急性胰腺炎患者外周血线粒体DNA水平变化及其对合并急性肺损伤的预测价值
赵雅彬 李琨琨 张志伟 杨宁 运苛政 王宝玉
急性胰腺炎(AP)指多种病因激活胰腺内胰酶引起胰腺组织自身消化、水肿、出血甚至坏死的炎症反应[1]。临床上根据疾病严重程度将其分为轻症急性胰腺炎(MAP)及重症急性胰腺炎(SAP)[2]。肺是AP疾病进展过程中最易受到损伤的脏器[3],相关统计数据显示,约15%~60%的SAP患者伴不同程度急性肺损伤(ALI)[4],既往常采用急性生理学与慢性健康状况评分系统(APACHE)Ⅱ评分联合改良器官衰竭(MarshaⅡ)评分系统动态评估AP病情变化,但该方法主观性较强,预测器官功能衰竭效能相对较差,探索更为有效的客观指标评估AP合并ALI具有重要意义。既往研究结果证实,AP患者机体存在血脂水平异常、胰岛素抵抗等多种能量代谢失衡现象,易诱发线粒体DNA(mtDNA)转录、蛋白合成障碍,最终导致线粒体功能障碍乃至细胞死亡[5]。mtDNA序列变化与线粒体功能密切相关,既往研究发现尿毒症、糖尿病、脓毒血症等多种疾病患者外周血mtDNA水平存在异常,影响患者疾病进展[6-7],但AP患者外周血mtDNA水平是否存在异常尚未明确。本研究旨在观察AP患者外周血mtDNA水平变化,评估其对AP合并ALI的预测价值,以期提高AP合并ALI的检出率,便于医生及时调整治疗计划以提高治疗效果。
对象与方法
1.对象:将2020年2月~2022年2月我院收治的90例AP患者按照疾病严重程度分为轻症组(55例)和重症组(35例)。纳入标准:(1)符合《中国急性胰腺炎诊治指南2019》[8]中AP的相关诊断标准:血清淀粉酶≥正常值上限3倍,氧合指数≤200 mmHg,且经影像学或生化检查确诊为AP;(2)无认知功能障碍且依从性良好;(3)APACHEⅡ评分≥8分;(4)临床资料完整。排除标准:(1)合并血液系统疾病、心脑血管疾病、自身免疫疾病或呼吸系统疾病;(2)合并恶性肿瘤;(3)严重外伤或近3个月内接受过重大外科手术。选取同期于我院体检的40例健康志愿者作为对照组。其中,轻症组患者男29例、女26例,年龄24~69岁,平均年龄(42.18±10.07)岁;重症组患者男19例、女16例,年龄25~67岁,平均年龄(42.37±10.13)岁;对照组受试者男21例、女19例,年龄25~64岁,平均年龄(42.28±10.02)岁。3组受试者性别、年龄比较差异均无统计学意义(P>0.05),具有可比性。根据AP急性反应期是否发生ALI将90例AP患者再分为ALI组(32例)和非ALI组(58例)。诊断标准:MAP:符合上述AP诊断标准,无腹痛、胰腺局部并发症、器官功能障碍;SAP:符合上述AP诊断标准,出现严重腹痛、胰腺并发症,且存在时间≥48 h的持续性器官功能衰竭。ALI:符合《急性肺损伤/急性呼吸窘迫综合征诊断和治疗指南》[9]中ALI诊断标准,且临床有进行性呼吸困难、低氧血症等症状,肺部X线检查结果示双肺存在斑片状阴影。本研究已通过我院医学伦理委员会审核批准,所有受试者均知情同意。
2.方法:收集所有AP患者一般资料(性别、年龄、BMI)及临床资料,临床资料包括致病原因及实验室相关指标[降钙素原(PCT)、甘油三酯(TG)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、WBC计数、白蛋白(ALB)、血细胞比容(HCT)、空腹血糖(GLU)、脂多糖(LPS)、C反应蛋白(CRP)、血淀粉酶(AMY)、钙离子(Ca2+)、mtDNA]。收集对照组受试者的一般资料及外周血mtDNA水平。
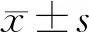
结 果
1.对照组、轻症组及重症组受试者外周血mtDNA水平比较:重症组、轻症组及对照组受试者外周血mtDNA水平依次降低(P<0.05),见表1。
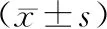
表1 对照组、轻症组及重症组受试者外周血mtDNA水平比较
2.ALI组和非ALI组患者临床资料比较:ALI组患者CRP、AMY、Ca2+及mtDNA水平均高于非ALI组(P<0.05),两组患者其余指标比较差异均无统计学意义(P>0.05)。见表2。
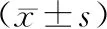
表2 ALI组及非ALI组患者临床资料比较
3.影响AP合并ALI的危险因素分析:Logistic回归分析结果显示,CRP、AMY、Ca2+及mtDNA水平升高均为影响AP合并ALI的独立危险因素(P<0.01)。见表3。
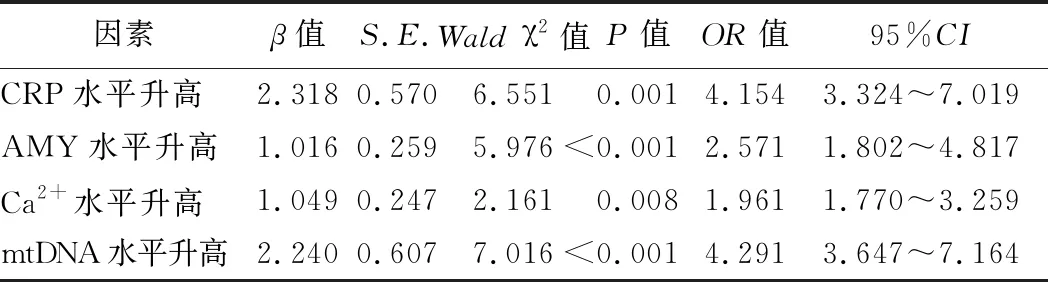
表3 影响AP合并ALI的logistic回归分析
4.外周血mtDNA水平对AP合并ALI的预测价值:ROC曲线分析结果显示,外周血mtDNA水平预测AP合并ALI的ROC曲线下面积(AUC)为0.817,对应敏感度和特异度分别为84.27%及75.01%。见图1。
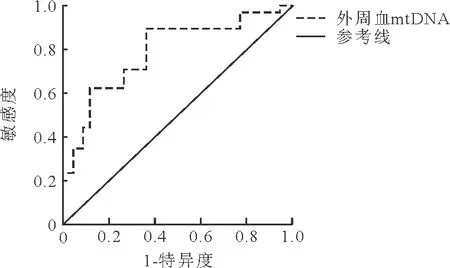
图1 外周血mtDNA水平评估AP合并ALI的ROC曲线
讨 论
线粒体是机体进行氧化磷酸化的场所,氧化磷酸化可生成大量氧自由基(ROS),当机体ROS超过自身抗氧化系统清除水平时,mtDNA极易受氧化应激的影响而发生氧化损伤,所造成的线粒体功能障碍与AP、糖尿病、脓毒症等多种疾病相关[10]。ALI是AP患者常见并发症之一,有研究发现,机体中性粒细胞过度激活后释放大量炎性细胞因子,诱发全身炎症反应,产生的炎症递质于肺组织聚集、活化[11],这是AP合并ALI的主要病理机制。本研究结果显示,重症组、轻症组及对照组受试者外周血mtDNA水平依次降低,即AP患者病情越严重,外周血mtDNA水平越高,与Wu等[12]研究结果类似,表明外周血mtDNA水平与AP的发生有关。mtDNA编码多数为氧化磷酸化酶复合体,当AP发生时,机体抗氧化系统紊乱,生成大量氧化介质及其衍生物使mtDNA氧化或出现无碱基位点,此时线粒体外膜透过率升高,透过大量超氧阴离子损伤线粒体并诱导细胞凋亡,细胞器极度损伤后机体启动极端动力学机制,从而引发mtDNA异常[13-14]。
本研究结果亦显示,ALI组患者CRP、AMY、Ca2+、mtDNA水平均高于非ALI组,表明上述指标可能与AP合并ALI有关。进一步行logistic回归分析发现,CRP、AMY、Ca2+、mtDNA水平升高均为影响AP合并ALI的独立危险因素。CRP具有促进吞噬、激活补体、调节T细胞免疫等作用,其水平可反映机体炎症程度及组织损伤程度。AP发生时,机体微循环血流量降低,生成的大量血管活性物质可与体内超氧阴离子结合生成强氧化物,其损伤肺组织后可诱发CRP释放,CRP又可诱导ROS形成而加重肺损伤。此时线粒体供能障碍,能量代谢失衡后负反馈于AP,形成恶性循环。机体正常状态下,细胞内主要依靠线粒体、内质网、细胞膜等调节Ca2+转运,使细胞内始终维持低钙稳态,当大量胰酶、内毒素释放入血并随循环系统至肺脏后,肺泡细胞膜上Ca2+-ATP通道受到抑制,大量Ca2+内流导致钙超载,ATP能量衰竭后进一步激活ROS、磷脂酶等物质,加重肺组织损伤程度,这可能是AP合并ALI患者Ca2+水平升高的主要原因[15-16]。此外,本研究ROC曲线分析结果显示,外周血mtDNA水平预测AP合并ALI的AUC为0.817,其对应的敏感度及特异度分别为84.27%及75.01%,表明外周血mtDNA可作为诊断AP合并ALI的生物学指标,相较于既往动态评估法,外周血mtDNA水平预测AP合并ALI不受患者主观意识影响,更具客观性。临床可进一步探索外周血mtDNA在AP合并ALI的发生、进展中的作用。
综上所述,AP患者外周血mtDNA水平越高,病情越严重,且AP合并ALI的危险因素众多,其中mtDNA对AP合并ALI具有一定预测价值。因选取样本量有限,本研究相关结论仍需大样本多中心临床试验进一步佐证。

