混合加热反应器内Ca(OH)2/CaO热化学储能体系实验
张志浩,靳晓刚,包恒兴,凌 祥
(南京工业大学机械与动力工程学院,江苏 南京 211816)
发展可再生能源日益成为减少二氧化碳排放的一种可行方案[1]。向可再生能源的转变增加了开发可靠的能源存储系统以补偿其并网所带来波动的紧迫性[2]。储热(thermal energy storage,TES)是最具潜力的储能技术之一,一方面因为很大一部分能源消耗的形式也是热利用[3];另一方面,TES的能源来源更加广泛且廉价,因而具有更广泛的应用场景,成本也相应较低[4]。
常用的TES方法包括显热储热、潜热储热和热化学储能(thermochemical energy storage,TCES)[5]。与目前相对较成熟的显热和潜热储热技术相比,TCES具有储能密度高、存储时间长、环境温度下热损失少等优点[6],是未来可再生能源社会最具前景的技术之一[7]。在众多TCES体系中,氢氧化物体系因其环境友好[8]、廉价[9]、储能温度范围广[10]等特点受到了广泛关注。用于TCES 的氢氧化物体系主要有两种:MgO/Mg(OH)2、CaO/Ca(OH)2。基于钙循环(CaL)的CaO/Ca(OH)2TCES 体系因其较高的储能密度(693 kWh/m3[11])而受到广泛关注。Ca(OH)2/CaO的脱水/水化过程如式(1)所示,其反应温度一般在400~650 ℃[12]。
Ca(OH)2(s)+ ΔH⇌ CaO(s)+ H2O(g)ΔH=104.4 kJ/mol (1)
Ervin[13]最早提出将CaO/Ca(OH)2体系应用于TES系统。Schaube等[8]在505 ℃、105Pa H2O分压下测定了反应焓(104.4 kJ/mol)。Criado等[14]研究了CaO/Ca(OH)2的反应机理,实验结果与缩核模型吻合良好。这些研究指出,Ca(OH)2/CaO TCES体系由于力学性能较差,使得该反应容易造成团聚现象从而降低反应活性。为了解决这个问题,诸多学者提出了许多新型的复合材料[15-23]。
反应器作为储能系统最重要的组成部分,在很大程度上决定了Ca(OH)2/CaO TCES体系的蓄热性能。为此,Ca(OH)2/CaO TCES体系在反应器水平上的反应行为也越来越多地被国内外学者所研究。用于CaO/Ca(OH)2体系的反应器形式主要有3种:直接式、间接式、连续式[24]。Schaube 等[25]开发了一种直接传热反应器。实验结果表明,换热速率和颗粒反应速率是热通量的主要限制因素。Schmidt 等[26]设计了一个间接传热的反应器,并通过实验计算了其峰值功率(热功率约7.5 kW)。后续研究表明,CaO/Ca(OH)2反应速率对反应条件的微小变化高度敏感[27]。Yan等[28]探究了固定床反应器中CaO/Ca(OH)2体系的反应特性。在蓄热过程中,较高的脱水温度可提高储热量和蓄热效率(510 ℃和540 ℃时分别为47%和65%)。Azpiazu等[29]分析了添加翅片的固定床反应器中的储热性能。实验结果表明,改进后反应器的热效率提高了72.5%。Schaube等[30]报道称,流化床比热导率低的固定床反应器更适合作为反应器。Pardo等[31]在流化床反应器中研究了CaO/Ca(OH)2体系的流动特性,表明了反应物的难流化性。Criado等[32]提出了将流化床反应器应用于CaO/Ca(OH)2TCES系统的概念工艺设计。后续的研究[33]验证了鼓泡反应器模型的有效性,并指出快速脱水动力学导致相当大的相间传质阻力。
对于反应器设计,同时具有足够的传热、传质性能是反应器的主要困难所在。因为固体反应物导热性较差,当固体以松散的颗粒或粉末应用于气固反应时,其低导热性和低渗透性造成的传热、传质困难便更加显著[34]。固定床反应器由于其几何形状简单,在许多工业中仍被广泛应用[35]。到目前为止,固定床反应器仍是研究Ca(OH)2/CaO TCES体系最常用的反应器。Schaube等[36]比较了间接和直接类型的CaO/Ca(OH)2TCES固定床反应器,发现直接换热反应器的热性能优于间接换热反应器。为防止碳化降低反应的循环稳定性,应提高反应的脱水温度[29]。
对于储能反应而言:直接式反应器改善了反应中的传质性能,但是气体的比热容较低,不利于储能反应的能量输入;而间接式反应器,可有效提供反应所需的能量输入,但受固体反应物颗粒恶劣导热性能的限制。本研究设计了一个间接和直接混合加热的固定床反应器实验平台,进行了空气氛围下典型的储/释热实验,探究了混合加热反应器内的储热特性与限制因素。在此基础上,提出了在反应器尺度改善循环性能的可行方案,为CaO/Ca(OH)2TCES体系的工业应用提供了参考。
1 研究方法
1.1 材料与设备
本实验采用的氢氧化钙粉末[Ca(OH)2,纯度>95%]由国药集团化学试剂有限公司提供。相比较于氢氧化钙的理论密度2200 kg/m3[8],实验测得的粉末堆积密度为517.65 kg/m3。
图1展示了实验台与实验流程。其中,空气压缩机[BLT-10A/8(1.25 m3/min,0.8 MPa)]由博莱特(上海)压缩机有限公司提供,主要作用是提供传热、传质流体;蒸汽发生器[LDR3-0.4 (4 kg/h,0.7 MPa)]由上海贯申机械设备有限公司提供,主要作用是提供与反应器内合成反应所需的水蒸气。空气加热器(15 kW)由南京宝色股份公司和宜兴市康达窑炉耐火材料有限公司联合定制,材质为310 S,用来提高气体的温度。缓冲罐由南京信创宏齿轮有限公司制作,材质为304不锈钢,主要用途是稳定气体流量和测量气体的性质,包括湿度、压力、温度等。冷却器(304 不锈钢)由南京天沃节能环保科技有限公司生产。以水为冷却介质,主要用于冷却出口气体。反应器(304不锈钢;内径125 mm;壁厚5 mm)由宜兴市康达有限公司提供,主要作用是实现CaO/Ca(OH)2储/释能过程。

图1 实验台Fig. 1 Experimental platform
实验数据采集系统包括NI数据采集器、湿度计、CO2浓度检测仪、压力计、压差变送器、热电偶和涡街流量计。表1列出了这些采集装置的参数细节。

表1 测量仪器的详细参数Table 1 Details of the measuring instruments
1.2 实验流程
实验分为冷态实验、储热实验、储释热连续实验。冷态实验用来确定实验过程中反应物处于固定床状态;储热实验用于探究典型储热过程的反应特性,并在循环实验基础上研究在储热阶段恢复反应性能的可行方案;储释热连续实验,用于研究连续反应的特性和循环反应的性能下降原因。
反应器通过直接与间接混合加热的方式为蓄热过程提供热量。热空气经气体分布器从底部分散后进入反应器。压缩机产生的空气通过气体加热器加热至反应温度,反应器壁面采用陶瓷加热带加热。反应初始时反应器中均匀填充有500 g的新鲜Ca(OH)2粉末。
1.2.1 冷态实验
为了确保实验中反应物处于固定床状态,测定了不同空气流量下的床层压降。如果流量增加过程中的床层压降变化规律与前人研究[37]是吻合的,则表明实验过程中的流量处于固定床范围内。固定床中流体流速和压差关系可用经典的Ergun公式[37]来表达:

式中,Δp为具有H高度的床层上下两端的压降;ε为床层孔隙率;dv为单一粒径颗粒等体积当量直径,对非均匀粒径颗粒可用dp即等比表面积平均当量直径来代替;u为流体的表观速度,由总流量除以床层的截面积得到。
1.2.2 储热实验
对Ca(OH)2/CaO TCES体系储热过程的实验研究分为干燥和反应两个阶段。初始时将反应物加热并维持至低于反应温度,使实验系统和反应物干燥。当进出口湿度相等时,将空气温度和反应器壁温提高到反应温度,并保持到反应结束。Ca(OH)2在加热过程中逐渐分解,转化率计算如下:

式中,X为转化率;n为物质的量。
水蒸气的物质的量nH2O可以用如下公式计算:
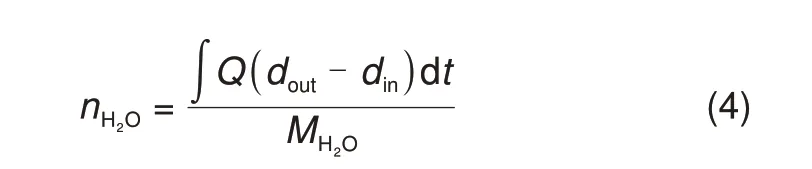
式中,Q为空气的质量流量;t为反应时间;MH2O为H2O的摩尔质量;d为绝对湿度,可以通过下式计算:

式中,B为混合气体的压力;φ为相对湿度,可以通过湿度计测量得到;ps为水蒸气对应温度下的饱和压力。
ps(0~200 ℃)可以用下式计算[38]:

1.2.3 储释热连续实验
在上述储热实验过程结束后,降低通入的空气温度和壁面温度。待反应物温度降低至合成反应温度,维持一段时间直至反应物温度分布均匀,开启蒸汽发生器阀门,经缓冲罐与空气混合后在气体加热器进一步升温,通入反应器内进行合成反应。相应的合成反应转化率用式(7)表示。重复储能实验与释能实验,进行循环实验。

式中,X为转化率;n为物质的量。
1.2.4 不确定性分析
实验测量仪器的精度列于表1中。测量的不确定度可以通过式(8)、式(9)[35]计算得到。经计算,本实验测量结果的不确定度小于1.2%。

式中,ai为测量值xi的最大误差界;u(xi)为测量值的不确定度;uc为计算值的不确定度;f为测量值xi与计算值之间的函数关系。
2 结果与讨论
2.1 冷态实验
图2 展示了床层压降与流体流速的关系。如图2(a)所示,流过固定床的流体,其压降随着流体流速的增加而增大,流体压降与流速之间的关系近似于线性关系,即Ergun公式[式(2)][37]。当超过一临界值时压降与流速不再满足Ergun公式,此时床层由固定床向流化床转变。图2(b)展示了实验过程中测得的床层压降与流量之间的关系,可以发现,床层压降随流量近乎线性增加,表明实验过程中的流速未超过临界流速,反应床处于固定床状态。

图2 流量与床层压差关系Fig. 2 Relationship between flow rate and bed pressure
2.2 储热实验
图3展示了混合加热反应器内Ca(OH)2/CaO TCES体系典型储热过程的实验结果。实验中,进口气体流量约2.5 m3/h,反应器壁面与进口气体温度加热至550 ℃进行反应。图3(a)展示了实验过程中,反应物内部各测点的平均温度与进出口湿度的关系。干燥阶段使得进出口湿度平衡之后,迅速将温度提高至反应温度,进出口湿度差随反应进行逐渐变大,在最大反应速度后逐渐减小,直至反应结束。图3(b)展示了实验过程中进口温度、反应器壁面温度与反应物内各测点温度的变化趋势,贴近壁面和入口处的反应物温度迅速提升至局部水蒸气压力下的平衡温度后,发生分解反应而存储热量,该部分的分解反应结束后热量才得以更多地传导至反应器内部的反应物,因此远离壁面和进口的反应物升温更为滞后。对比发现:轴向上,1、2、3点的升温速度依次递减;径向上,2、4、5点的升温速度依次递减。这表明,采用直接与间接混合加热的方式,使得反应呈现向心推进与逐层推进相结合的形式。

图3 储热实验Fig. 3 Thermal storage experiments
根据式(4)计算实验过程中的脱水量,进而根据式(3)计算反应过程中氢氧化钙的转化率。本次储能实验过程中的转化率变化表现如图4 中的“1 次循环”曲线。转化率曲线的斜率表示反应速率,初始时反应速率逐渐增快,而后逐渐减慢。这可以通过反应动力学方程(10)[39-40]解释:

图4 不同次循环后储能反应转化率Fig. 4 Conversion rate of energy storage reaction after different cycle

式中,A为反应的指前因子;E为反应的活化能;平衡温度Teq是水蒸气分压的函数。
初始时,随着温度的升高,动力学方程(10)中的Arrhenius 常数随温度升高而增大,并且当前温度与局部压力下平衡温度的差值也随温度的升高而增大,同样促进了反应的进行,因此在这个阶段反应随温度提高而加快。反应进行到一定程度时,氢氧化钙浓度的降低占据反应速率的主要影响,反应随着氢氧化钙浓度的降低而逐渐减慢。
2.3 储释热连续实验
图5展示了储释热连续实验过程中温度与进出口湿度的变化趋势。反应分为5个阶段:升温阶段(Ⅰ)、储热反应阶段(Ⅱ)、降温阶段(Ⅲ)、释热反应阶段(Ⅳ)、散热阶段(Ⅴ)。储热反应阶段,壁面传入的热量与热空气直接接触换热提供的热量致使局部温度提升,而Ca(OH)2分解过程中吸收大量的反应热使得局部温度降低。相应地,释热反应阶段,通过壁面与气体带走的热量使得局部温度降低,而合成反应放出的大量反应热使得局部温度提高。因此,每一点的温度变化曲线都是在两方面共同作用下产生的。

图5 储释热连续实验温度变化趋势Fig. 5 Temperature variation trend of heat storage and release in continuous experiment
对比Ⅳ阶段释热反应过程中各监测点的温度变化可以发现:轴向上1、2、3点的升温速度依次递减;径向上,2、4、5点的升温速度基本同步,这与已有的研究结果[30]相吻合。这主要是因为水蒸气流经反应物时随反应进行被吸收,H2O的摩尔分数在轴向上逐渐减少,相应的H2O分压逐渐降低,动力学方程(10)中的Teq减小,则平衡温度项减小,从而使得反应速率沿轴向逐渐减慢。
对比温度变化与进出口湿度差的变化规律发现,释热反应的速度高于储热反应。这一方面是因为储释热过程的动力学参数差异;另一方面,从传热的角度来看,上述储热实验表明混合加热的反应器内,反应呈现向心推进与水平推进相结合的形式,这在一个侧面表明了热量输入的困难所在:固体颗粒物恶劣的导热性能限制了热量的输入,粉末堆积造成的额外热阻更加剧了这个过程的难度。相比较而言,释热反应的热量直接通过过量的水蒸气和空气的混合物带走,降低了热量输出的难度。因此,增强储热过程的热输入性能是目前研究的重要挑战之一。
图5展示了不同次循环后储热阶段反应物的转化率,这些转化率是按照初始的Ca(OH)2量计算的。对比发现,随循环次数的增加,反应的最高转化率逐渐降低。相比较于初次循环的转化率,5次循环后的储能反应转化率降低了5.6%,10 次循环相较于5 次循环的反应最大转化率降低了3.8%。这可能由两方面原因造成:随循环次数的增加材料的团聚加剧,造成了循环性能的降低[22];空气中的CO2与CaO/Ca(OH)2反应生成少量的CaCO3[41]。
2.4 储热阶段反应性能恢复实验
上述研究过程中发现,随循环次数的增加,储能过程反应转化率逐渐下降。为了探究造成循环性能下降的原因,并提出在反应器尺度改善循环性能的可行方案,首先测定了不同循环次数下的反应物粒径与不同次循环后反应物的热重(TG)实验。图6展示了不同循环次数的反应物粒径测试结果,对比容易发现,反应物的平均粒径相差不大,10次循环的粒径相比较于原始反应物,粒径仅增大了0.07 µm,这侧面说明了造成循环性能下降的主要因素并非团聚的影响。为了进一步验证空气中CO2的影响,将10次循环后与初始的反应物进行了TG实验,其测试结果如图7所示。对比发现,10次循环后的反应物有两次明显的失重过程:450 ℃附近、650 ℃附近,分别对应了Ca(OH)2与CaCO3的分解温度。表明致使循环性能下降的主要因素是空气中CO2的影响。

图6 不同循环次数反应物粒径对比Fig. 6 Particle size comparison of reactants with different cycles
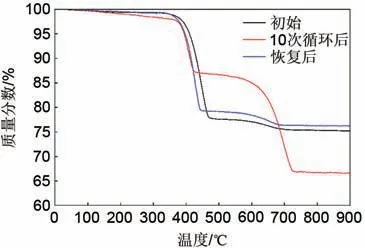
图7 不同循环次后与升温恢复后反应物TG实验对比Fig. 7 TG test comparison of reactants after different cycles and recovery after improve temperature
为了消除这种影响,在储能实验过程中将反应器壁面与进口气体温度提高至650 ℃,图8展示了反应物平均温度与进出口CO2浓度的变化趋势。随反应物温度升高脱水反应进行,待温度超过水解温度后继续升高温度,可以观察到出口CO2浓度逐渐升高。出口CO2浓度超过进口时表明反应中吸收的CO2逐渐析出。为了检测储能反应阶段过余温度消除空气中CO2带来的影响的效果,将反应性能恢复之后的反应物进行了TG实验,如图7“恢复后”所示。对比发现,相较于10 次循环后的反应物,反应活性恢复有效降低了反应物中的CaCO3含量。

图8 反应物平均温度与进出口CO2浓度Fig. 8 Average temperature of reactants and CO2 concentration of inlet and outlet
3 结 论
本工作建立了一个直接与间接混合加热的固定床反应器实验平台。进行了空气氛围下的储/释热实验,探究了混合加热反应器内的储热特性与限制因素,并在此基础上探究了在反应器尺度改善循环性能的可行方案。研究得到的主要结论如下。
(1)储热实验研究表明,采用直接与间接混合加热的方式,使得反应呈现向心推进与逐层推进相结合的形式,增进了储能反应的速率。
(2)储释热连续实验表明,5 次循环后的储能反应最大转化率降低了5.6%,10次循环相较于5次循环的反应最大转化率降低了3.8%,随着循环次数增多,反应性能逐渐下降。
(3)TG实验与粒径测试结果表明,空气中CO2是造成循环性能下降的主要因素。
(4)储热阶段反应性能恢复实验表明,提高脱水温度可以有效恢复循环性能,650 ℃时所提供的过余温度可以有效降低反应物中CaCO3的含量。
符号说明
A——指前因子,s-1
d——绝对湿度,kg/m3
E——活化能,J/mol
M——摩尔质量,kg/mol
n——物质的量,mol
Δp——床层压降,Pa
Q——流量,kg/s
u——流体速度,m/s
X——转化率,%
ε——孔隙率
φ——相对湿度,%

