选择性门静脉栓塞治疗胆漏相关性肝脓肿1例*
张 跃 刘有顺 王 昊 韩 涛 陈挺松
(上海中医药大学附属第七人民医院肿瘤二科,上海 200120)
胆漏是肝胆外科手术及肝动脉化疗栓塞(transcatheter arterial chemoembolization,TACE)的重要并发症之一[1,2],是指胆汁通过异常的病理性通道进入到腹腔或肝实质内,造成感染性腹膜炎、术区积液积脓或胆源性肝脓肿。肝胆外科术后胆漏发生率可高达6.4%[3,4]。胆漏的治疗可分为外科手术治疗和非手术治疗两大类,非手术治疗包括经皮穿刺引流、腹腔穿刺引流及内镜治疗。胆源性肝脓肿的治疗往往需要几种手段联合,迁延不愈,治疗周期较长。二次外科手术因创伤较大常作为非手术治疗方法失败后的选择。对于经皮穿刺引流、内镜治疗可能无法达到良好治疗效果的复杂性胆漏相关性肝脓肿,选择性门静脉栓塞(portal vein embolization,PVE)治疗不失为二次外科手术治疗前的一种微创方式的尝试。PVE治疗胆源性肝脓肿在临床并不多见。我们对国内外相关文献进行检索,PVE治疗胆源性肝脓肿的报道仅有几例个案,现阶段临床对于PVE治疗胆源性肝脓肿还没有充分认识。2020年,我院应用选择性PVE治疗复杂性胆漏相关肝脓肿1例,报道如下。
1 临床资料
患者男,50岁,乙肝肝硬化病史,2019年9月因“肝右叶占位”于外院行肝右前叶Ⅷ段切除+胆囊切除术,术后病理示肝门部胆管癌。术后行周期性TACE 3次,末次TACE为2020年1月16日。2020年2月3日、3月1日2次因反复高热伴寒颤于当地医院就诊,化验检查提示肝脓肿并发脓毒血症,内科药物治疗症状好转后出院。3月18日因高热伴寒颤于当地医院就诊,行彩超引导下经皮肝脓肿穿刺引流术,术后留置3根引流管(10F、10F、8F)于肝右后叶脓液区。4月21日因反复发热,最高体温39.8 ℃,伴寒颤及上腹部不适,外院CT检查考虑右肝脓肿,穿刺引流及抗生素治疗无效,转诊于我院治疗。
入院后行上腹部CT平扫(图1),提示肝癌术后TACE术后,多发肝脓肿,位于肝右后叶,最大直径约5 cm。血常规白细胞2.98×109/L[正常值(3.5~9.5)×109/L],C反应蛋白50.8 mg/L(正常值<5 mg/L),降钙素原0.53 ng/L(正常值<0.03 ng/L),总胆红素12.5 μmol/L(正常值<21 μmol/L)。影像学检查提示脾大,结合化验考虑脾功能亢进可能性大。分别于4月24日(脓肿引流管调整)、4月29日(脓肿引流管调整、经皮肝脓肿穿刺抽吸)2次行彩超引导下多点经皮经肝脓肿穿刺抽脓及引流,引流出墨绿色脓液共约300 ml,脓液黏稠不易流出。脓液总胆红素126 μmol/L。引流液病理提示红细胞、黄染胆汁样物,未见明确异型细胞。脓液培养提示铜绿假单胞菌,药敏试验提示左氧氟沙星敏感。给予左氧氟沙星0.75 g静滴每日一次抗感染治疗5天,仍反复发热,最高体温38.7 ℃,伴寒颤、上腹部不适。4月26日上腹部增强CT见肝右叶多发脓肿,体积与前片比较无明显缩小,3根引流管在位;MRCP未见明显胆管狭窄及扩张(图2)。诊断胆漏并发复杂性肝脓肿,因脓肿病情迁延,引流及药物抗感染治疗效果不佳,脓肿位于肝右叶实质内,内镜治疗可能效果不理想,与患者、家属充分沟通后,于5月11日行经皮经肝门静脉右支栓塞术。
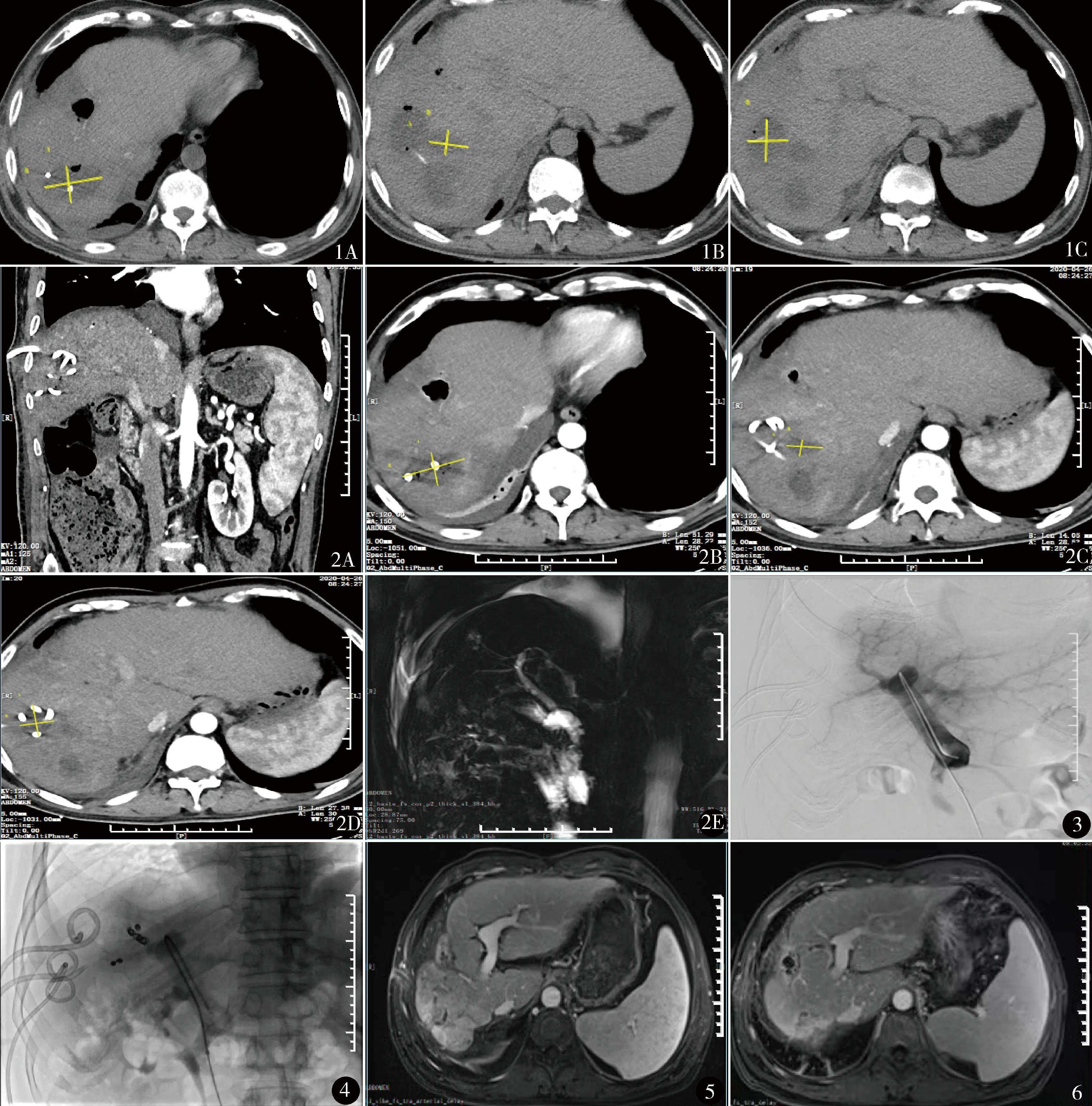
图1 入院时(2020年4月21日)上腹部CT平扫,提示肝右后叶多发脓肿:A.肝右叶近膈顶处低密度影,大小5.0 cm×3.1 cm;B.肝右前叶一低密度影,大小1.9 cm×3.1 cm;C.肝右叶另一低密度影,大小3.6 cm×3.3 cm图2 置入3根引流管33天(2020年4月26日)复查增强CT(A~D),显示3根引流管在位,脓肿无明显变化;MRCP(E)未见明显胆管狭窄及扩张 图3 PVE治疗前门静脉造影,门静脉右主干有2个分支 图4 PVE术后门静脉造影见门静脉主干、门静脉左支显影,右支不显影 图5 PVE术后4个月复查MRI,肝右叶萎缩,脓肿基本消失,1根引流管在位 图6 PVE术后7个月复查MRI,肝右叶萎缩,脓肿完全消失
术前造影见门静脉右主干有2个分支(图3)。超选导丝进入右下门静脉分支,注入明胶海绵与造影剂混悬液5 ml,置入2枚弹簧钢圈,同样方法栓塞门静脉右上分支,造影见门静脉主干、门静脉左支显影,右支不显影(图4)。术后继续保肝、左氧氟沙星抗感染等治疗。术后第6天实现体温连续3日保持正常,停用左氧氟沙星,第7天拔出2根肝右下叶引流管,带1根肝右上叶引流管出院。术后1个月(6月13日)复查,无发热、腹痛、黄疸等不适,1根肝右上叶引流管引流量30~40 ml/d。术后4个月(9月12日)复查MRI,肝右叶萎缩,脓肿基本消失,1根引流管在位(图5)。无发热、寒颤、腹部不适等症状,影像学检查提示脓肿基本消失,9月15日拔除引流管,操作过程顺利,无明显不适。由于临床症状消失,腹部体征基本正常,影像学检查提示脓肿基本消失,故认为胆漏并复杂性肝脓肿痊愈。术后7个月(2020年12月18日)周期性入院复查,无腹痛、发热、寒颤等不适,腹部MRI提示肝右叶脓肿完全消失(图6),血常规提示白细胞2.26×109/L,C反应蛋白0.5 mg/L,降钙素原<0.02 ng/L,总胆红素12.5 μmol/L,均正常。
2 讨论
胆漏临床表现主要为腹痛、发热、黄疸等,长期可形成复杂性肝脓肿。胆漏相关性肝脓肿诊断依据[5]:腹腔、肝周或肝内积液总胆红素>5 mg/L(10.5 μmol/L)或高于血清总胆红素3倍,引流液证实为胆汁,或胆道造影证实胆漏。本例经皮经肝穿刺引流脓液总胆红素126 μmol/L,且高于血清总胆红素3倍,病理检查见黄染胆汁样物,结合相关化验检查,证实为胆漏并发肝脓肿。并且本例具有如下几个特点,符合复杂性肝脓肿的特点:①应用敏感抗生素及穿刺引流后仍反复发热伴寒颤、上腹部不适;②影像学检查提示肝内多发脓腔,较大者有多发间隔,反复调整引流管仍难以实现通畅引流;③肝脓肿脓腔内大量坏死黏稠组织难以引出。
依据胆漏分级标准[6],本例为需要临床干预及管理但暂不需要二次手术的B级胆漏,胆道减压、内镜下胆道引流、内镜下括约肌切开和胆道支架置入常常治疗效果一般,以致肝脓肿迁延不愈。本例胆道MRCP未见胆管狭窄、扩张,故内镜下治疗可能无效;因患者一般情况欠佳,病灶多发并分散于肝右叶,胆漏位置不确定,外科手术指征不足。如何有效治疗该级别胆漏是临床难点。
PVE最初用于增加余肝体积,以提高肝切除的安全性,扩大肝细胞癌的手术指征,同时尽量减少术后肝功能障碍[7,8]。近年来的研究显示,PVE对复发性胆漏有较好疗效,其机制可能为通过门静脉调节栓塞肝及非栓塞肝的营养血流,促使栓塞肝萎缩及非栓塞肝代偿增大[8]。肠肝循环合成胆盐的速率是调节胆汁分泌量的最重要因素。大多数胆盐在回肠末端被重新吸收,并通过门静脉返回肝脏。因此,PVE可以通过减少栓塞肝侧胆盐合成及栓塞肝萎缩失用双重机制减少胆汁分泌[8~10]。2002年,Yamakado等[11]报道PVE治疗难治性胆漏1例获得成功。本例为晚期肝门部胆管癌,部分肝切除+胆囊切除术后复杂性多发性胆漏并肝脓肿,肝脓肿已经形成分隔,经内科保守治疗、引流治疗均失败,行右前叶上段门静脉(门静脉右支)栓塞,术后第7天发热得到控制并拔除2根脓肿引流管,达到理想的治疗效果。针对本例经穿刺引流、引流管调整、穿刺抽吸及内科抗炎等治疗无效,经评估内镜治疗及手术治疗无法达到良好治疗效果,PVE治疗的成功为类似病例提供了较好的借鉴。对于无内镜治疗指征且无法耐受外科手术的难治性胆漏,穿刺引流及内科抗炎治疗失败后,PVE可能是相对安全有效的一种治疗选择。

