基于Illumina RNA-Seq分析的三种内分泌干扰物对斑马鱼神经毒性效应与机制
郭子一,王伟伟,宋 杰,王慧利*
基于Illumina RNA-Seq分析的三种内分泌干扰物对斑马鱼神经毒性效应与机制
郭子一1,王伟伟2,宋 杰1,王慧利1*
(1.苏州科技大学,江苏 苏州 215009;2.温州医科大学,浙江 温州 325035)
三氯生、三氯卡班和双酚A均具内分泌干扰作用,但从转录组学层面上揭示其靶分子及神经毒性机制鲜有报道,因此,本文借助RNA-Seq测序获得它们暴露斑马鱼幼鱼的转录组数据,基于生物信息分析证明:三种药物暴毒组差异表达基因(DEGs)的GO功能和KEGG代谢途径富集在生物过程、细胞组成和分子功能上,富集的DEGs数量和功能均不同,在神经相关途径上均有富集,但具体信号通路和途径不同.PPI网络节点关联度计算发现:富集在神经通路的Hub基因也不同,且与神经标志功能基因之间存在丰富间接的互作网络.将DEGs与TCGA数据库中胶质母细胞瘤GBM突变基因整合,证实其环境暴露均有诱发GBM风险,但发生途径和调控信号通路不同,故从分子水平上解析了三种污染物诱导神经毒性机制的根源.
内分泌干扰物;斑马鱼;转录组测序;神经毒性;神经胶质母细胞瘤
环境内分泌干扰物(EDCs)是一类广泛存在于环境中,可干预生物体内源激素的合成、分泌、转运、降解过程,对生物体的生殖、免疫、内分泌和神经各大系统造成伤害的化学物质[1],其污染问题已经受全球重点关注.EDCs主要来自医药或农药中,也用于塑料、洗涤剂、涂料及化妆品等.自然环境中EDCs含量较低,多数以10-12浓度或者10-15浓度为主,然而由于目前工业生产废气、生产生活废水、农药的残留沉降、垃圾填埋物等污染,自然环境中EDCs含量逐渐增多[2].近期的体内、体外实验和流行病学研究表明,EDCs暴露增加了精神退行性疾病、肥胖、代谢综合征和2-型糖尿病的发生的风险[3].2022年5月,国务院办公厅印发的《新污染物治理行动方案》中环境内分泌干扰物被列入需加强风险管理的新污染物范畴.这类化学物质污染的毒性效应已成为新的公共卫生问题,引起全世界高度关注.
三氯生(Triclosan, TCS)和三氯卡班(Triclocarban, TCC)均为高效广谱性杀菌剂,广泛应用于医药、精细化工等领域[1].其大量频繁使用产生的“二次污染”对生态环境隐患已成不争的事实[2-3].尽管2016~2017年美国FDA禁止二者在手皂和沐浴露中使用,2019年在临床护理、洗手液和牙膏产品中禁用,但是,其仍被添加到各种家庭和工作场所的领先品牌产品中,在世界范围内销售.目前,全球TCS和TCC的年产量分别约为1.05×105t,7.5× 105t.TCC在中国的年产量超过6000t[3],经污水处理厂处理后的出水有3%以上的TCC残留,其已被美国国家环境保护局列入最常见的十大水污染物之一[4].由于TCS (logow=5.46) 和TCC(logow=4.9)的亲脂性比较强,故有较强的生物蓄积、生物放大作用.研究者在水藻、鱼虾,甚至80%妇女的乳汁和脐带血中均检出二者的存在[5].TCS和TCC的化学结构近似于非固醇类激素,与典型的内源激素干扰物双酚A(BPA)、多氯联苯和多溴联苯醚等结构的相似性可预测其潜在的(抗)雄或雌激素效应.越来越多的体内外实验也证实了它们作用于免疫、生殖、神经三大系统并会干扰人和动物的内分泌系统.虽然目前致代谢紊乱、免疫和生殖毒性研究已比较成熟,但对神经毒性效应及机制研究尚欠缺充足数据.
由于不同污染物作用受体、靶分子和致毒机制不同,给环境健康带来不同的风险,尤其是诱发神经相关疾病和机制还不明了.斑马鱼作为继小鼠之后的第二大脊椎模式动物,以其与人类基因超高相似度(87%)而被用于环境污染物的毒性研究模型[5].有研究表明,低剂量BPA暴露就会导致斑马鱼畸形率升高[6],神经元数量增多,导致斑马鱼过度活跃而出现多动症[7].而TCS会干扰鱼类的甲状腺,其对神经发育有重要作用[8].TCC除了改变胚胎神经元细胞的表观遗传状态,还会导致早期发育阶段脑神经元自噬[9-11].但大多数研究依旧局限于个体、组织器官或功能评判层面,故本研究选择斑马鱼为模式生物,以BPA、TCS、TCC为研究对象,利用转录组深度测序获取了三者急性暴露斑马鱼幼鱼的转录组数据,借助生物信息学分析,将其转录组数据与TCGA数据库整合分析,从分子层面上评判三种内分泌干扰物对水生生物的神经毒性效应,分析比较其作用靶标、作用途径、致毒机理及可能诱发神经相关疾病的异同,评判其诱发神经胶质瘤的潜在风险.为从分子水平上评判环境污染物健康风险与预警提供科学依据.
1 材料与方法
1.1 LC50的计算
在ChemDraw软件中分别绘制三种内分泌干扰物的结构式,以mol格式导出至Ecosar Applcation 软件,点击Submit进行数据处理,得出BPA、TCS、TCC三种内分泌干扰物的LC50预测值.再根据软件预测的LC50,选择浓度对斑马鱼进行梯度浓度暴露.胚胎从6hpf开始在培养皿中进行暴毒处理,每组50颗胚胎,每24h更换药液一次,其中BPA的梯度浓度分别为0, 5.5, 6.5, 7.0, 8.0, 9.0mg/L,TCS的梯度浓度分别为0, 0.20, 0.25, 0.30, 0.40, 0.50mg/L.TCC的梯度浓度分别为0, 100, 300, 350, 400, 500μg/L,分别统计在120hpf各暴露浓度对应的斑马鱼死亡率,获得剂量-效应关系曲线,50%死亡率的对应暴露浓度即为LC50.
1.2 斑马鱼的饲养与暴露
使用的实验动物为野生型斑马鱼AB品系,根据斑马鱼的养殖指南,雌雄母鱼分开饲养在专用养殖系统中.调节水温为(28.5±0.5)℃,pH值为6.8~7.5;设置为14h光照:10h黑暗循环周期,每d 08:00和18:00喂食两次新鲜丰年虾.
对照组、BPA组、TCS组、TCC组四组胚胎从6hpf开始在培养皿中进行暴毒处理,暴露浓度均为225μg/L每24h更换暴露药液1次,持续暴露至实验所需.
1.3 Illumina RNA-Seq测序
选取连续暴露在三种药物5d的斑马鱼幼鱼(5dpf),分别提取RNA,建立测序文库,采用Illumina Hiseq4000进行测序,测序读长为双端2*150bp.测序原始数据(Raw data)进行过滤去杂和质控分析,获得合格测序数据,测序数据以FPKM(Fragments Per Kilobase of exon model per Million mapped reads),即指在每百万测序碱基中每千个转录本测序碱基中所包含的测序片断数,表示基因在不同处理组中的表达丰度.将表达丰度不同的序列通过比对到Ensembl上最新的Zv9.0斑马鱼序列(ftp://ftp. ensembl.org/pub/release-66/fasta/danio rerio/dna/),获得全面转录本信息,并进行基因表达定量,按∣log2 (fold change)∣³1,-value <0.05的阈值选取所有阳性差异表达基因(DEGs)进行后续分析.
1.4 差异基因的GO功能分类和KEGG Pathway富集分析
将筛选出的DEGs及其差异变化倍数导入微生信在线分析网(https://www.bioinformatics.com.cn),根据基因标识以生物过程(Biological Process)、细胞组成(Cell Component)和分子功能(Molecular Function)进行GO功能分类及KEGG富集分析,GO功能分析作用是将筛选得到的差异表达基因进行GO功能条目富集,判断其显著相关的生物学功能,涉及生物过程(Biolo-gical Process)、细胞组成(Cell Component)和分子功能(Molecular Function)三方面.KEGG信号通路分析是对各处理组差异基因的代谢通路Pathway分析,寻找不同药物暴露下的差异基因可能与哪些细胞通路的改变有关.最终确定差异基因主要参与的GO Term及信号通路.
1.5 差异表达基因的蛋白互作分析
将筛选出来的DEGs导入STRING 11.0 (http: //www.string-db.org/),在线进行候选DEGs能够互作的蛋白分析,构建蛋白互作网络(Protein-protein interaction, PPI),将蛋白互作网络导入Cytoscape 3.9.1软件进行可视化分析,使用Cytohub插件对DGEs进行模块化分析,从DGEs中筛选出与蛋白互作积分较高的Hub基因以备其功能评判.
1.6 胶质母细胞瘤突变基因筛选与分析
cBioPortal(https://www.cbioportal.org/)是一个开源平台,用于探索、可视化和分析多维癌症基因组学和临床数据.cBioPortal包含200多项癌症基因组学研究[12],包括来自癌症基因组图谱(The Cancer Genome Atlas, TCGA) 的所有数据.通过cBioPortal平台下载胶质母细胞瘤(Glioblastoma, GBM)的突变基因数据,共有14972个突变基因,筛选出其中976个致癌基因将其与三种药物处理的转录组测序数据中候选DEGs在STRING转化后进行比较分析,筛选出污染暴露差异基因与TCGA致癌基因的交集基因,评判污染物暴露诱发GBM的风险.
2 结果与分析
2.1 三种污染物对不同水生生物的LC50预测与对斑马鱼幼鱼的LC50实验值测定
经过Ecosar Applcation软件分析得出BPA、TCS和TCC对不同生物的半致死浓度(表1),由表1可知三种污染物对鱼类、水蚤和绿藻的毒性大小排序均为TCC>TCS>BPA.表明TCC对水生动物的毒性最高.尽管三种环境雌激素结构相似(图1),但对水生生物的毒性效应却不同.
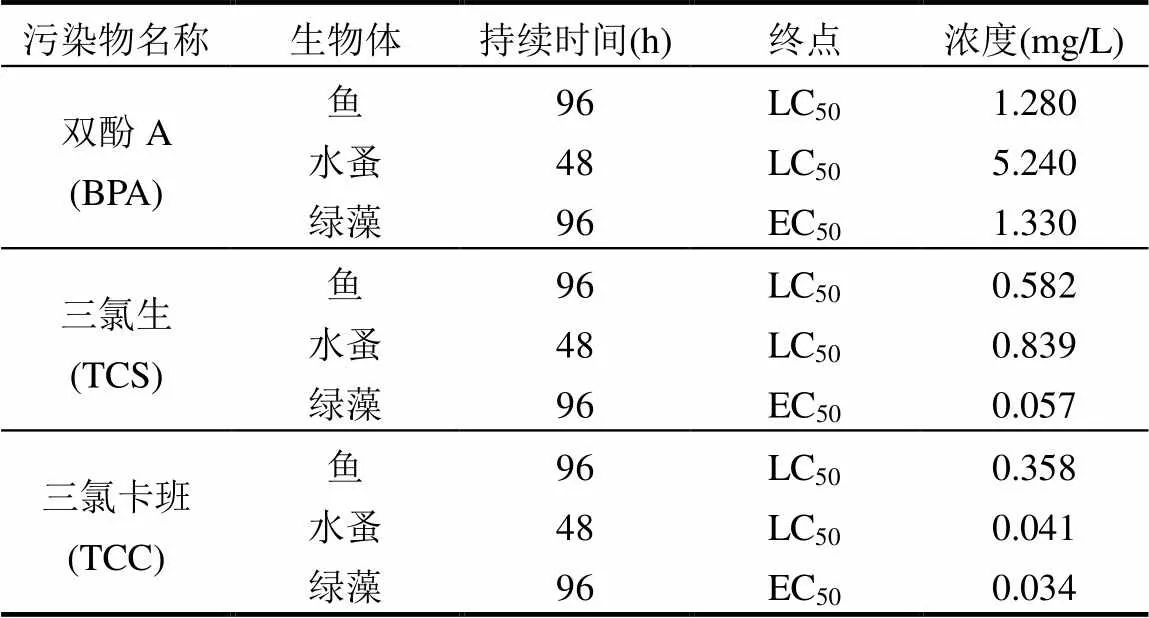
表1 三种典型环境雌激素污染物的LC50预测
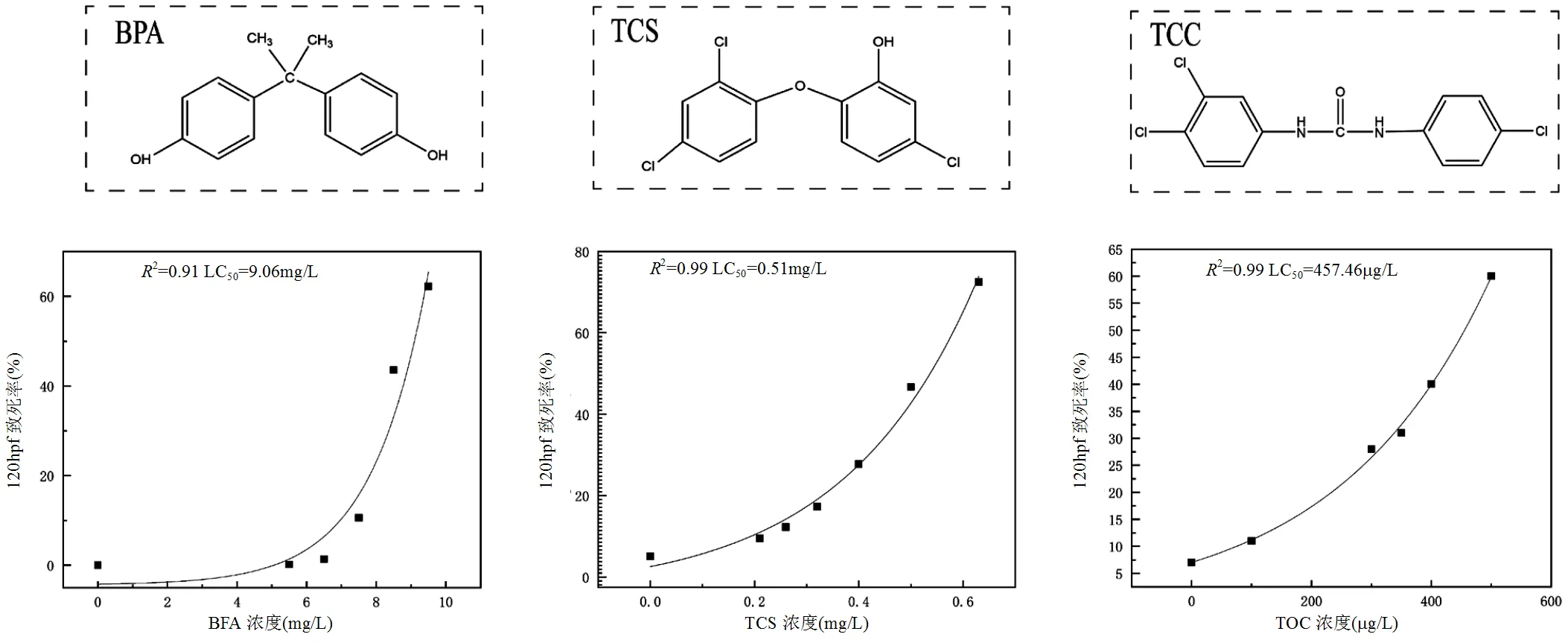
图1 三种污染物化学结构式及其对120hpf斑马鱼幼鱼LC50模拟
参考三种污染物鱼类对应的LC50预测值,分别在其上下各设定2~3个浓度梯度暴露处理6hpf的斑马鱼胚胎(hpf为受精几小时后的缩写),放置6孔板中持续暴毒至120hpf,模拟出BPA、TCS、TCC对斑马鱼幼鱼(120hpf)LC50分别为9.06,0.51和0.46mg/L.拟合回归曲线2值分别为0.91,0.99和0.99,BPA,TCS和TCC剂量-效应回归方程的2值均超过90%(图1).因此,后续转录组测序实验选取半致死剂量的约1/2作为亚致死处理剂量(225μg/L).
2.2 污染物暴露斑马鱼转录组测序差异表达基因筛选和功能分析
为了分析比较三种环境内分泌干扰物的毒性效应的分子靶标,以225μg/L相同浓度的三种不同污染物暴露斑马鱼胚胎,暴露第5天时进行转录组测序.对表达丰度不同的测序进行差异分析,设定显著差异的阈值标准为|log2fold change|³1且<0.05,筛选出三种污染物处理组与对照组之间的差异基因,绘制如图2(A)的火山图,由图可见TCC处理组发生显著变化的基因明显多于BPA和TCS暴露组,且TCC处理组的差异基因变化幅度明显高于其它两个药物暴露组.由图2(B)发现,与对照组相比,BPA、TCS、TCC、分别产生99、581、740个DEGs,其中BPA处理组有37个上调和62个下调DEGs. TCS处理组约272个差异基因表达上调和309个表达下调,TCC处理组存在174个上调基因和564个下调基因.图2(C)显示三种污染物处理组中存在9个重叠的显著差异基因,说明这3种环境污染物致斑马鱼幼鱼差异变化的基因大多数不同,预示其作用靶分子或毒性效应机制不同.
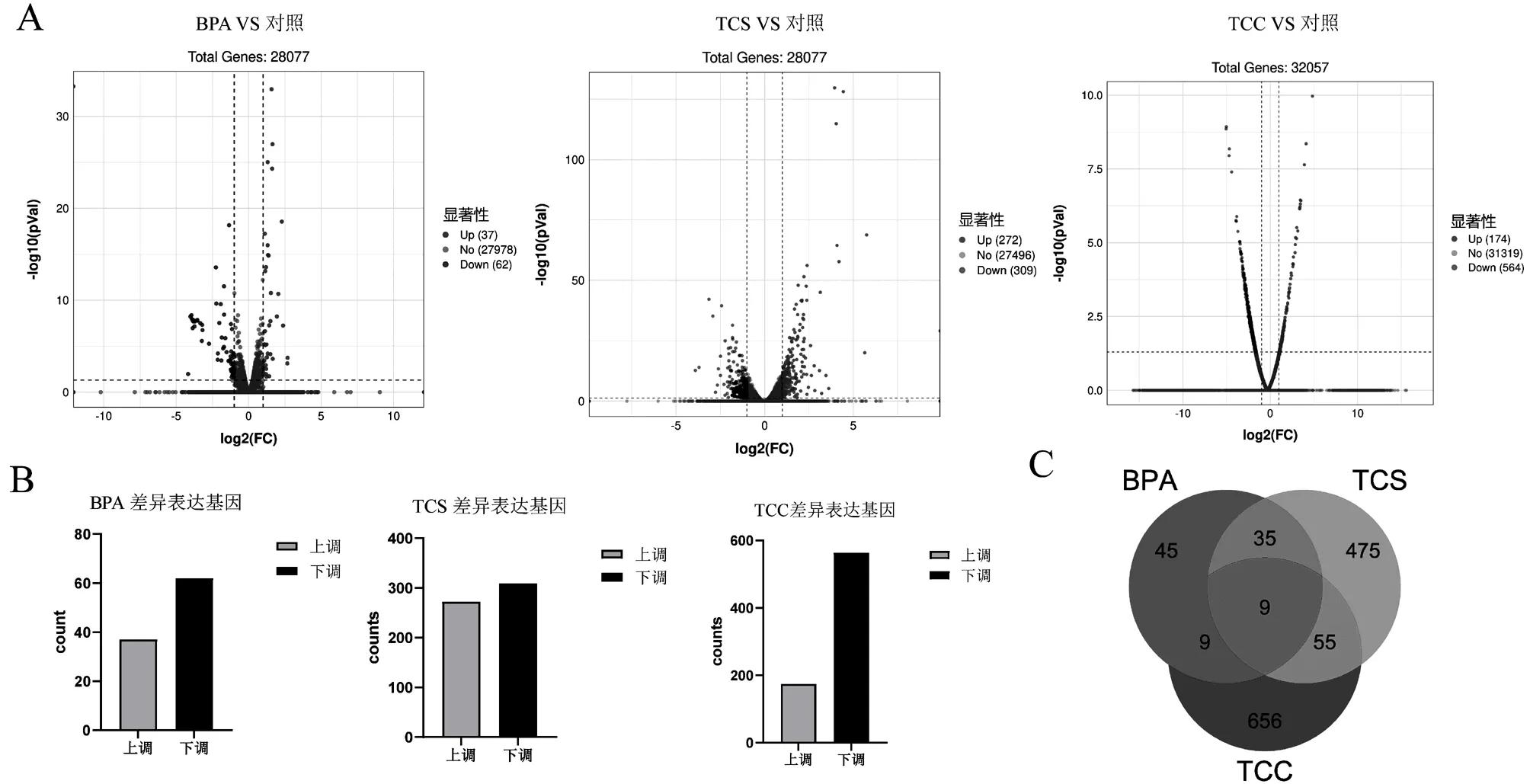
图2 各处理组差异基因火山图(A)、统计图(B)、韦恩图(C)
2.3 三种污染物差异表达基因GO富集分类
为了进一步分析比较三种内分泌干扰物差异表达基因的分布功能以及作用途径,我们对差异表达基因进行了GO和KEGG富集分析,以了解三种EDCs暴露组中所有差异表达基因所富集的生物学功能和涉及的代谢调控Pathway,以深入阐明EDCs暴露作用的相关分子机制.图3展示了各处理组所富集到的排名前10的GOterms(<0.05),气泡图的左侧为相应的基因富集的生物过程、通路、部位等名称,气泡的大小代表所富集到的DEGs的数量.
GO分析显示,TCS处理组在生物过程(Biological Process)方面,有大部分差异基因富集在“对外来刺激的反应(Response to xenobiotic stimulus)”、“药物反应(Response to drug)”以及“药物代谢过程(Drug metabolic process)”等生物过程.而在细胞组成(Cell Component)方面,差异基因主要富集在“质膜区(Plasma membrane region )”部位.在分子功能(Molecular Function)方面,大部分差异基因富集在“铁离子络合(Iron ion binding)”和“氧化还原酶活性(Oxidoreductase activity)”.GO分析表明TCS主要生物影响药物代谢过程以及氧化还原功能.TCC处理组差异基因在生物过程方面主要富集到 “细胞外基质组织(Extracellular matrix organization)”和“补体激活(Complement activation)”.而在细胞组成方面,差异基因大部分富集在“细胞外基质(Extracellular matrix)”组成.TCC处理组在分子功能上所富集到的最显著的是“内肽酶活性(Endopeptidase activity)”功能.GO分析显示与TCS相比TCC主要影响细胞外基质形成的过程以及补体和内肽酶活性.
BPA处理组的差异基因在生物过程(Biological Process)方面大部分富集在“物种间相互作用(Interspecies interaction between organisms)”以及“对激素的反应(Response to hormone)”等两个生物过程.在细胞组成(Cell Component)方面,差异基因主要富集在“突触后密集区(Supramolecular fiber)”、“神经元间突触(Neuron to neuron synapse)”以及“不对称突触(Asymmetric synapse)”.在分子功能(Molecular Function)方面,BPA处理组差异基因富集到分子功能项与TCS相似,分别是“铁离子结合(Iron ion binding)”和“氧化还原酶活性(Oxidoreductase activity)”等相关功能 (图3).GO分析显示与TCC不同BPA主要影响生物间的相互作用以及生物氧化还原的分子功能.
由此可知,三种污染物差异基因的GO功能富集存在一定的差异,尤其是TCC的GO功能与BPA和TCS差异较大.
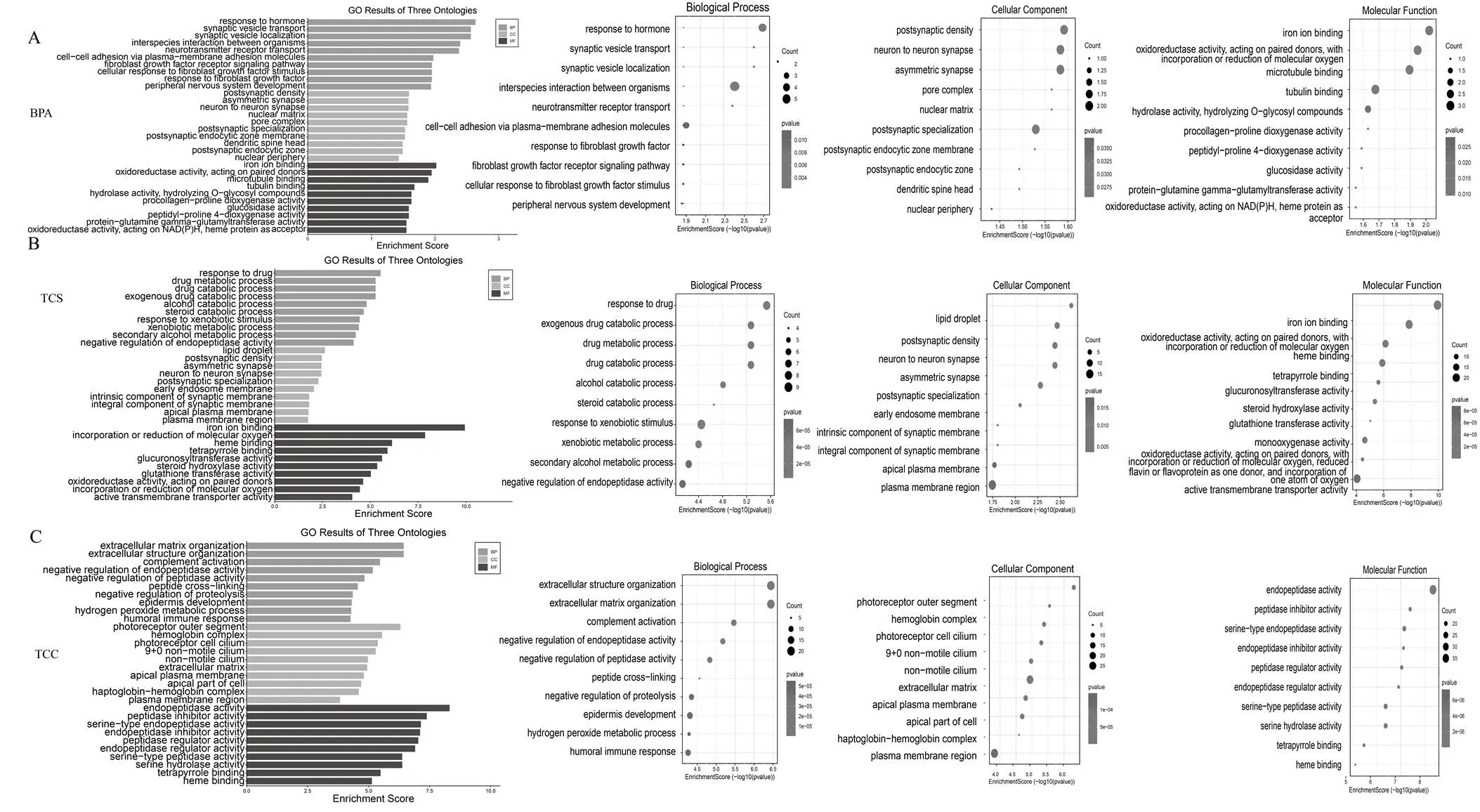
图3 不同EDCs干扰物处理下差异表达基因(DEGs)GO功能分析
2.4 三种污染物差异表达基因KEGG Pathway富集分析
各处理组差异基因的KEGG途径富集如图4A所示,TCS处理组主要富集的KEGG代谢途径 (<0.05),主要包括“细胞色素P450对外源性物质的代谢(Metabolism of xenobiotics by cytochrome P450)”、“辅助因子的生物合成(Biosynthesis of cofactors)”、“药物代谢-细胞色素P450(Drug metabolism cytochrome P450)”三个通路.TCC处理组显著富集的KEGG途径 (<0.05)包括 “附着斑(Focal adhesion)”、“肌动蛋白细胞骨架的调节(Regulation of actin cytoskeleton)”以及“光转导(Phototransduction)”等通路.而BPA处理组主要富集的KEGG途径 (<0.05),分别是“精氨酸和脯氨酸代谢(Arginine and proline metabolism)”与“甘油脂代谢(Glycerolipid metabolism)”通路.由此可知,三种污染物尽管均具有内分泌干扰作用或雌激素作用,但是他们靶向的差异基因富集在不同的代谢途径,表明由不同的信号通路介导.
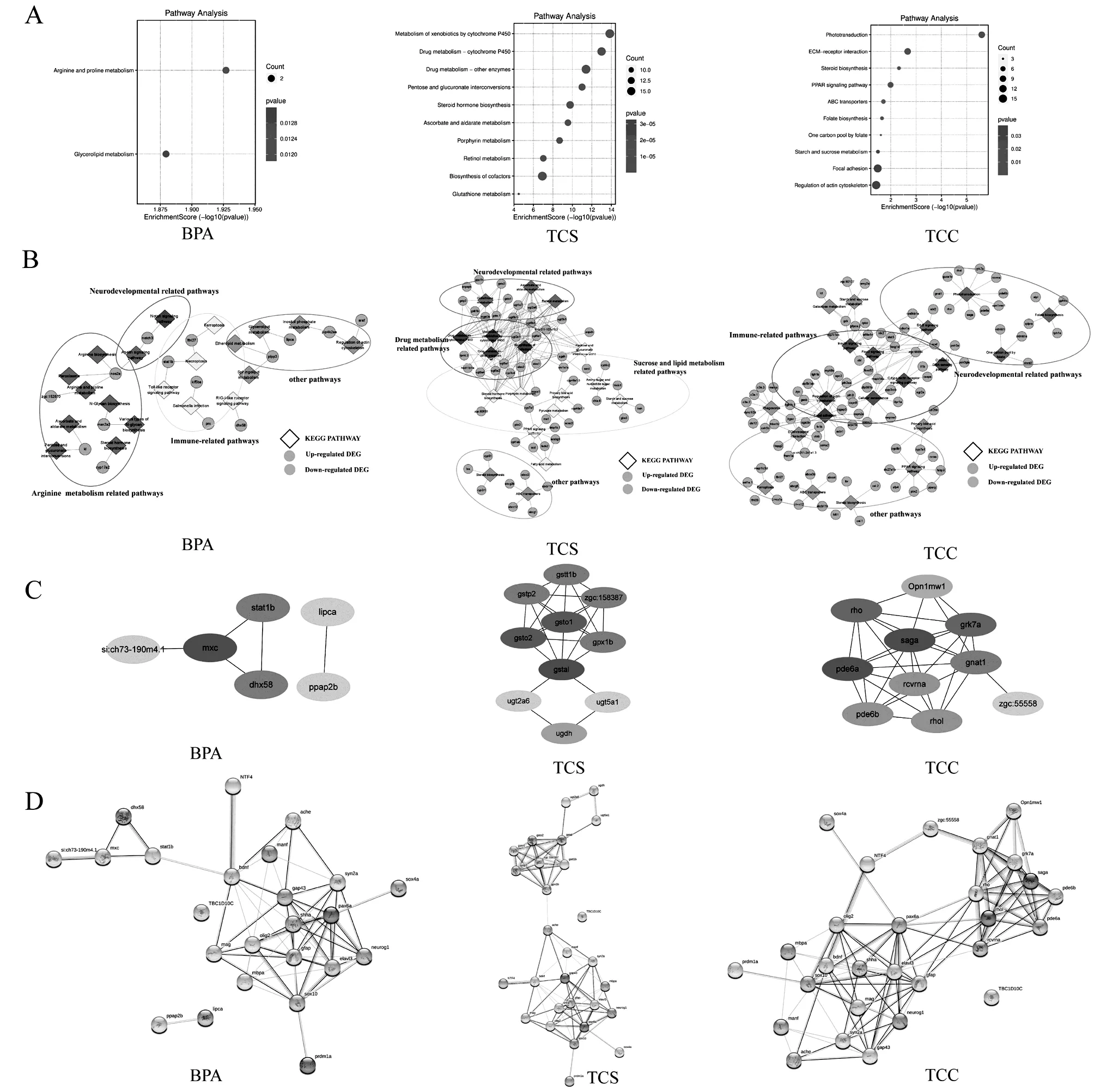
图4 不同EDCs处理下差异表达基因(DEGs)KEGG功能分析
将各自富集出的前20个通路及其基因导入Cytoscape v3.9.1软件进行可视化展示,分析其基因的表达模式聚类(图4B).棱形代表KEGG信号通路,蓝色小球代表下调的DEGs,红色小球代表上调的DEGs.TCS显著富集的通路大致可以划分为三大类:药物相关代谢途径(红色圈内),包括细胞色素P450对异生素的代谢、药物代谢-细胞色素P450、药物代谢-其他酶类、辅因子的生物合成;糖类和脂质代谢相关途径(黄色圈内),包括类固醇激素生物合成、氨基糖和核苷酸糖代谢、淀粉和蔗糖代谢、脂肪酸代谢等途径;神经发育相关途径(紫色圈内),包括谷胱甘肽代谢、视黄醇代谢、抗坏血酸和醛糖代谢.TCC显著富集的通路大致可以划分为免疫相关途径(红色圈内),包括胰岛素信号通路、C型凝集素受体信号通路、粘着斑等途径;神经发育相关途径(紫色圈内),包括光转导、叶酸生物合成、叶酸的一个碳库、ErbB信号通路;其他途径例如PPAR信号通路等(绿色圈内).
BPA显著富集的四条通路划分为精氨酸和脯氨酸代谢途径(红色圈内),包括精氨酸生物合成、各种类型的N-聚糖生物合成等途径;免疫相关途径(黄色圈内),包括铁死亡、RIG-I样受体信号通路、Toll样受体信号通路等途径;神经相关途径(紫色圈内),包括Notch信号通路、Apelin信号通路;其他途径例如甘油脂代谢等途径(绿色圈内).上述分析表明,三种污染物差异表达基因的KEGG通路在神经相关途径均有富集,但是,作用于神经通路是不同的.TCS富集的神经作用途径主要是周围神经系统生长分化相关的通路,TCC富集的神经作用途径主要是叶酸合成和ErbB信号通路;而BPA的神经富集途径关于Notch信号通路、Apelin信号通路.从富集的基因数量来看,TCS和TCC富集的差异基因比较多,然而而TCS主要是上调的基因参与神经相关通路,TCC主要是下调的差异基因参与(图4B).
Cytohubba软件可对PPI网络节点关联度进行计算,计算出PPI网络中最密集的区域,筛选出基因组合中的关键基因(Hub基因).为比较和探索三种污染物对神经毒性的机制,选取富集在神经发育相关途径的基因进行Hub基因的筛选.如图4C,TCS组中前10的Hub基因为、、、、、、、、、.其中有研究报道癫痫持续状态(SE)后大鼠海马体中GPx1蛋白时空分布表达发生了改变[13],并表明谷胱甘肽介导GPx1的调节可能影响SE诱导的神经元死亡和自噬性星形胶质细胞变性.TCC处理组中前10Hub基因为、、、、、、、、、;其中Rho家族GTP酶是小G蛋白,充当在活性和非活性形式之间穿梭的分子开关[13].Rho GTPases调节多种细胞过程,例如生长、迁移、粘附和分化[14].Rho GTPases也在调节神经元形态和功能方面发挥着重要作用[15].刘晓楠等[16]发现了Gstp可以通过JNK信号调节神经元轴突形成,表明了Gstp蛋白在皮质发育过程中在神经突起始中的新功能.BPA组中的前6个Hub基因为、、、、、,其中在维持果蝇幼虫大脑中的神经干细胞命运和神经节母细胞分化中起关键作用.Elena Butturini等[17]已证明氧化应激诱导STAT1的S-谷胱甘肽化并过度激活其在小胶质细胞BV2中的信号传导,并指出这种转录因子在神经炎症中的重要性.
为证明上述筛选的Hub基因与神经标志功能基因蛋白之间的互作网络及Hub基因调控神经毒性的作用模式,即为比较三种污染物的神经毒性效应机制.如图4D所示,BPA组筛选出的Hub基因与脑源性神经营养因子之间存在相互作用;TCS组筛选的Hub基因与神经递质乙酰胆碱酯酶ache具有互作关系;TCC组筛选的Hub基因中与神经营养因子4有相互作用,Hub基因、和与配对盒蛋白、Elav样蛋白、胶质纤维酸性蛋白有相互作用.综上所述,TCS、TCC、BPA均能直接靶向于神经相关的Hub基因诱导不同的神经毒性,也可通过Hub基因间接地与神经标志基因的互作而诱导神经毒性.就像BPA在神经毒性通路上富集KEGG pathway和Hub基因较少,但是Hub基因与神经标志功能基因之间存在丰富而间接的蛋白互作网络.这些发现使我们在分子水平上了解了三种污染物诱导神经发育毒性效应不同、作用的分子机制与途径不同.
2.5 三种污染物差异基因与胶质母细胞瘤突变癌基因的比较分析
胶质母细胞瘤是成人最常见、最具侵袭性的原发脑肿瘤,占原发恶性脑肿瘤的45.6%[18].胶质母细胞瘤的年发病率随着年龄增长而增加,从儿童的0.15/10万增加到75~84岁患者的峰值15.03/10万[19].一些环境的致癌因素也可影响胶质瘤的发生.与神经外器官的肿瘤相比,胶质母细胞瘤和原发脑肿瘤的发生率普遍较低,可能是由于血脑屏障的对大脑的保护,血脑屏障的三磷酸腺苷结合盒(ABC)家族转运体限制化学诱变剂向大脑扩散,使其免受毒性应激的影响.有研究表明妊娠期暴露于EDCs可能会干扰儿童正常大脑发育,并容易导致以后行为功能障碍[20],且由于这三种环境内分泌干扰物都是脂溶性物质,都具有神经毒性相关的报道.因此我们进行了这些药物暴露诱发脑胶质瘤的潜在风险的分析,通过cBioPortal(https://www.cbioportal.org/)下载了TCGA中胶质母细胞瘤的突变基因数据,共有14972个突变基因,其中有976个致癌基因与三种药物处理的转录组测序数据中候选DEGs在STRING转化后进行比较分析.如图5所示,BPA暴露组差异表达基因在转化后与976个癌基因共有2个交集基因,为NOTCH3、ARAF;TCS暴露组与其有10个交集基因,为TET3、NOTCH3、SOCS2、AFF4、PMAIP1、ARID1B、ARID3A、ARNT、PTPRT、PIK3R2;TCC暴露组与其有27个交集基因,为DDX6、FAT4、ARAF、AXIN1、EML4、MIB1、ZNF750、HDAC7、IRF8、PRSS1、STAT3、CDKN1A、ABL2、PALB2、MST1、CBL、STAT4、DUSP4、S1PR2、SAMHD1、SCG5、ROS1、REL、SHOC2、TP63、RPTOR、PPARG.
BPA暴露组的交集基因中,NOTCH3是一个高度保守的基因,是一种跨膜的发育信号受体,它在细胞发育模式、细胞命运、细胞存活和增殖的调节中起许多关键作用[21].最近的研究已经发型了NOTCH3在神经元干细胞和神经元分化中有重要作用,NOTCH3能调节室管膜下区的静止干细胞群[22-23].穆罕默德·艾尔库达等[24]发现NOTCH3基因是17%的胶质瘤组织活检中最显著的扩增之一, NOTCH3在许多恶性肿瘤中经常被异常调控,可能在胶质瘤发生中起主要作用.ARAF是丝氨酸/苏氨酸特异性蛋白激酶Raf家族的成员.在丝裂原活化蛋白激酶(MAPK)信号通路中,Raf激酶被认为是Ras和MEK之间的重要节点[25].在典型的受体酪氨酸激酶(RTK)-Ras-Raf-MEK-MAPK信号转导过程中,Raf在RTK刺激下直接与GTP结合的RAS转位到质膜,然后Raf通过磷酸化激活双特异性激酶MEK1和MEK2,进而激活ERK2,从而构成经典的三级MAPK激酶级联.Ras-Raf-MEK-MAPK通路的异常激活常见于各种类型的癌症[26,27].BPA暴露可能会通过影响NOTCH3的表达以及Raf信号通路导致神经胶质细胞发生癌变继而引起神经胶质瘤.
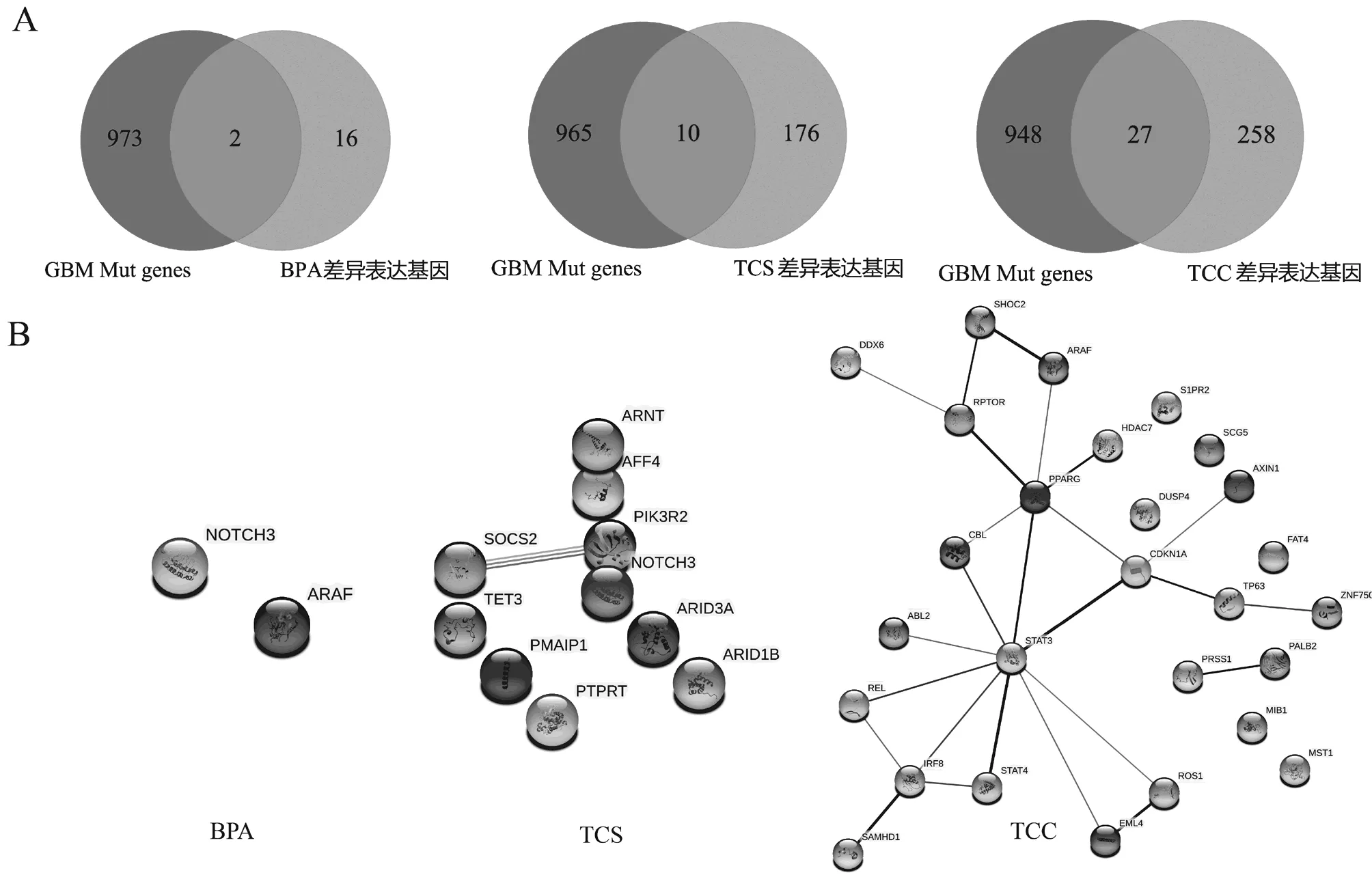
图5 不同EDCs处理下差异表达基因(DEGs)与GBM突变基因的交集
TCS暴露组中,细胞因子信号(SOCS)蛋白抑制剂是细胞因子和生长因子信号的调节剂,其异常调节与多种炎症和肿瘤疾病有关[28].细胞因子信号抑制因子(SOCS)家族成员最为人知的是JAK/STAT途径的信号负调节因子.该家族的一些成员,尤其是SOCS2,在神经系统中具有促进神经元分化和轴突生长等神经营养素的作用[29-30].SOCS2还可影响胶质母细胞瘤(GBM)对甲基环己氯乙亚硝脲化疗敏感性的核心基因.磷酸肌醇3激酶调节亚基2(PIK3R2)是一种肿瘤驱动因子.有研究表明XLOC可以募集特异性蛋白1(Sp1)转录因子,并促进Sp1与PIK3R2启动子的结合[31],从而提高PIK3R2在mRNA和蛋白水平的表达.PIK3R2介导的PI3K/ AKT信号通路的激活促进了替莫唑胺(TMZ)耐药和胶质瘤细胞增殖[32].由此分析可知,TCS暴露可能会通过影响SOCS2的表达以及PIK3/AKT信号通路影响脑胶质瘤的发生及其预后.
TCC暴露组与GBM突变基因交集中,信号转导和转录激活因子3(STAT3)是参与调节细胞生长、分化和存活的7个STAT家族成员之一.研究表明[33],胶质瘤细胞中STAT3及其下游基因,如细胞周期蛋白D1(cyc-linD1)、c-Myc、Bcl-2、Bcl-xl和VEGF等,常显示异常表达或活性增强,从而使细胞生长失控,抑制肿瘤细胞凋亡,促进肿瘤细胞增殖,诱导肿瘤血管生成,参与肿瘤免疫逃逸.PPARG系统可以快速感知细胞压力,并以多种抗炎和神经保护方式在神经胶质细胞、神经元和脑血管内皮细胞的中枢神经系统中发挥作用.有研究说明了PPARG的异常表达可能与GBM患者的存活时间有关[34].CDKN1A是一个细胞生长调节因子,其能降低细胞生长速度,且CDKN1A与肿瘤发生有关,有研究发现CDKN1A参与AKT介导的胶质瘤细胞的TMZ抗性[35].此外,CDKN1A可能参与GBM中的补体和凝血级联通路[36].TCC暴露可能会通过影响STAT3、PPARG、CDKN1A等癌基因的表达导致脑胶质瘤的发生.
综上所述,BPA、TCS、TCC三种内分泌干扰物环境暴露均在一定程度上有诱导脑胶质瘤发生的风险,但三者诱导脑胶质瘤发生的途径和介导的信号通路不同,其中TCC的风险远大于另外两种污染物.
3 结语
基于多数内分泌干扰物对斑马鱼神经毒性效应与机制的研究依旧局限于个体、组织器官或功能评判层面,故本研究从分子层面上评判三种EDCs对水生生物的神经毒性效应,分析比较其作用靶标、作用途径、致毒机理及可能诱发神经相关疾病的异同,评判其诱发神经胶质瘤的潜在风险.
1)基于转录组测序和生物信息学的系统分析,揭示了BPA、TCS、TCC差异基因的GO功能富集存在差异.此外,尽管三种污染物差异表达基因的KEGG通路在神经发育相关途径均有富集,但是其作用于神经通路是不同的.
TCS富集的神经发育相关途径主要是周围神经系统生长分化相关的通路, 例如视黄醇代谢、抗坏血酸代谢.抗坏血酸已被证明在周围神经系统 (PNS) 中具有重要功能.抗坏血酸可以通过形成含有胶原蛋白和层粘连蛋白的细胞外基质在体外促进髓鞘形成[37].视黄酸可以促进分化的视网膜神经节细胞和外周感觉神经元的轴突再生.在发育过程中内源性视黄酸能够促进神经胶质和神经元分化以及体外实验中视黄酸可以促进分化的视网膜神经节细胞和外周感觉神经元的轴突再生[38].
TCC富集的神经发育作用途径主要是叶酸合成和ErbB信号通路,髓磷脂对于中枢和外周神经系统(PNS)中轴突快速准确地传导电脉冲至关重要.PNS中的髓鞘发育依赖于Nrg1/ErbB受体提供的轴突信号.有证据表明,大脑中有一个最佳的NRG/ ERBB信号水平,偏离它会损害大脑功能[39]. NRGs/ERBBs和下游信号通路可能为特定的神经精神症状提供治疗靶点.叶酸可调节神经系统中不同细胞的行为包括对神经胶质细胞产生趋化反应,诱导神经营养因子释放,以及刺激细胞系统的神经元分化.
BPA富集于Notch信号通路、Apelin信号通路.Notch信号通路是多细胞生物进化上保守的信号通路,其已被证明可调节突触分化和传递[40].有研究证明Notch信号是神经形成过程中神经周围迁移和分化所必需的,神经周围细胞中Notch信号的丢失会导致雪旺细胞分化失败[41].Apelin/APJ受体系统已被证明在下丘脑调节功能中发挥作用,例如食物摄入、体液稳态、神经内分泌控制,以及心血管、胃肠运动和呼吸功能等自主神经/内脏运动信号的调控[42].
2)三种内分泌干扰物差异基因表达和富集的通路存在差异,并且TCC的差异更为显著,可能是由于三种药物结构不同,构效关系不同导致其作用的靶分子也不同.由于TCC分子结构中含有的脲键可以作为调节药物分子理化性质的功能基团,调节分子间的氢键作用.而氢键是药物与蛋白之间最主要的相互作用,其中脲键的羰基可作为氢键受体,-NH-既可为氢键供体也可为受体.故TCC中形成的氢键较多,所作用的靶蛋白可能较其他两种药物多,以及与靶蛋白作用的作用力可能强于其他两种药物[43].
3)通过进行Hub基因筛选,发现TCS、TCC、BPA均能直接靶向于神经相关的Hub基因诱导不同的神经毒性,也可通过Hub基因间接地与神经标志功能基因的互作而诱导神经毒性.
4)最后,我们评估了这三种内分泌干扰物引起脑胶质瘤的可能风险,BPA暴露可能会通过影响NOTCH3的表达以及Raf信号通路导致神经胶质细胞发生癌变继而引起神经胶质瘤.TCS暴露可能会通过影响SOCS2的表达以及PIK3/AKT信号通路影响脑胶质瘤的发生及其预后.TCC暴露可能会通过影响STAT3、PPARG、CDKN1A等癌基因的表达导致脑胶质瘤的发生.
5)总而言之,这些发现使我们在分子水平上了解了三种污染物诱导神经毒性效应的靶基因不同、作用的分子机制与途径不同,为从分子水平上评判环境内分泌干扰物的健康风险与预警提供科学依据.然而,还需要进一步的实验来证明其如何通过Hub基因与神经标志基因的互作而诱导神经毒性,以及通过经典的通路抑制剂和激动剂的使用证明具体信号通路的介导作用.另外对于内分泌干扰物的暴露是否会增加脑胶质瘤形成的风险、易感性及其预后,以及内分泌干扰物暴露的时间和剂量与诱发风险的关系均需要进一步实验研究来证实.
[1] 王 杨,吴国辉,钱秋慧,等.三氯生对斑马鱼发育和脂质代谢的影响[J]. 中国环境科学, 2022,(3):1394-1400.
Wang Y, Wu G G, Qian Q H, et al. Effects of triclosan environmental exposure on zebrafish development and lipid metabolism [J]. China Environmental Science, 2022,(3):1394-1400.
[2] 赵晨曦,王 杨,钱秋慧,等.三氯卡班环境暴露对斑马鱼神经行为的影响 [J]. 中国环境科学, 2022,(1):456-464.
Zhao C X, Wang Y, Qian Q H, et al. Effects of environmental exposure to triclocarban on the neurobehavior of zebrafish(Danio rerio) [J]. China Environmental Science, 2022,(1):456-464.
[3] Gomes M F, de Paula V C S, Martins L R R, et al. Sublethal effects of triclosan and triclocarban at environmental concentrations in silver catfish (Rhamdia quelen) embryos [J]. Chemosphere, 2021,263: 127985.
[4] Yun H, Liang B, Kong D, et al. Fate, risk and removal of triclocarban: A critical review [J]. Journal of hazardous materials, 2020,387: 121944.
[5] Gao C J, Kannan K. Phthalates, bisphenols, parabens, and triclocarban in feminine hygiene products from the United States and their implications for human exposure [J]. Environment international, 2020, 136:105465.
[6] 宋静文,靳亚茹,刘红玲.典型酚类污染物内分泌干扰效应研究—对斑马鱼发育及核受体介导基因调控的分子影响[J]. 中国环境科学, 2020,(9):4065-4076.
Song J W, Jin Y R, Liu H L. Research on the endocrine disruption effect of typical phenolic pollutants: The embryonic development effects and molecule effects of gene regulation mediated by nuclear receptor on Zebrafish [J]. China Environmental Science, 2020,(9): 4065-4076.
[7] Kim S S, Hwang K S, Yang J Y, et al. Neurochemical and behavioral analysis by acute exposure to bisphenol A in zebrafish larvae model [J]. Chemosphere, 2020,239:124751-124752.
[8] Lee J, Moon K W, Ji K. Systematic review of exposure to bisphenol A alternatives and its effects on reproduction and thyroid endocrine system in zebrafish [J]. Applied Sciences, 2021,11(4):1832-1837.
[9] Coumailleau P, Trempont S, Pellegrini E, et al. Impacts of bisphenol A analogues on zebrafish post-embryonic brain [J]. Journal of Neuroendocrinology, 2020,32(8):e12879.
[10] Qiu W, Liu S, Chen H, et al. The comparative toxicities of BPA, BPB, BPS, BPF, and BPAF on the reproductive neuroendocrine system of zebrafish embryos and its mechanisms [J]. Journal of hazardous materials, 2021,406:124300-124304.
[11] Gyimah E, Xu H, Dong X, et al. Developmental neurotoxicity of low concentrations of bisphenol A and S exposure in zebrafish [J]. Chemosphere, 2021,262:128043-128046.
[12] Buechner P, Hinderer M, Unberath P, et al. Requirements analysis and specification for a molecular tumor board platform based on cBioPortal [J]. Diagnostics, 2020,10(2):92-93.
[13] Kim J E, Lee D S, Kim T H, et al. Glutathione regulates GPx1expression during CA1neuronal death and clasmatodendrosis in the rat hippocampus following status epilepticus [J]. Antioxidants, 2022,11(4):744-756.
[14] Humphries B, Wang Z, Yang C. Rho GTPases: big players in breast cancer initiation, metastasis and therapeutic responses [J]. Cells, 2020, 9(10):2166-2167.
[15] Kalpachidou T, Spiecker L, Kress M, et al. Rho GTPases in the physiology and pathophysiology of peripheral sensory neurons [J]. Cells, 2019,8(6):591-598.
[16] Liu X, Blazejewski S M, Bennison S A, Toyo-Oka K. Glutathione S-transferase Pi (Gstp) proteins regulate neuritogenesis in the developing cerebral cortex [J]. Hum. Mol. Genet., 2021,30(1):30-45.
[17] Butturini E, Carcereri de Prati A, Mariotto S. Redox regulation of STAT1 and STAT3 signaling [J]. International Journal of Molecular Sciences, 2020,21(19):7033-7037.
[18] Tan A C, Ashley D M, López G Y, et al. Management of glioblastoma: State of the art and future directions [J]. CA: a cancer journal for clinicians, 2020,70(4):299-312.
[19] Alexander B M, Cloughesy T F. Adult glioblastoma [J]. Journal of Clinical Oncology, 2017,35(21):2402-2409.
[20] Braun J M. Early-life exposure to EDCs: Role in childhood obesity and neurodevelopment [J]. Nature Reviews Endocrinology, 2017,13(3): 161-173.
[21] Aburjania Z, Jang S, Whitt J, et al. The role of Notch3 in cancer [J]. The oncologist, 2018,23(8):900-911.
[22] Hosseini-Alghaderi S, Baron M. Notch3in development, health and disease [J]. Biomolecules, 2020,10(3):484-489.
[23] Hevia C F, Engel-Pizcueta C, Udina F, et al. The neurogenic fate of the hindbrain boundaries relies on Notch3-dependent asymmetric cell divisions [J]. Cell Reports, 2022,39(10):110915.
[24] Alqudah MA, Agarwal S, Al-Keilani MS, et al. NOTCH3is a prognostic factor that promotes glioma cell proliferation, migration and invasion via activation of CCND1and EGFR. PLoS One. 2013, 8(10):e77299
[25] An S, Yang Y, Ward R, et al. A-Raf: A new star of the family of raf kinases [J]. Critical Reviews in Biochemistry and Molecular Biology, 2015,50(6):520-531.
[26] Zhou Z W, Ambrogio C, Bera A K, et al. KRASQ61H preferentially signals through MAPK in a RAF dimer-dependent manner in non–small cell lung Cancer KRASQ61H signals in a RAF dimer- dependent manner [J]. Cancer research, 2020,80(17):3719-3731.
[27] Meng L D, Shi G D, Ge W L, et al. Linc01232 promotes the metastasis of pancreatic cancer by suppressing the ubiquitin-mediated degradation of HNRNPA2B1and activating the A-Raf-induced MAPK/ERK signaling pathway [J]. Cancer Letters, 2020,494:107- 120.
[28] Trengove M C, Ward A C. SOCS proteins in development and disease [J]. American journal of clinical and experimental immunology, 2013, 2(1):1-6.
[29] Beldi-Ferchiou A, Skouri N, Ben Ali C, et al. Abnormal repression of SHP-1, SHP-2and SOCS-1transcription sustains the activation of the JAK/STAT3 pathway and the progression of the disease in multiple myeloma [J]. PloS one, 2017,12(4):e0174835.
[30] Nguyen C H, Glüxam T, Schlerka A, et al. SOCS2is part of a highly prognostic 4-gene signature in AML and promotes disease aggressiveness [J]. Scientific Reports, 2019,9(1):1-13.
[31] Hermawan A, Putri H. Bioinformatics studies provide insight into possible target and mechanisms of action of nobiletin against cancer stem cells [J]. Asian Pacific Journal of Cancer Prevention: APJCP, 2020,21(3):611-616.
[32] Tomar V S, Patil V, Somasundaram K. Temozolomide induces activation of Wnt/β-catenin signaling in glioma cells via PI3K/Akt pathway: implications in glioma therapy [J]. Cell Biology and Toxicology, 2020,36(3):273-278.
[33] Dan L U. Anticancer mechanism of scutellarin [J]. Journal of International Oncology, 2015,42(8):682-686.
[34] Wang Q, Cai J, Fang C, et al. Mesenchymal glioblastoma constitutes a major ceRNA signature in the TGF-β pathway [J]. Theranostics, 2018,8(17):4721-4733.
[35] Ohta K, Hoshino H, Wang J, et al. Micro RNA-93 activates c-Met/PI3K/Akt pathway activity in hepatocellular carcinoma by directly inhibiting PTEN and CDKN1A [J]. Oncotarget, 2015,6(5): 3211-3217.
[36] Hu K, Li J, Wu G, et al. The novel roles of virus infection-associated gene CDKN1A in chemoresistance and immune infiltration of glioblastoma [J]. Aging (Albany NY), 2021,13(5):6662.
[37] Gess B, Röhr D, Young P. Ascorbic acid and sodium-dependent vitamin C transporters in the peripheral nervous system: from basic science to clinical trials [J]. Antioxidants & redox signaling, 2013, 19(17):2105-2114.
[38] Mey J. Retinoic acid as a regulator of cytokine signaling after nerve injury [J]. Zeitschrift für Naturforschung C, 2001,56(3/4):163-176.
[39] Ho B L, Goh Q, Nikolaou S, et al. NRG/ErbB signaling regulates neonatal muscle growth but not neuromuscular contractures in neonatal brachial plexus injury [J]. FEBS letters, 2021,595(5):655- 666.
[40] Hayashi Y, Nishimune H, Hozumi K, et al. A novel non-canonical Notch signaling regulates expression of synaptic vesicle proteins in excitatory neurons [J]. Sci Rep. 2016;6:23969.Published 2016Apr 4.
[41] Binari L A, Lewis G M, Kucenas S. Perineurial glia require Notch signaling during motor nerve development but not regeneration. J Neurosci. 2013,33(10):4241-4252.
[42] Travagli M B A. “Novel transmitters in brain stem vagal neurocircuitry: New players on the pitch [J].” American Journal of Physiology. Gastrointestinal and Liver Physiology, 2018,315(1): G20-G26.
[43] Ghosh A K, Brindisi M. Urea derivatives in modern drug discovery and medicinal chemistry [J]. Journal of medicinal chemistry, 2019, 63(6):2751-2788.
Neurotoxicity effects of the three endocrine disruptors on zebrafish and the underlying molecular mechanisms by using the Illumina RNA-seq technique.
GUO Zi-yi1, WANG Wei-wei2, SONG Jie1, WANG Hui-li1*
(1.Suzhou University of Science and Technology, Suzhou 215009, China;2.Wenzhou Medical University, Wenzhou 325035, China)., 2023,43(2):946~956
Triclosan (TCS), triclocarban (TCC), and bispenol A (BPA) are all proved to possess endocrine disrupting effects; however, little data are available on their neurotoxicity effects on zebrafish () and the underlying molecular mechanisms. Herein, zebrafish transcriptomic data was obtained with the aid of RNA-Seq after exposure to the aforementioned three pollutants. By means of bioinformatics analysis, nine common positively differential expression genes (DEGs) were screened in the three exposure treatments. The GO functions and KEGG pathways of nine DEGs were mainly attributable to biological process, cellular component, and molecular function, in which the number and function were different with varying chemical exposure. Notably, most of the DEGs were found to be enriched in the nerve-related pathways, but their detailed pathways were different for three chemicals. The computation of node-correlation degree of PPI network showed that the hub genes enriched in neural pathways were different in the three treatments, which had rich and indirect interaction networks with neural marker genes. By integrating DEGs with GBM mutant gene of glioblastoma in the TCGA database, we confirmed that chemical exposure induced GBM risk, but the related occurrence pathway and regulatory signaling pathway were different. Therefore, the underlying neurotoxicity mechanisms induced by the three pollutants were disclosed at the molecular level.
endocrine disruptors;zebrafish;transcriptome sequencing;neurotoxicity;glioblastoma
X171
A
1000-6923(2023)02-0946-11
郭子一(2000-),女,山东枣庄人,苏州科技大学硕士研究生,主要从事风险评价与生态安全方面的研究.
2022-07-04
国家自然科学基金资助项目(32071617)
* 责任作者, 教授, whuili@163.com

