LMR对广泛期小细胞肺癌一线化疗疗效和预后的预测价值
杨 燕,程倩倩,王 威,邵 玉,李 曼,王效静
肺癌是各种癌症相关死亡的首要原因[1-2]。其中小细胞肺癌(small cell lung cancer,SCLC)恶性程度高,占比10%~15%。该类肿瘤生长快速,早期容易出现远处转移,具有高度侵袭性和致命性,这些特点导致大多数SCLC病人在确诊时已处于疾病晚期阶段,预后极差[3]。近年来,PD-L1抑制剂如Atezolizumab、Durvalumab让广泛期小细胞肺癌(ES-SCLC)的治疗有了一些突破[4-5],但由于该类制剂在中国上市较国外晚,且上市后价格昂贵,导致单纯化疗在一段时间内将仍然是ES-SCLC的主流方案。一线化疗是该类疾病的基石,但有效的疗效预测方法和预后判断生物标志物的缺乏在一定程度上限制了病人的获益。近年来,免疫炎症指标淋巴细胞-单核细胞比值(lymphocyte to monocyte ratio,LMR)协助判断包括SCLC在内的多种恶性肿瘤的疗效和预后的作用被多项研究[6-10]所证实。其中GO等[9]发现,诊断时的LMR可预测在接受一线化疗或放化疗的SCLC病人的疗效和预后,但该研究没有对局限期和广泛期SCLC进行区分。QI等[11]在研究基线LMR对使用免疫联合化疗治疗ES-SCLC病人预后预测价值时发现,LMR并不是其独立预后因素。可见,LMR在ES-SCLC病人中的临床价值值得进一步探索。本研究选择接受一线化疗的ES-SCLC病人,探讨LMR对病人一线化疗疗效及生存的预测价值。
1 资料与方法
1.1 一般资料 回顾性收集2019年1月至2022年1月在我院肿瘤内科治疗的50例ES-SCLC病人临床资料。纳入标准:经组织学或细胞学确诊为SCLC;经影像学确诊为广泛期;可测量病灶≥1个;接受一线标准化疗方案治疗≥2个周期;临床资料完整且可被追溯。排除标准:合并其他肿瘤及亚型;合并使用其他抗肿瘤治疗手段;既往接受过针对晚期阶段的系统治疗。
1.2 方法 纳入病人均接受“铂类联合依托泊苷”或“铂类联合伊立替康”的双药方案治疗。具体参考美国国立综合癌症网络、中国临床肿瘤学会等国内外SCLC诊疗指南或规范。收集病人性别、年龄、吸烟史、ECOG评分、病理资料、浆膜腔积液情况、原发灶情况、远处转移情况、疗效评价情况和进展时间等临床资料。通过医院复查或电话随访等方式获取病人病情进展时间和死亡时间,随访截止日期为2022年3月。记录病人一线化疗前外周血淋巴细胞、单核细胞计数,并计算LMR:LMR=外周血淋巴细胞计数(109/L)/外周血单核细胞计数(109/L)。根据受试者工作特征(receiver operating characteristic,ROC)曲线确定LMR最佳截断值,取最大约登指数时所对应的指标值,将病人分为高、低LMR 2组,比较2组ES-SCLC病人一线化疗疗效和预后的差异。
1.3 疗效评价 近期疗效参照实体肿瘤疗效评价标准(RECIST)1.1版进行,包括:完全缓解(complete response,CR)、部分缓解(partial response,PR)、疾病稳定(stable disease,SD)和疾病进展(progressive disease,PD)。疾病控制率(disease control rate,DCR)=(CR+PR+SD)/(CR+PR+SD+PD),客观有效率(objective response rate,ORR)=(CR+PR)/(CR+PR+SD+PD)。远期疗效观察无进展生存时间(progression-free survival,PFS)和总生存时间(overall survival,OS)。PFS:病人从开始一线治疗至出现疾病进展或死亡的时间,OS:病人从开始一线治疗至因任何原因导致死亡的时间。
1.7 统计学方法 采用t检验、χ2检验;应用Kaplan-Meier法绘制2组生存曲线,采用log-rank检验比较;使用Cox回归分析筛选预后因素。均为双侧检测,检测水准为α=0.05。
2 结果
2.1 ES-SCLC病人基线血清LMR与临床特征的关系 纳入ES-SCLC病人共50例,年龄45~88岁,男45例(90%)。基线LMR与病人是否患有低蛋白血症和骨转移有关(P<0.05);而年龄、性别、吸烟状况、ECOG评分、有无肺部炎症、有无浆膜腔积液、有无脏器、脑以及肝转移均与基线LMR无关(P>0.05)(见表1)。
2.2 LMR与一线化疗疗效的关系 50例ES-SCLC病人一线化疗后,CR 0 例,PR 25例,SD 18例,PD 7例。ORR为50.0%,DCR为86.0%。LMR最佳截断值为3.08,高LMR组22例,化疗疗效评价为CR或PR的病人15例,PD或SD为7例;低LMR组28例,化疗疗效评价为CR或PR的病人10例,PD或SD为18例。分析发现,基线LMR越高,一线化疗疗效越好(χ2=5.20,P<0.05)(见表2)。
2.3 LMR与ES-SCLC病人一线化疗PFS的关系 50例病人中位PFS为7.4个月。LMR最佳截断值为3.16,其中高LMR组20例,低LMR组30例,中位PFS分别为9.0个月与5.8个月。生存结果分析提示,PFS在高、低LMR组间差异有统计学意义(χ2=4.50,P<0.05)(见图1)。单因素Cox回归分析表明,有无脏器转移和基线LMR与PFS相关(P<0.05)(见表3)。将有无脏器转移和基线LMR纳入多因素Cox回归分析,结果显示,有无脏器转移和基线LMR均是ES-SCLC病人PFS的独立预测因素(P<0.05)(见表4)。
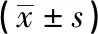
表1 ES-SCLC病人基线血清LMR与临床特征的关系

表2 ES-SCLC病人基线血清LMR与一线化疗疗效的关系(n)
2.4 LMR与ES-SCLC病人OS的关系 50例病人中位OS为11.0个月。LMR最佳截断值为3.16,其中高LMR组20例,低LMR组30例,中位OS分别为18.5个月和9.7个月。生存结果分析提示,OS在高、低LMR组间差异有统计学意义(χ2=8.47,P<0.01)(见图2)。单因素Cox分析显示,性别、有无脏器转移和基线LMR与OS相关(P<0.05~P<0.01)(见表5)。将性别、有无脏器转移和基线LMR纳入多因素Cox回归分析,结果显示,性别、有无脏器转移和基线LMR均是ES-SCLC病人OS的独立预测因素(P<0.05~P<0.01)(见表6)。
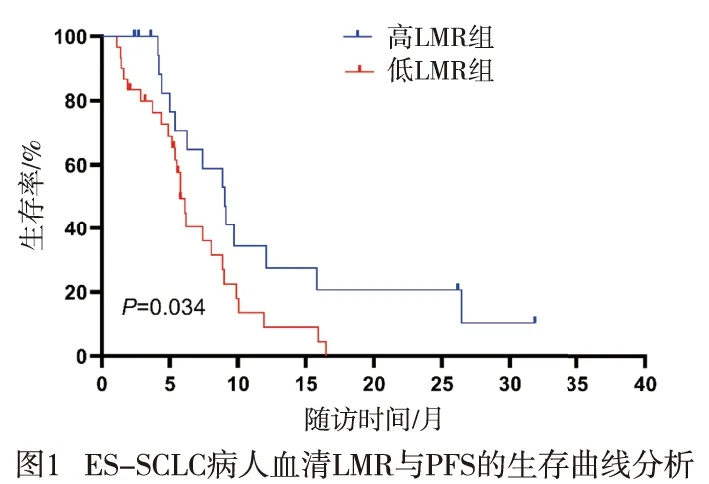
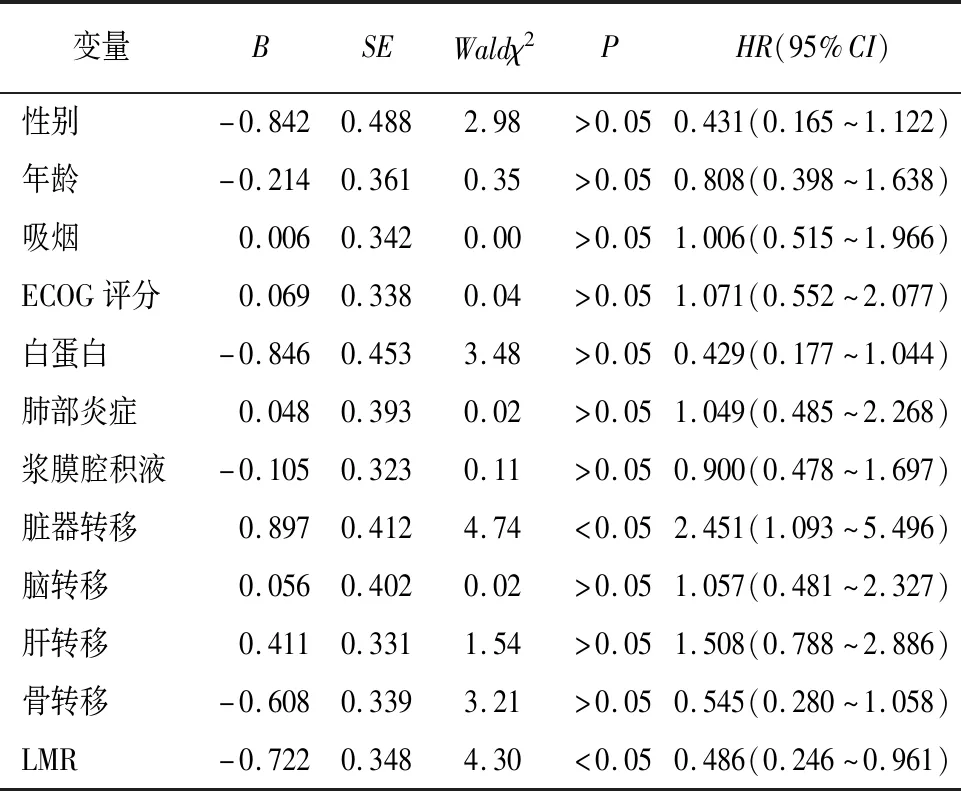
表3 ES-SCLC病人PFS的单因素Cox回归分析
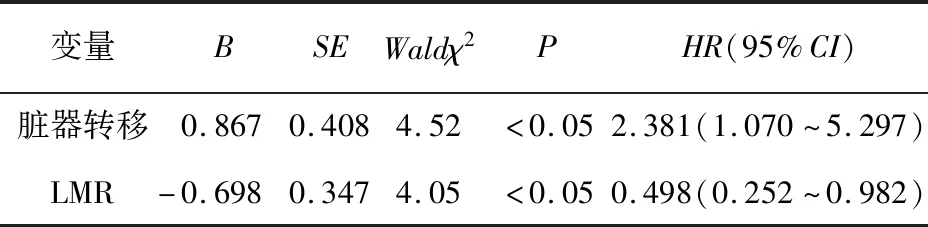
表4 ES-SCLC病人PFS的多因素Cox回归分析
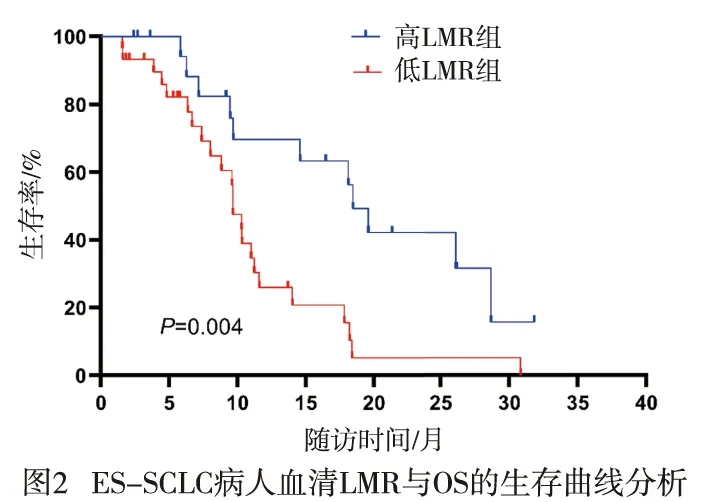
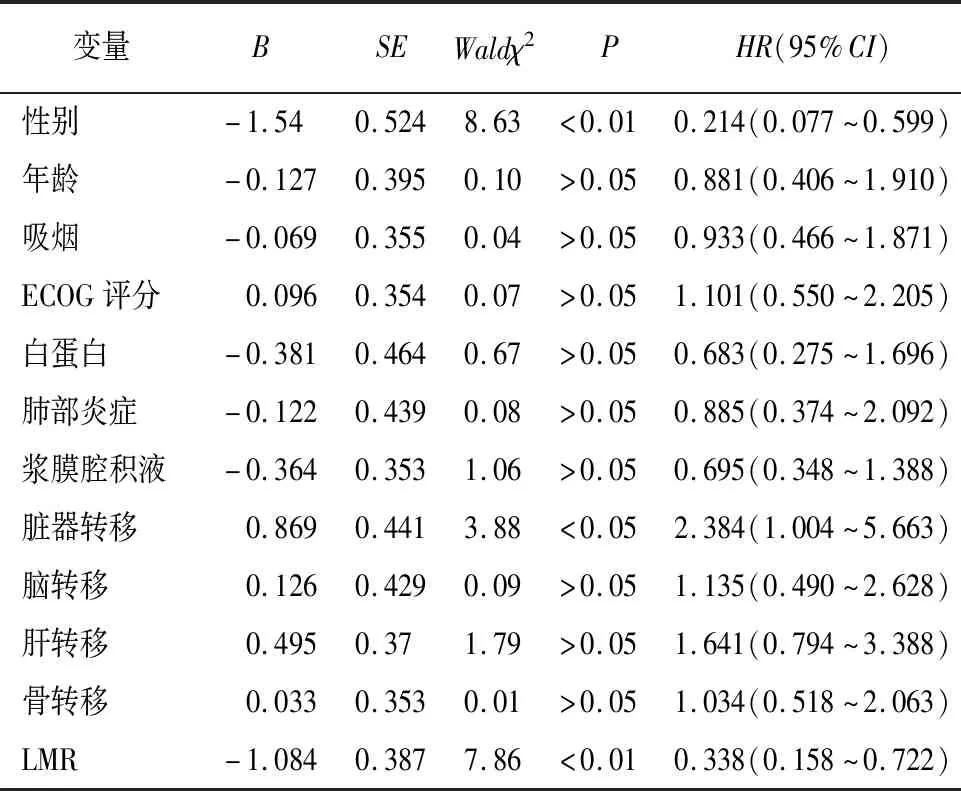
表5 ES-SCLC病人OS的单因素Cox回归分析

表6 ES-SCLC病人OS的多因素Cox回归分析
3 讨论
本研究纳入的50例病人,一线化疗的近期疗效评价指标ORR为50.0%、DCR为86.0%,远期疗效评价指标中位PFS为7.4个月、中位OS为11.0个月。国际研究[5]中卡铂联合依托泊苷化疗组的中位PFS 4.3个月、中位OS 10.3个月。CHENG等[12]研究中,顺铂联合依托泊苷作为ES-SCLC病人一线治疗方案的ORR为53.9%、DCR为85.5%,中位PFS为5.3个月、中位OS为9.7个月。其中,本研究PFS相较于临床试验长,考虑是病人未能接受和临床试验一样严密的医学观察,复查不规律或者影像学评估滞后所致。本研究其余疗效评价指标与临床试验高度一致,可见,本中心研究数据具有一定的代表性。
近年来,肿瘤与免疫、炎症反应的关系被广泛研究。肿瘤细胞在免疫逃逸的同时,可以通过全身炎症反应创造有利的微环境,来促进其自身生长、侵袭和转移[13]。淋巴细胞包括CD8+细胞毒性T细胞(CD8+cytotoxic T cells,CTL)和CD4+辅助性T细胞(CD4+helper T cells,Th),是免疫系统的主要成分。CTL可通过组织相容复合体Ⅰ类分子杀伤肿瘤细胞,Th主要通过激活CTL、NK细胞,及产生肿瘤坏死因子等发挥免疫作用[14]。因此,淋巴细胞减少将导致机体抗肿瘤免疫应答能力减弱,使肿瘤易于进展和扩散,进而影响病人的治疗效果和转归。外周血淋巴细胞计数的减少与包括ES-SCLC在内的多种恶性肿瘤病人较短的OS相关[15-17],因此,本研究推断淋巴细胞计数可有效反映宿主的免疫功能,从而影响预后。单核细胞可参与病原体的清除和炎症反应,与此同时,其在粒细胞-巨噬细胞集落刺激因子和白细胞介素(IL)-4的作用下可刺激T淋巴细胞活化[18],因此单核细胞也是免疫细胞的重要组成部分。单核细胞趋化到肿瘤组织后,可分化成肿瘤相关巨噬细胞(tumor-associated macrophages,TAMs)。TAMs是肿瘤组织中炎症浸润的重要部分,可促进许多生长因子等物质的产生,进而促进肿瘤侵袭和迁移[19-20]。另外,TAMs和肿瘤细胞可通过产生IL-10来削弱CTL的抗肿瘤反应[21],从而帮助肿瘤细胞发生免疫逃逸。因此,肿瘤相关的炎症反应可抑制机体免疫力。我们推测,结合这两个参数获得的LMR可对机体的免疫应答能力和肿瘤负荷水平进行有效评估。
本研究结果显示,由基线血清淋巴细胞和单核细胞计数计算所得的LMR值是ES-SCLC独立预后指标,LMR越低,预后越差。淋巴细胞计数低、单核细胞计数高提示宿主免疫应答能力较差和肿瘤负荷较重,往往反映肿瘤病人的预后不佳。这与之前LMR对多种恶性肿瘤预后影响的研究[8-10]结果相一致,共同支持较低的LMR与ES-SCLC病人较短的PFS和OS相关这一研究发现。关于PFS、OS的Cox回归分析结果表明,有无脏器转移是PFS、OS的独立预测指标,性别和OS相关。MINAMI等[22]发现,有无脏器转移是ES-SCLC病人的独立预后因素,因为肿瘤负荷会影响病人预后;而性别与OS不相关。但许文娟等[23]发现,性别是SCLC病人的独立预后指标,可能与基因易感性、激素水平等对生存状况产生的影响相关。因此,性别与ES-SCLC病人OS的相关性尚待进一步明确。
另外本研究还发现,基线LMR可预测ES-SCLC的一线化疗疗效,体现在LMR越低,化疗疗效越差。这与既往在多种肿瘤上探索LMR的疗效预测价值的研究[6-8]发现一致。TAMs可通过增加肿瘤基质密度、诱导肿瘤细胞发生上皮间充质转化等过程,影响化疗药物进入肿瘤细胞,同时增强肿瘤细胞自身抗凋亡能力,从而参与肿瘤的化疗耐药[24]。而且,由单核巨噬细胞产生的IL-6也被发现可通过分泌抗凋亡蛋白增加肺癌对化疗药物的耐药性[25]。这些研究均支持LMR有作为恶性肿瘤化疗疗效预测标志物的潜在价值。
本研究在对LMR与ES-SCLC临床变量关系分析时发现,低蛋白血症、骨转移病人LMR更低。在应答肿瘤过程中,单核巨噬细胞通过分泌肿瘤坏死因子α,进而抑制白蛋白的合成;另外其释放的炎症因子损伤内皮细胞,也可以导致毛细血管通透性增加,血清白蛋白漏出,因此LMR指标一定程度上可以间接反映血清白蛋白含量,这一点也在其他恶性肿瘤的研究[26]中得到证实。肺癌骨转移大多是溶骨型病变,扩散到骨髓中的肿瘤细胞可分泌多种炎症因子,这些细胞因子通过激活RANKL通路产生成熟的破骨细胞,引起骨吸收[27]。淋巴细胞可直接或间接杀伤肿瘤细胞,因此骨转移病人外周血淋巴细胞计数可能相对较低,同时该类病人因炎症因子释放影响单核细胞计数,导致其LMR倾向于更低。
综上所述,LMR是一种计算简便、易于获得的免疫炎症指标,有作为预测ES-SCLC病人一线化疗疗效和预后生物标志物的潜在价值,未来检测基线LMR对于该类病人的疾病管理具有重要意义。但本研究结果基于小样本的单中心回顾性数据,在本研究结论推广前需更大样本量的多中心前瞻性研究对其进行验证。

