长春胺调控TLR4/NF-κB信号改善2,4,6-三硝基苯磺酸诱导的小鼠结肠炎
李晶晶,杨 子,崔 腾,周国羊,王祎宸,左芦根,张小凤
克罗恩病(Crohn′s disease,CD)是一种以肠道慢性复发性炎症为主要病理改变的炎症性肠病(inflammatory bowel disease,IBD)[1]。近年来CD在我国的发病率不断攀升,已然成为消化系统常见的难治性疾病[2]。药物治疗是CD的主要治疗方式,然而遗憾的是当前用于临床治疗的药物多存在药效不佳、药物抵抗、药物不耐受或不良反应较大等不足,因此寻找新的、更为有效的抗肠炎药物是当前CD研究领域亟需解决的问题[3]。长春胺(vincamine,VC)是一种从夹竹桃植物长春花中所提取出的一种天然小分子化合物(分子式:C21H26N2O3;分子量:354.443),被报道具有拮抗炎症、细胞保护等多种生物学功能[4-5],但其是否能够影响CD肠炎尚不明确。本研究拟以2,4,6-三硝基苯磺酸(2,4,6-trinitrobenzene sulfonic acid,TNBS)诱导的小鼠结肠炎作为CD模型,观察VC干预对CD样结肠炎的作用效果,并采用网络药理学、分子对接和实验验证等方式探索VC可能的作用机制。
1 材料与方法
1.1 动物分组、干预和取检 将24只雄性Wild-type(WT)小鼠随机分为对照组(WT组)、模型组(TNBS组)和VC干预组(VC组),每组8只。TNBS组和VC组小鼠接受TNBS(Sigma,USA)造模处理,小鼠麻醉(1% 戊巴比妥钠)后,肛门涂抹石蜡油,置入软质肛管并注入0.1 mL的2.5% TNBS乙醇溶液,头低足高45°倾斜体位15 min后复位[6]。造模当天,将VC(Topscience,China)于1% 吐温80中溶解,并以40 mg·kg-1·d-1的量对VC组小鼠进行灌胃处理[7],TNBS组和WT组接受等量的1% 吐温80灌胃。连续干预一周后采用脱颈法处死小鼠,留取小鼠结肠组织分别-80 ℃冻存和福尔马林固定。每日记录小鼠腹泻、稀便等肠炎症状;实验前和取检前称量小鼠体质量;于取检时测量各组小鼠的结肠长度。
1.2 小鼠肠炎的临床症状、病理组织学和炎症介质水平评估 小鼠肠炎症状采用肠炎疾病活动度(disease activity index,DAI)量表进行评估,评分范围为0~5分,分值高代表肠炎症状重[8]。小鼠肠炎病理组织学评估依据苏木精/伊红(HE)染色结果,参照Spencer推荐的肠炎组织学评分标准进行,评分范围为0~4分,分数越高代表肠炎越重[9]。另取冰冻结肠组织,充分研磨后,依据产品说明书采用酶联免疫吸附法(ELISA)检测结肠黏膜炎症因子水平,包括:肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)和白细胞介素-6(interleukin-6,IL-6)。
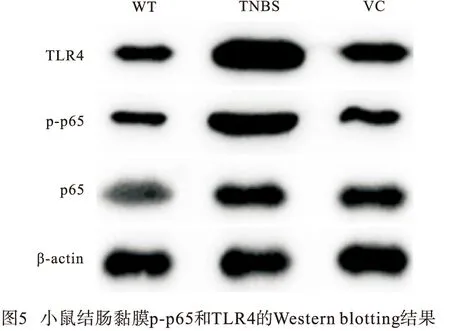
1.3 Western blotting检测结肠组织中p-p65、p65及TLR4蛋白表达情况 小鼠结肠组织于称重后置于RIPA裂解液中充分研磨震荡,并使用高速离心机分离上清。经BCA法检测目标蛋白浓度后,依次进行上样、电泳、转膜、脱脂牛奶封闭、孵育一抗(anti-TLR4,anti-p-p65,anti-p65,anti-β-actin)及二抗;再经ECL化学发光液显色,凝胶成像仪显影,最后使用ImageJ软件分析目的条带的灰度值并计算相对表达量。Western blotting检测所用抗体均购买于美国Abcam公司。
1.4 预测VC治疗CD的潜在靶点 将从PubChem数据库(https://pubchem.ncbi.nlm.nih.gov/)获得VC SMILE式,输入SuperPred数据库(https://prediction.charite.de/subpages/target_predicton.php)中,得到VC的潜在作用靶点,并通过Uniprot网站(https://www.uniprot.org/)进行基因名称转换。利用DisGeNet数据库(https://www.disgenet.org/)检索与CD相关的疾病靶点。将筛选得到的VC潜在作用靶点及CD相关靶点导入Venny 2.1 在线工具(https://bioinfogp.cnb.csic.es/tools/venny/),绘制韦恩图,并得到二者交集靶点基因。
1.5 构建蛋白-蛋白互作网络 将交集靶点导入String数据库(https://cn.string-db.org/)构建蛋白-蛋白互作网络(protein-protein interaction,PPI),选择“Multiple proteins”,物种设为“Homo sapiens”,获取蛋白与蛋白之间的互作信息,并将文件导入Cytoscape软件绘制PPI网络,分析其网络拓扑参数。
1.6 GO(Gene Ontology)和KEGG(Kyoto Encyclopedia of Genes and Genomes)富集分析 将交集靶点导入DAVID(https://david.ncifcrf.gov/)在线数据库进行功能注释及通路分析,选定物种为智人(homo spaiens),并将GO分析筛选出的生物过程、分子功能、细胞成分以及KEGG富集的通路进行可视化处理。
1.7 分子对接模拟验证 在PDB 数据库中下载靶点蛋白及3D 结构pdb 格式文件,在PubChem 数据库中下载VC 2D 结构sdf 格式,通过Open Babel GUI软件转换得到VC的pdb 格式文件。采用AutoDock 4.2.6软件进行VC与关键靶点的分子对接并计算其结合能。利用PyMOL软件对结果进行可视化分析。
1.8 统计学方法 采用方差分析和t检验。
2 结果
2.1 各组小鼠体质量改变、DAI评分和结肠长度比较 VC干预后,VC组小鼠体质量下降幅度高于TNBS组(P<0.05),但仍低于WT组(P<0.05);VC组小鼠DAI评分低于TNBS组(P<0.05);VC组小鼠结肠长度长于TNBS组(P<0.05),但仍短于WT组(P<0.05)(见表1)。
表1 小鼠体质量改变、DAI评分和结肠长度比较
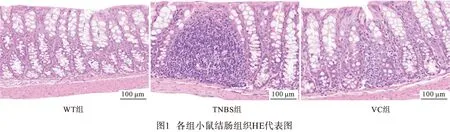
2.2 各组小鼠结肠组织学炎症评分比较 HE染色结果显示,WT小鼠结肠黏膜内未见明显的炎症细胞浸润,TNBS组小鼠结肠黏膜内可见大量炎症细胞浸润和聚集,而VC组小鼠结肠黏膜内仅见少量的炎症细胞浸润。同时,VC组小鼠结肠组织学炎症评分低于TNBS组(P<0.05)(见图1、表2)。
表2 小鼠结肠组织学炎症评分比较
2.3 各组小鼠结肠黏膜炎症介质水平比较 ELISA结果显示,VC组小鼠结肠黏膜炎症介质(TNF-α、IL-1β、IL-6)水平低于TNBS组(P<0.05),但仍高于WT组(P<0.05)(见表3)。
表3 小鼠肠黏膜炎症介质水平比较
2.4 网络药理学预测VC作用靶点和PPI网络分析 通过SuperPred数据库共获得VC 110个作用靶点。通过DisGeNet数据库检索到CD相关疾病靶点1 382个,将两者取交集后共获得VC治疗CD的潜在作用靶点31个(见图2A)。将上述31个交集靶点录入STRING数据库进行分析,并得到蛋白相互作用关系网络,共涉及到31个节点,70条边。在PPI网络中,Degree值是评价网络中靶点贡献程度的重要参数,根据其数值大小筛选出排名靠前的关键靶点,数值越大,提示靶点的贡献度越高。根据Degree值筛选出拓扑参数排名前10的靶蛋白,其中TLR4、CHUK、STAT3、PTGS2、NFKB1、HIF1A 之间的相互作用关系最为密切(见图2B、表4)。
2.5 GO和KEGG富集分析 对31个交集靶点进行GO富集分析,结果显示VC治疗CD主要涉及82个生物过程条目、18个细胞组分条目和19个生物分子条目。其中生物过程条目主要涉及炎症反应等;分子功能条目主要涉及酶结合等;细胞组分条目则集中于细胞膜、细胞表面等(见图3A、B、C)。KEGG通路富集分析得到82条可能相关的通路,选择前20条进行可视化处理(见图3D)。其中NF-κB通路与炎症反应进程最为相关,且TLR4为VC作用于CD的关键靶点,因此我们推测VC可能通过TLR4/NF-κB信号通路改善TNBS小鼠CD样结肠炎。


表4 VC治疗CD的关键靶点信息表
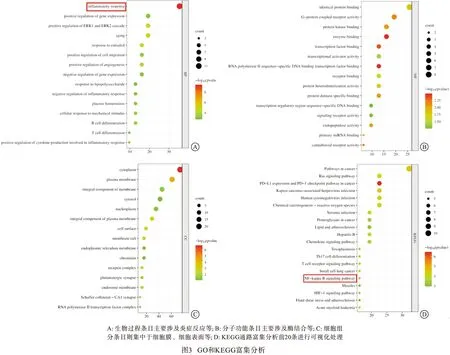
2.6 分子对接技术验证VC作用靶点 选取NF-κB信号通路相关靶点TLR4、PTGS2、NFKB1分别与VC进行分子对接验证(见图4)。采用结合能评价小分子药物和大分子蛋白的结合情况:若结合能小于0 kcal/mol,表明VC能与该蛋白可进行自发结合;结合能绝对值越大,表明发生结合作用的可能性越大。分子对接结果显示,VC与以上3个靶点的结合能均小于0 kcal/mol(见表5),证明VC与TLR4、PTGS2、NFKB1具有较强的结合力。以上结果提示VC可能通过调控NF-κB信号通路发挥改善TNBS小鼠CD样结肠炎作用。
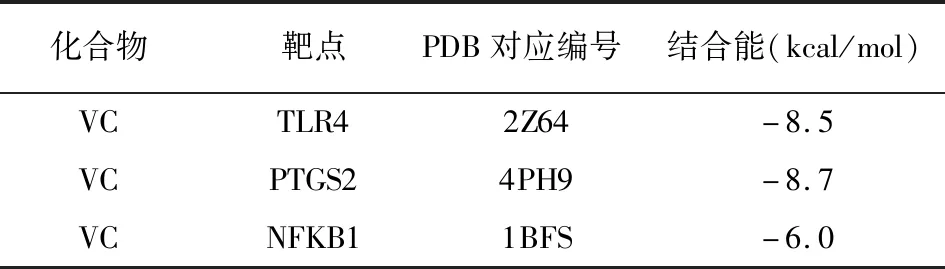
表5 分子对接结果
2.7 在体验证VC对TNBS模型小鼠TLR4/NF-κB信号的调控作用 Western blotting分析显示,VC组小鼠结肠黏膜组织中TLR4和p-p65水平较TNBS组降低(P<0.05),但仍高于WT组(P<0.05)(见图5、表6)。
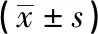
表6 小鼠结肠黏膜p-p65和TLR4蛋白水平比较
3 讨论
本研究发现天然植物化合物VC可显著改善TNBS模型小鼠的肠道炎症症状、组织学损伤并抑制肠黏膜促炎介质水平,这可能与其调控TLR4/NF-κB信号有关。
我们以TNBS模型小鼠为研究对象,其具有与人类CD相似的肠炎症状[10]。随着肠炎进展,体质量减轻,DAI评分增加及结肠缩短是CD模型小鼠基本的临床表现[11]。本研究发现,VC干预同时缓解了TNBS模型小鼠体质量减轻,DAI评分增加以及结肠缩短等临床症状,提示VC具有保护TNBS模型小鼠肠道炎症的潜力。同时,HE染色发现,VC显著抑制了TNBS模型小鼠结肠黏膜组织中炎症细胞的浸润和聚集;且基于HE染色对各组小鼠结肠进行组织病理学评分发现,VC组小鼠呈现比TNBS组更低的炎症评分。此外,ELISA检测结果显示,TNBS模型小鼠结肠黏组织中促炎介质水平(TNF-α、IL-1β、IL-6)经VC作用后得到了显著降低。因此,我们的研究分别从肠炎临床症状、组织病理学及分子水平三个层面共同证实了VC在体干预对TNBS模型小鼠的CD样肠道炎症具有保护作用。新近研究[5]表明,VC不仅可保护人类角膜上皮细胞免受脂多糖(LPS)的炎性损伤,还对LPS诱导小鼠急性肺损伤具有缓解作用[7],而我们的研究不仅进一步证实了VC的抗炎作用,同时拓展了其疾病应用领域。
接下来,我们尝试探讨VC缓解CD样肠炎的可能分子机制。通过SuperPred和DisGeNet数据库筛选得到VC治疗CD的潜在作用靶点31个,并对其进行GO和KEGG富集分析,结果表明VC主要参与炎症反应的调控过程,且提示TLR4/NF-κB通路可能在VC治疗CD肠炎过程中扮演重要角色;此外,分子对接显示VC与TLR4、PTGS2及NFKB1均具有较稳定的结合力。以上结果证明VC对TLR4/NF-κB通路具有潜在的调控作用。既往研究[12-13]表明,TLR4/NF-κB是调控炎症的关键信号通路,且与CD肠炎发生发展密切相关。因此,我们采用Western blotting技术对各组小鼠结肠黏膜中TLR4和p-p65的水平进行检测,结果显示VC干预可显著抑制TNBS模型小鼠结肠黏膜组织中TLR4和p-p65的水平。以上结果提示,VC可能通过抑制TLR4/NF-κB信号发挥缓解TNBS模型小鼠CD样结肠炎作用。相关研究显示,VC还可通过调控其他条信号通路发挥其生物学保护作用。例如,在肾缺血/再灌注损伤模型中,VC可通过抑制MAPK和凋亡信号通路缓解泮托拉唑诱导的肾组织损伤[4];在三苯氧胺诱导的急性肝损伤模型中,VC可通过抑制JNK/ERK通路发挥抑制小鼠肝脏组织的氧化应激和炎症反应[14]。我们的研究进一步丰富了VC发挥生物学功能的可能分子机制。
尽管手术可切除病变肠管,但无法治愈CD,因此药物治疗对缓解CD进步进展至关重要[15]。当前以TNF-α单抗为代表的CD治疗药物尽管取得了一定的疗效,但均存在不同程度的局限性,因此探寻更为安全有效的CD治疗药物是当前亟需解决的难题[16]。近年来,天然植物提取物的药用价值受到学术界关注,其应用于炎症性疾病的治疗成为当前研究的热点[17-18]。VC作为一种天然的小分子化合物[4],我们基于其强大的抗炎和细胞保护效应,进一步证明了VC对CD样肠炎具有保护作用,提示其具有潜在的药物开发及应用价值,有望为CD治疗药物的选择提供新的参考。
本研究还存在不足之处:一方面,鉴于VC的生物学功能尚未得到完全揭示,本研究仅证明了VC对CD样肠炎具有保护作用,但具体的功能学途径仍有待进一步探究。另一方面,TLR4/NF-κB通路只能在一定程度上解释VC缓解CD样肠炎的可能机制,但不能排除其他信号通路的可能。
综上,VC可能通过抑制TLR4/NF-κB通路发挥缓解TNBS小鼠CD样肠道炎症的作用。

