新疆阿克苏地区猪源粪肠球菌耐药性分析及相关耐药基因的检测
王 东,易海波,李宏博,秦 蕾,徐琦琦,吴慧敏,夏利宁
(1.新疆农业大学动物医学学院,乌鲁木齐 830052;2.新疆昭苏县喀夏加尔镇畜牧兽医站,新疆昭苏 835618)
0 引 言
【研究意义】肠球菌属于人和动物的正常肠道共栖菌,但是在特定的情况下也会引起诸如尿道感染、菌血症、脑膜炎等重要感染,严重时会导致死亡[1]。目前临床肠球菌感染大部是由粪肠球菌和屎肠球菌引起的,占比达到85%~95%[2]。肠球菌属于医院感染的重要病原菌之一[3],肠球菌作为生猪体内的常在菌,对当地猪源粪肠球菌的进行耐药监测,可以预测当地耐药情况,防止病原菌通过食物链传播。【前人研究进展】肠球菌不仅对头孢菌素类、磺胺类、低浓度的氨基糖苷类与林可胺类药物存在固有耐药[4],还能够捕获外源耐药基因使自身获得性耐药[5],增加了临床治疗肠球菌感染的难度。【本研究切入点】肠球菌在耐药性传播的问题上往往担任着耐药基因“储存库”的角色,不仅具有将自身携带的耐药基因通过水平转移的方式传递其他细菌的能力[6],还能通过食物链在人和动物之间传播[7]。目前新疆关于粪肠球菌耐药性及相关耐药基因研究的报道较少。需进行新疆阿克苏地区猪源粪肠球菌耐药性分析及相关耐药基因的检测。【拟解决关键问题】以阿克苏地区三个猪场的猪源粪肠球菌为研究对象,分析阿克苏地区猪源粪肠球菌的耐药数据,为养殖场制定合理用药方案提供数据支撑,为该地区的耐药性监测提供必要的理论依据。
1 材料与方法
1.1 材 料
1.1.1 样品来源
2018年11月在阿克苏地区A、B、C三个猪场的猪只肛拭子采集样本。
1.1.2 菌株及培养基
粪肠球菌标准质控菌株(ATCC29212)、金黄色葡萄球菌标准质控菌株(ATCC29213)购自杭州天和微生物试剂有限公司;肠球菌选择培养基(胆汁七叶苷叠氮钠琼脂)、脑心浸肉汤(BHI)、MH肉汤(MHB)培养基均购自北京奥博星有限公司。
1.1.3 药 品
大环内酯类:红霉素、泰乐菌素;噁唑烷酮类:利奈唑胺;四环素类:四环素、多西环素;糖肽类:万古霉素;酰氨醇类:氟苯尼考;喹诺酮类:左氧氟沙星、恩诺沙星;氨基糖苷类:庆大霉素;截短侧耳素类:沃尼妙林;以上药物均购自上海源叶生物科技有限公司。
1.2 方 法
1.2.1 肠球菌的分离鉴定
通过灭菌棉签采集猪直肠粪样后置于经过灭菌的装有1 mL MH肉汤的2 mL规格的EP管中,采集后的样品置于4 ℃冰箱中保存,完全采集完毕后,通过将样品置于含有低温冰袋的泡沫箱后运回。
将带有灭菌肉汤的肛拭子置于恒温摇床中37 ℃,180 r/min过夜培养增菌;接取5 μL菌液于含6.5% NaCl的BHI肉汤中置于恒温摇床中42 ℃,180 r/min,培养16~18 h,使用接种环蘸取一环菌液划线涂布与肠球菌选择培养基上,倒置于37 ℃恒温培养箱中培养24 h。挑取平板上大小适中、白色圆滑凸起且菌落周围显示黑色的单菌落,初步鉴定为肠球菌,挑取单菌落至灭菌BHI培养基中,恒温摇床42 ℃,180 r/min过夜培养保藏至-20 ℃冰箱备用。
使用水煮法[8]提取疑似菌株DNA模板,根据文献[9]序列合成粪肠球菌持家基因引物,引物由生工生物工程(上海)股份有限公司合成。使用PCR的方法鉴定粪肠球菌,并将疑似菌株送往生工生物工程(上海)股份有限公司进行16S测序进行鉴定。 表1
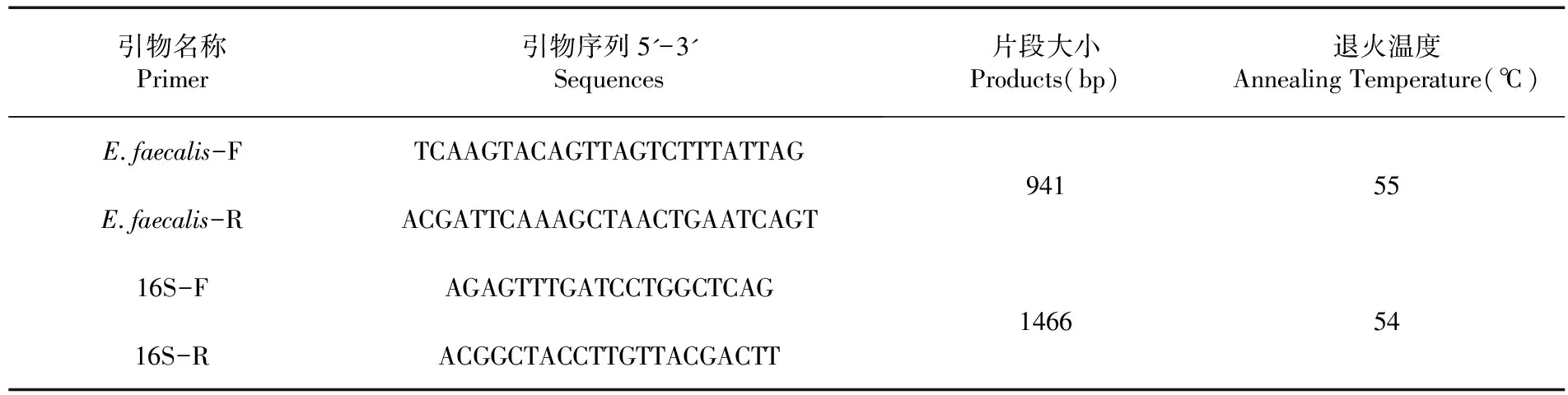
表1 肠球菌鉴定引物序列
1.2.2 药物敏感性
根据美国临床实验室标准委员会(Clinical and Laboratory Standards Institute, CLSI)发布的抗微生物抗菌药物敏感性试验的标准[10, 11],对分离的粪肠球菌进行8大类12种药物的最小抑菌浓度测定(MIC),采用粪肠球菌标准菌株ATCC29212、测试菌株结果以敏感(S)、中介(I)、耐药(R)表示。
1.2.3 相关耐药基因测定
根据文献[12, 13],合成相关耐药基因引物,引物由生工生物工程(上海)股份有限公司合成,使用PCR方法检测粪肠球菌的耐药基因。表2
1.3 数据处理
使用IBM SPSS Statistics 26.0进行数据分析,对药敏结果以及多重耐药结果使用卡方或Fisher精确检验进行非参数检验,P<0.05为差异显著。
2 结果与分析
2.1 三个猪场猪源粪肠球菌分离情况
研究表明,从阿克苏地区三个猪场共采集样品624份,A、B、C三个猪场采集的样品数依次为269份、234份、121份,共分离粪肠球菌160株,总体分离率为25.6%,A、B、C猪场分离粪肠球菌数依次为44株、81株、35株,其分离率依次为16.4%、34.6%、28.9%。表3
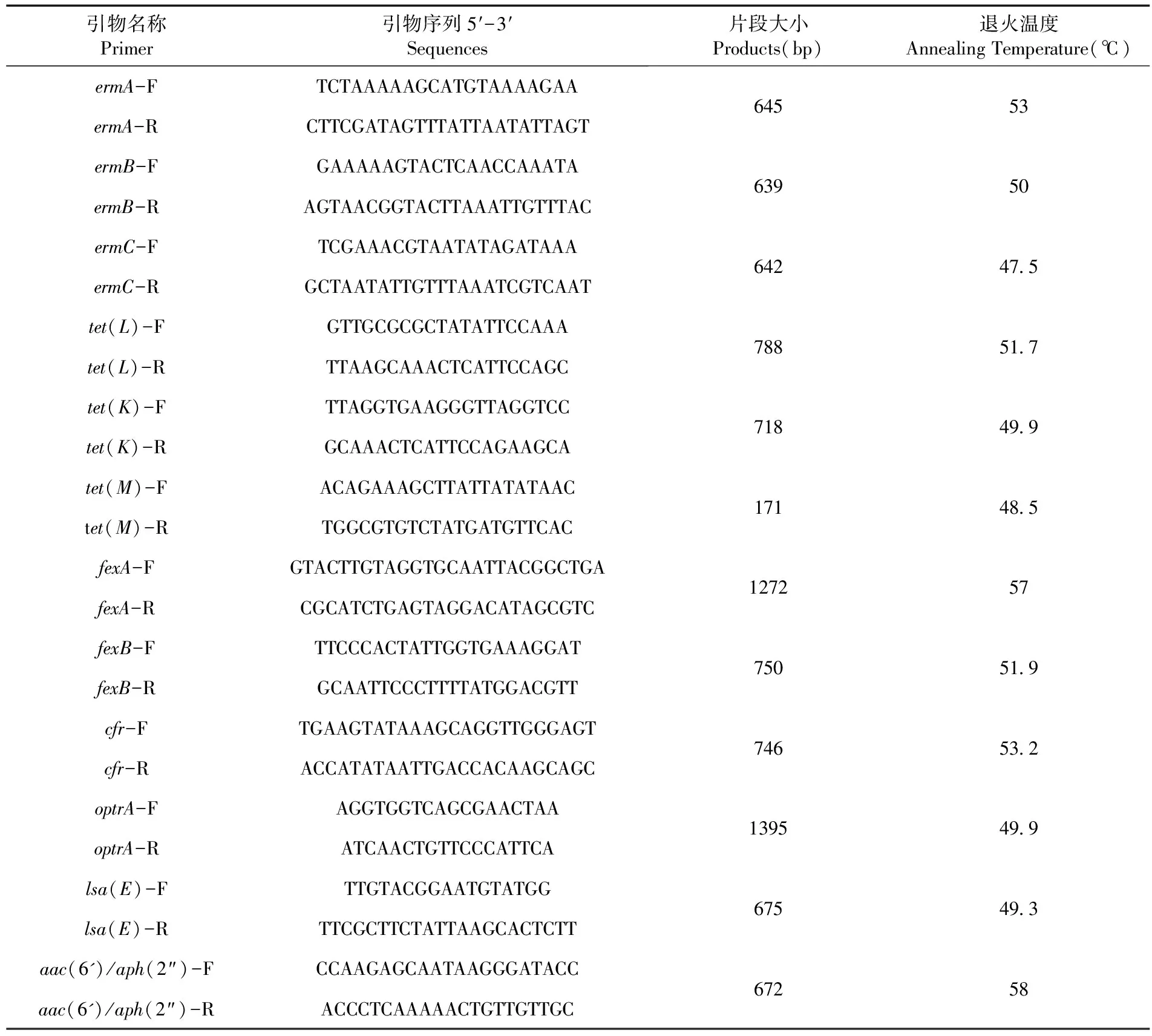
表2 相关耐药基因引物序列
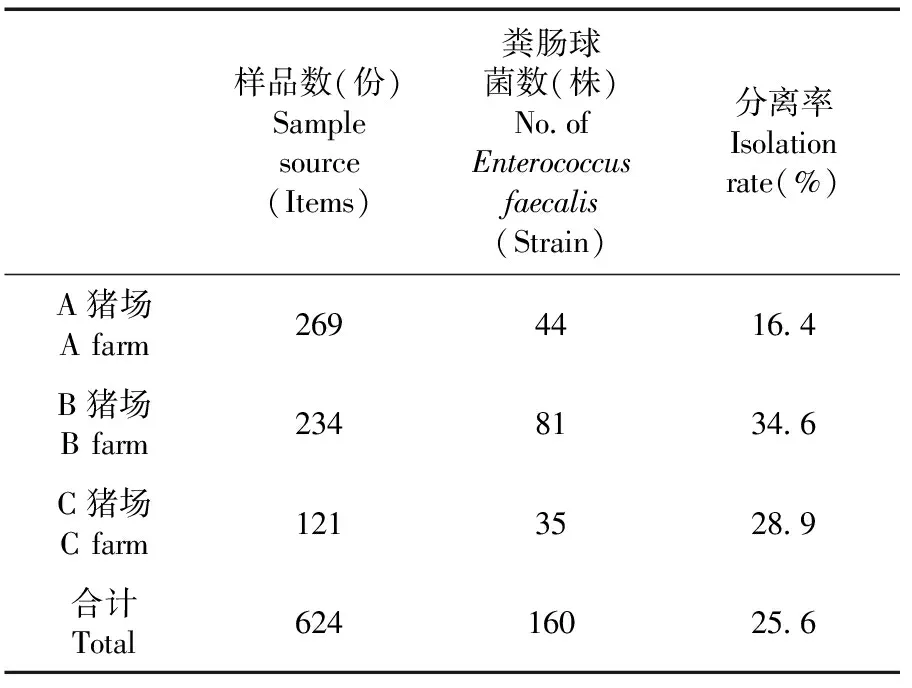
表3 阿克苏地区三个猪场猪源粪肠球菌分离
2.2 阿克苏地区三个猪场猪源肠球菌的耐药变化
研究表明,B猪场对所检12种药物的耐药菌株分离率显著高于A和C猪场(P<0.05),A、C两个猪场之间差异不显著(P>0.05),三个猪场对红霉素、泰乐菌素、四环素、多西环素、庆大霉素和沃尼妙林的耐药率均达到90%以上,其中对利奈唑胺、氟苯尼考、左氧氟沙星及恩诺沙星的耐药率分别为21.3%、30.6%、53.8%和57.5%。B猪场粪肠球菌分离株对这几种药物的耐药率显著高于A、C两个猪场(P<0.05);A猪场粪肠球菌分离株对恩诺沙星及氟苯尼考的耐药率显著高于C猪场(P<0.05);其余药物A、B、C猪场粪肠球菌分离株的耐药率之间差异不显著(P>0.05)。表4
2.3 阿克苏地区3个猪场猪源粪肠球菌的多药耐药变化
研究表明,A猪场的耐药谱型在4~9耐之间,以6耐和7耐为主,占比70.4%;B猪场的耐药谱型在7~10耐,以8耐和10耐为主,占比为81.4%;C猪场的耐药谱型在3~8耐,以6耐为主,占比为80.0%。B猪场在8、9以及10耐的菌株占比显著高于其余两个猪场(P<0.05);C猪场6耐菌株占比显著高于A和B猪场(P<0.05)。三个猪场猪源粪肠球菌的耐药严重程度依次为B猪场、A猪场、C猪场。表5
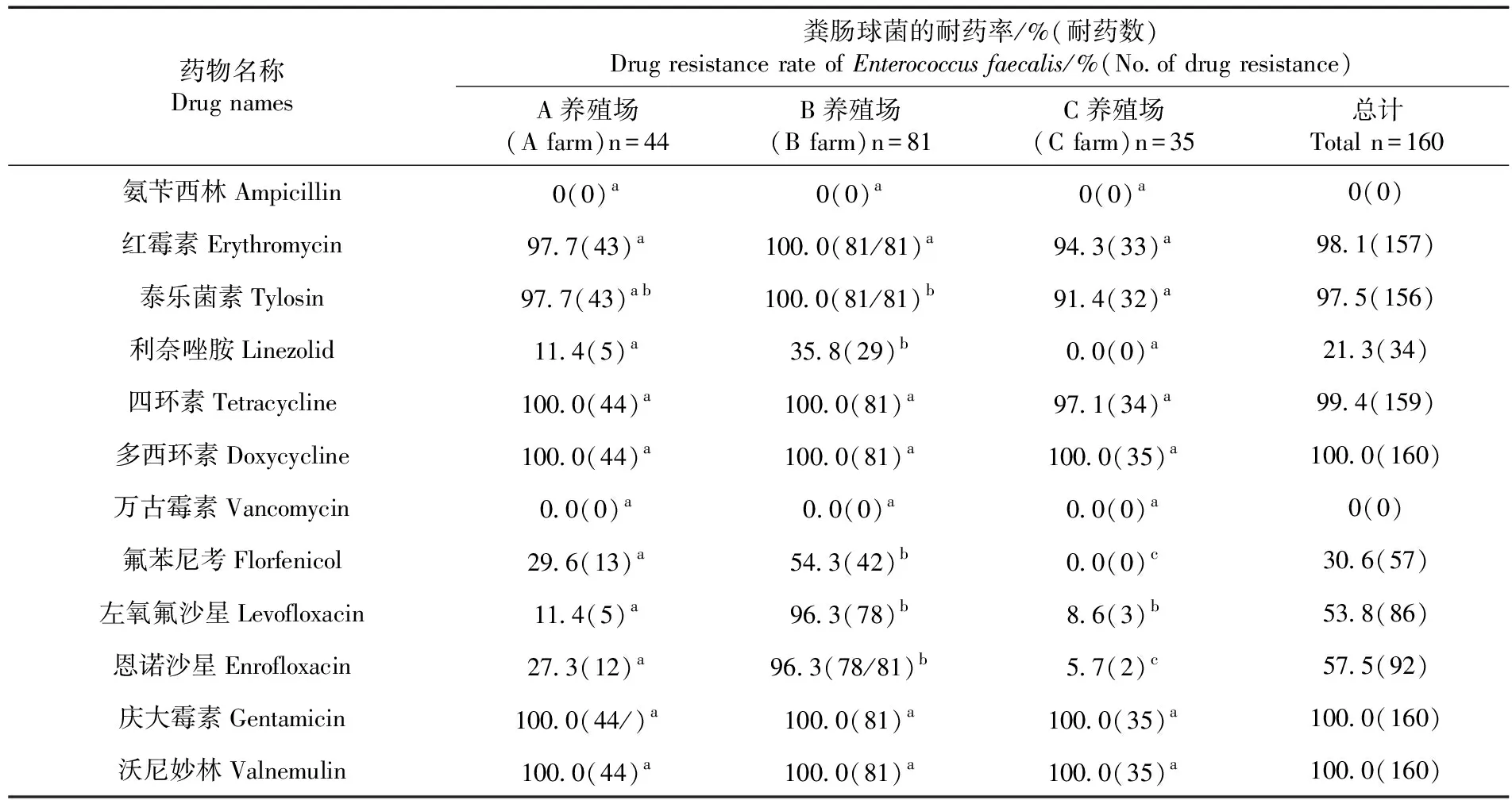
表4 阿克苏地区三个猪场猪源肠球菌的耐药变化
表5 阿克苏地区3个猪场猪源粪肠球菌的多药耐药变化
2.4 猪源粪肠球菌耐药基因检出情况
研究表明,阿克苏地区三个猪场的猪源粪肠球菌均检出ermB、ermC、tet(K)、tet(L)、tet(M)、aac(6')/aph(2")、lsa(E)基因,其中ermB基因在A、B、C三个猪场的检出率依次为90.9%(40/44)、100(81/81)、94.29%(33/35),ermC基因在A、B、C三个猪场的检出率依次为70.5%(31/44)、51.9%(42/81)、80.0%(28/35),tet(K)基因在A、B、C三个猪场的检出率依次为95.5%(42/44)、74.1%(60/81)、68.6%(24/35),tet(L)基因在A、B、C三个猪场的检出率依次为97.7%(43/44)、86.4%(70/81)、77.1%(27/35),tet(M)基因在A、B、C三个猪场的检出率均为100.0%,aac(6')/aph(2")基因在A、B、C三个猪场的检出率依次为29.6%(13/44)、79.0%(64/81)、25.7%(9/35),lsa(E)基因在A、B、C三个猪场的检出率依次为15.9%(7/44)、60.5%(49/81)、22.7%(8/35);ermA、fexA、optrA基因仅在A和B两个猪场检出,其中ermA在A、B两个猪场的检出率分别为15.9%(7/44)和37.0%(30/81),fexA在A、B两个猪场的检出率分别为15.9%(7/44)和51.9%(42/81),optrA基因检A、B两个猪场的检出率分别为15.9%(7/44)和45.68%(37/81);fexB基因仅在B猪场检出,检出率为1.23%(1/81);三个猪场均未检出多药耐药基因cfr。图1
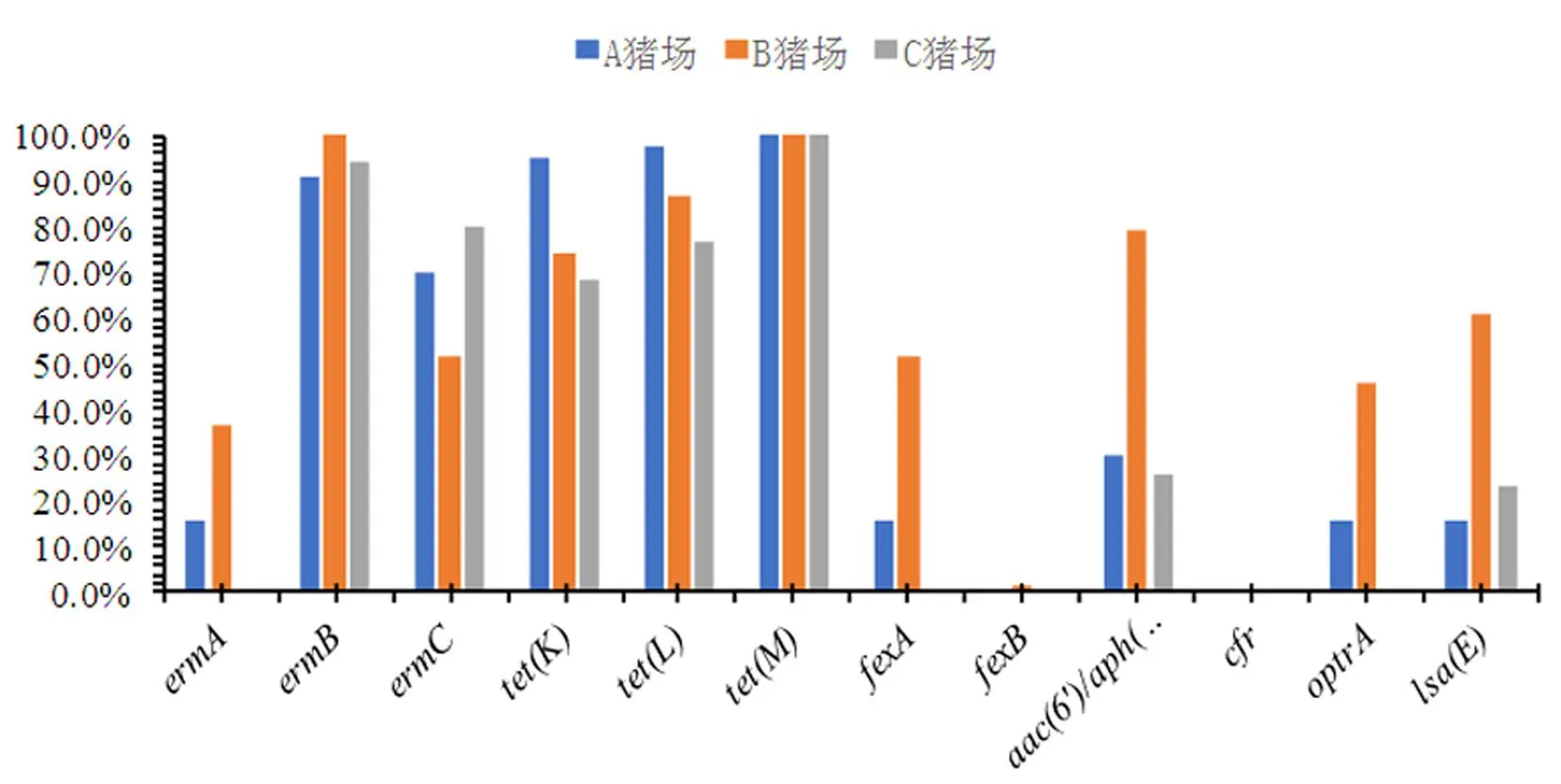
图1 猪源粪肠球菌耐药基因检出情况Fig. 1 Situation of detection of drug resistance genes of Enterococcus faecalis from pigs
3 讨 论
3.1随着抗菌药物在养殖业的不断使用,细菌耐药性的问题开始逐渐显现出来[14,15]。目前多个国家和地区的抗生素监测系统已将肠球菌作为耐药性监测的指示菌[16]。
分离结果显示:研究在阿克苏地区部分猪场分离的粪肠球菌总体分离率为25.6%,低于董鹏[17]在河南地区所分的猪源粪肠球菌的分离率(51.3%),可能地域不同、采样时间不同等因素导致的。
3.2药敏结果显示:阿克苏地区不同猪场对红霉素、泰乐菌素、四环素、多西环素、庆大霉素和沃尼妙林的耐药率高达90%以上,耐药结果与顾欣[18]和姚晓慧[19]报道的结果相近,以上药物的高耐药率表明以上6种药物对猪源粪肠球菌感染的治疗效果可能不理想,三个猪场对氟苯尼考、左氧氟沙星以及恩诺沙星的耐药率的差异也说明阿克苏地区各养猪场之间用药管理水平参差不齐。
3.3多药耐药结果显示:研究中阿克苏地区猪源粪肠球菌的多药耐药主要集中在6耐及以上,B猪场主要耐药谱型集中在8~10耐,表明阿克苏地区部分猪场的猪源粪肠球菌的耐药性问题应当得到重视,而A和C两个猪场的耐药形势也应引起足够的重视,lsa(E)基因可以介导包括链阳霉素A类、林可霉素类、截短侧耳素类药物在内的多种抗菌药物耐药[20],optrA基因可以介导噁唑烷酮类及酰氨醇类药物耐药[22],两种基因均可通过水平传播被其他细菌捕获,从而获得性耐药。研究lsa(E)基因检出率达40.0%,optrA基因检出率达25.6%,并且研究中携带optrA基因的粪肠球菌已经表现出噁唑烷酮类药物利奈唑胺低水平耐药的现象,链阳菌素A类和噁唑烷酮类药物在治疗耐万古霉素肠球菌(Vancomycin-ResistantEnterococcus, VRE)及耐甲氧西林金黄色葡萄球菌(Methicillin-resistantStaphylococcusaureus, MRSA)感染时存在药物有效性下降的可能[21-23]。
4 结 论
共分离粪肠球菌160株,总体分离率为25.6%,其分离率依次为16.4%、34.6%、28.9%。B猪场对所检12种药物的耐药菌株分离率显著高于A和C猪场(P<0.05),A、C两个猪场之间差异不显著(P>0.05),A猪场的耐药谱型在4~9耐,以6耐和7耐为主,占比70.4%;B猪场的耐药谱型在7~10耐,以8耐和10耐为主,占比为81.4%;C猪场的耐药谱型在3~8耐,以6耐为主,占比为80.0%。阿克苏地区三个猪场的猪源粪肠球菌均检出ermB、ermC、tet(K)、tet(L)、tet(M)、aac(6')/aph(2")、lsa(E)基因。

