高耐性库德里阿兹威氏毕赤酵母的筛选及应用
林良才,白茹,高滢,慕济锗,卢君,李长文,张翠英*
1(天津科技大学 生物工程学院,工业发酵微生物教育部重点实验室,天津,300457) 2(贵州国台酒业股份有限公司,贵州 仁怀,564501)
传统白酒发酵是顺其自然之道的开放式发酵,是多菌种的协同生态发酵过程。发酵体系中菌群的组成和代谢活性不仅决定了基酒的产量,还与基酒的品质息息相关。然而,独特的开放式发酵过程极易受到外界环境的影响,从而改变菌群结构,尤其是打破核心功能菌群之间的平衡,进而出现原料转化率低、风味生成不足、有害副产物伴生等问题,如夏季较高的环境温度极易造成乳酸、乙酸等有机酸的过度积累,导致糟醅酸度过高(pH<4),体系中功能酵母菌群的生长受到严重抑制,迫使企业“压排”,甚至停产。特别是在酱香型白酒酿造过程中,因其多轮次的特殊工艺,夏季发酵的轮次糟醅酸度过高的问题尤为突出,严重影响出酒率和产品风味。如何提高酿造微生态中功能菌群结构的稳定性和抗干扰性已成为企业稳定、高效、安全生产亟需解决的行业共性技术问题。
酵母是白酒酿造过程中的核心功能微生物,是最为重要的乙醇生产菌株,也与风味物质的合成密切联系,其抗逆性能和发酵性能不仅直接影响整个酿造微生态中菌群的演替变化,还与基酒产量和品质息息相关。酿酒酵母(Saccharomycescerevisiae)被广泛地视为白酒酿造过程中的主要发酵动力,是基酒中乙醇的主要来源,而发酵体系中非酿酒酵母因产醇能力相对较弱,往往被认为与风味物质的合成密切相关,如异常威克汉酵母属和念珠酵母属在酱香白酒第5轮次发酵过程中与乙酯含量呈正相关[1],粟酒裂殖酵母与包括丁醇、戊酸在内的136种风味物质的合成相关[2],毕赤酵母属和念珠酵母属在小曲清香白酒酿造过程中参与高级醇的合成[3]。然而,随着对传统白酒酿造体系科学认识的逐步深入,非酿酒酵母的功能已不仅仅局限于生香方面的贡献,它们是酿造核心功能微生物组中不可或缺的组成部分,尤其是这些非酿酒酵母对白酒发酵环境中的高温、高酸、高渗等压力胁迫具有较好的耐受性[4],对于稳定发酵体系中菌群的组成和代谢活性具有不可替代的重要作用。因此,高耐性核心功能酵母菌株是应对白酒发酵过程酸压力胁迫下发酵力不足、保持酿造微生态平衡的有效工具。
库德里阿兹威氏毕赤酵母(Pichiakudriavzevii)又称东方伊萨酵母(Issatchenkiaorientalis),不仅具有较好的耐酸、耐高温性能,而且在多重压力胁迫下仍能保持优良的发酵特性[5-6],是重要的酿造核心功能微生物,是酱香、浓香、芝麻香、清香型白酒发酵过程中的主要功能酵母[2-3,7-8],其代谢物苯乙醇可以显著抑制发酵体系中其他真菌的生长,对酿造微生态中菌群演替具有调控作用[9]。P.kudriavzevii还具有较强的尿素降解能力,可以较好地降低酱香型白酒发酵体系中氨基甲酸乙酯(ethyl carbamate, EC)的前体物质——尿素,从而降低EC含量,确保基酒的安全性[10]。此外,P.kudriavzevii可以降低发酵体系中乳酸的含量,调节酿造微环境的酸度,从而促进酿酒酵母的生长[11]。尽管P.kudriavzevii在白酒酿造过程中发挥极为重要的作用,但将其人工应用于白酒发酵过程的研究却鲜有报道。因此,筛选具有良好耐受性能及发酵性能的库德里阿兹威氏毕赤酵母,并开发基于强化菌剂的发酵调控技术,对实现传统白酒酿造可控、高效、稳定生产具有重要的应用价值。
本研究采用温度、酸度双重胁迫策略从酱香型白酒酒醅中特异性筛选、分离库德里阿兹威氏毕赤酵母11株,对其耐高温、耐酸、耐乙醇性能进行检测,并利用模拟发酵实验对其发酵性能及风味物质的生成进行系统评估,最终确定以XDNZ_PK05菌株进行原位发酵实验,评价其应用于酱香型白酒酿造过程中的作用,为传统白酒人工可控发酵调控技术的开发提供了新依据和新思路。
1 材料与方法
1.1 材料与试剂
玉米,市售;酵母浸粉、蛋白胨,北京奥博星生物技术有限公司;葡萄糖(分析纯)、NaCl,天津市永大化学试剂开发中心;琼脂粉、琼脂糖,北京索莱宝科技有限公司;乳酸、乙酸、乙醇,阿拉丁生化科技有限公司;dNTP、LATaqDNA聚合酶,日本TaKaRa公司;WL营养琼脂培养基,青岛海博生物技术有限公司。
1.2 培养基
YPD液体培养基(g/L):葡萄糖20,蛋白胨20,酵母浸粉10,pH自然,115 ℃灭菌20 min。固体培养基额外添加20 g/L琼脂粉。
玉米水解液:称取玉米醪1 kg,向其中加入3 L 60~70 ℃的自来水,静置20 min,进行玉米醪的糊化,使玉米醪充分膨胀,然后加入600 μL的液化酶(α-淀粉酶2×104U/mL),于85~90 ℃液化1.5 h,期间可进行搅拌以提高液化效率,液化结束后,迅速冷却降温至60 ℃,加入2 mL糖化酶(1×105U/mL)糖化20 h,期间搅拌。待糖化结束后,将糖化液用3层滤布过滤,得到渗出液即为玉米水解液,在105 ℃下高压灭菌20 min,室温保存使用。
一级种子培养基:将玉米水解液的糖度调整到8°Brix,加入0.5%(质量分数,下同)的酵母浸粉,按需求分装灭菌备用。
二级种子培养基:将玉米水解液的糖度调整到12°Brix,加入0.5%的酵母浸粉,按需求分装灭菌备用。
营养盐:分别称取15 g MgSO4,7.5 g KH2PO4,8.1 g尿素,依次加入烧杯中,加入80 mL蒸馏水,充分溶解,定容至100 mL。
浓醪发酵培养基:称取60 g玉米醪置于250 mL三角瓶,加入135 mL 60~70 ℃热水并搅拌均匀,放置20 min。向其中加入30 μL的液化酶(α-淀粉酶2×104U/mL)并搅拌均匀,90 ℃水浴90 min,液化。迅速冷却至60 ℃,加入90 μL糖化酶(1×105U/mL)并搅拌均匀,60 ℃水浴20 min,糖化。迅速冷却至40 ℃,加入1.2 mL酸性蛋白酶(2×104U/mL)并搅拌均匀,40 ℃水浴20 min。迅速冷却至30 ℃,加入1 mL营养盐溶液,即为发酵培养基。
1.3 仪器与设备
UVmini-1240紫外分光光度计,岛津仪器(苏州)有限公司;7890A气相色谱仪,美国安捷伦科技公司;YXQ-LS-30SH高压蒸汽灭菌锅,山东新华医疗器械厂;全自动凝胶成像仪,美国SYNGENE公司;PCT-200型PCR基因扩增仪,德国Eppendorf公司;PowerPacTM型电泳仪,美国BIO-RAD公司;LRH-250A生化培养箱,上海博讯实业有限公司;小型蒸酒设备,河南永康机械制造有限公司。
1.4 实验方法
1.4.1 高耐受性酵母的筛选
将10 g酱香型白酒酒醅和90 mL无菌生理盐水置于250 mL无菌三角瓶中充分混合,在30 ℃,180 r/min条件下振荡1 h,吸取1 mL菌悬液至YPD培养基中,35 ℃静止培养48 h,稀释涂布于含有40 g/L乳酸的YPD平板上,35 ℃倒置培养2~3 d,挑取单菌落进行纯化,并保存于4 ℃备用。
1.4.2 高耐受性酵母菌株的鉴定
(1)形态观察
将纯化后的菌株划线接种至WL营养琼脂培养基,30 ℃培养2~3 d后观察并记录菌落形态,同时在显微镜下观察其细胞形态。
(2)生理生化测定
参照杨舒雯等[12]的方法,对筛选出的菌株进行生理生化试验,包括糖发酵试验(主要测定葡萄糖、蔗糖、麦芽糖、可溶性淀粉)、碳源同化试验(主要测定果糖、半乳糖、木糖、阿拉伯糖)、氮源同化实验[主要测定KNO3、(NH4)2SO4、尿素]
(3)菌株分子生物学鉴定
利用真菌26S rDNA基因通用引物NL1(5′-GCATATCAATAAGCGGAGGAAAAG-3′)、NL4(5′-GGTCCGTGTTTCAAGACGG-3′)进行PCR扩增,条件为95 ℃预变性5 min;94 ℃变性45 s,57 ℃退火45 s,72 ℃延伸1 min,30个循环;72 ℃ 10 min。反应体系(20 μL):LATaq聚合酶0.125 μL,10×LA PCR Buffer 2 μL,dNTP Mix 1 μL,模板1 μL,引物NL1 1 μL,引物NL4 1 μL,ddH2O补齐至20 μL。PCR产物经电泳验证,纯化回收后由天津金唯智生物科技有限公司进行测序分析。
将所获得的PCR序列提交至NCBI进行BLAST比对,获取同源性较高的物种26S rDNA序列,利用MEGA 7.0中Neighbor-joining方法建立系统发育树。
1.4.3 菌株耐性能评估
本实验采用点板实验法检测菌株的耐受性,将测试菌株挑取至3 mL YPD培养基中,30 ℃培养12~16 h,将菌液OD600调整至0.5,吸取2 μL菌液分别滴加至含有不同质量浓度乳酸(50、60、70 g/L)、乙酸(3、4、5、6 g/L)或乙醇(90、100、110 g/L)的YPD平板上,30 ℃倒置培养1~2 d,每隔12 h观察菌株生长情况。类似的,利用点板法检测菌株的耐高温特性(37、42、45 ℃)。
1.4.4 发酵性能检测
从平板挑取单菌落接种于含有5 mL一级种子培养基的试管中,30 ℃静置培养24 h;将上述菌液全部接种至装有54 mL二级种子培养基的150 mL三角瓶中,30 ℃静置培养16 h;以10%(体积分数)接种量将二级种子发酵液接种至玉米浓醪发酵培养基中,30 ℃静置培养,通过CO2排放量来监测整个发酵过程的进程,每隔12 h称重1次,当12 h失重≤0.1 g时,表明发酵已经结束。
1.4.5 原位发酵实验
从平板挑取单菌落接种于200 mL YPD培养基中,在30 ℃,200 r/min条件下培养48 h,将酵母菌剂以106CFU/g的接种量加入50 kg六轮次摊凉拌曲后的酒醅中,混合后将其平均装入5个纯棉纱布袋中,放置在不同位置,待堆积发酵结束后,取样进行理化检测,然后将样品进行翻拌,模拟移堆操作,然后再分装至纱布袋中,在窖池原位环境中继续发酵。发酵结束后,取酒醅进行理化指标检测。
1.4.6 乙醇及风味物质检测
浓醪发酵代谢物检测:发酵结束后,取100 mL浓醪发酵液与100 mL蒸馏水混合均匀,蒸馏并收集100 mL馏出液,并用0.22 μm滤膜过滤,分别利用液相法和气相法测定乙醇含量和风味物质含量。
原位发酵酒醅代谢物检测:取50 g酒醅与200 mL蒸馏水混合均匀,蒸馏并收集100 mL馏出液,并用0.22 μm滤膜过滤,分别利用液相法和气相法测定乙醇含量和风味物质含量。
液相检测条件:色谱柱为GH0830078H(300 mm×7.8 mm);检测器为示差折光检测器(refractive index detector, RID);流动相为5 mmol/L的H2SO4溶液,流速0.6 mL/min;检测器温度45 ℃,柱温65 ℃,进样量20 μL。
气相检测条件:火焰离子化检测器(flame ionization detector, FID),毛细管色谱柱HP-INNOWAX(50 m×320 μm×1.0 μm),载气为纯度99.99%的高纯N2,分流比1∶10。进样口温度200 ℃,检测器温度200 ℃,进样量1 μL。采用程序升温,50 ℃保持8 min,升温速率5 ℃/min,升温至180 ℃,保持15 min,每个样品处理时间43 min。
1.4.7 残淀粉的测定
采用斐林试剂法[13]测定样品中的残余淀粉含量。
1.4.8 数据处理
每个试验重复3次,采用软件GraphPad Prism 8.0.1绘制图表,表示为平均值±标准差,其中差异显著性通过单因素方差分析(ANOVA)进行,置信度为95%(P<0.05)。
2 结果与分析
2.1 高耐性菌株的分离筛选
库德里阿兹威氏毕赤酵母是传统发酵中重要的参与者,是酒类酿造过程中重要的功能酵母[14],为了筛选获得高耐性的菌株,以酱香型白酒酒醅出发,根据库德里阿兹威氏毕赤酵母的耐受特性,采用传统平板培养法在35 ℃和40 g/L乳酸的双压力胁迫下特异性分离、筛选获得11株酵母菌株。
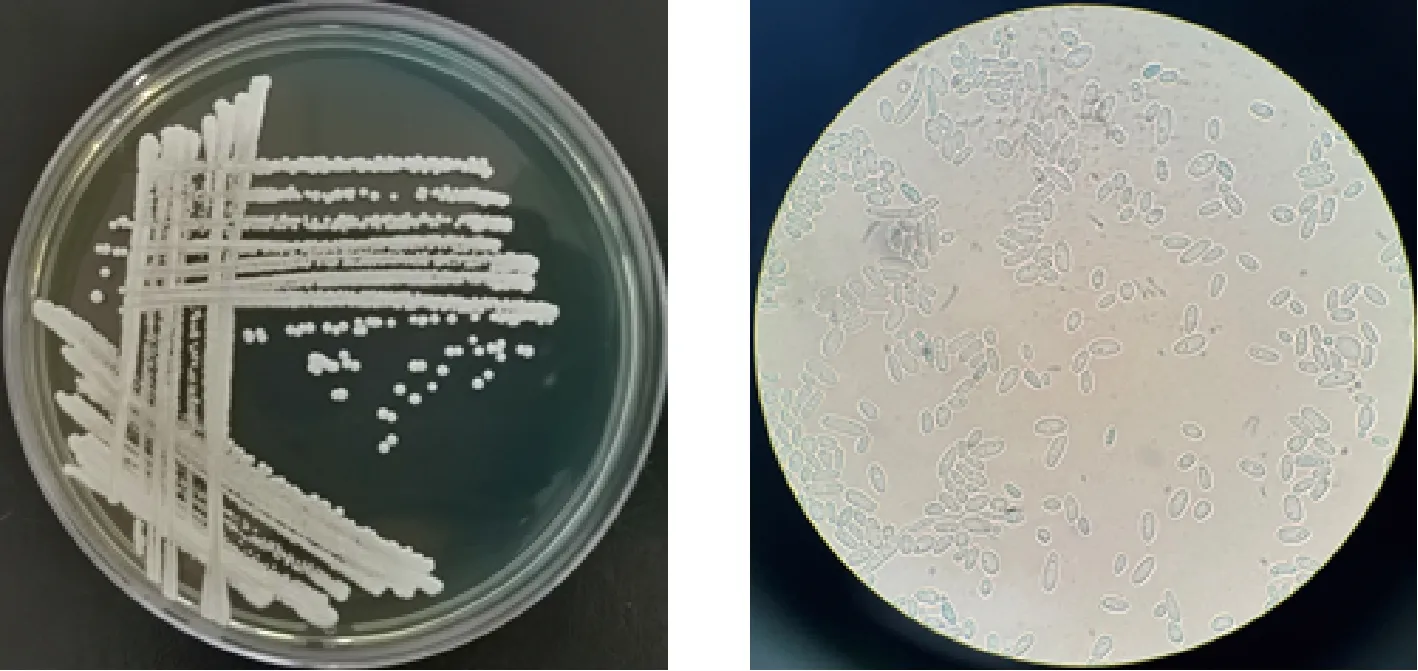
a-在WL营养琼脂培养基上菌落形态特征;b-显微镜下细胞形态特征(10×100)图1 菌株XDNZ_PK05的菌落及细胞形态Fig.1 Colony and cell morphology of strain XDNZ_PK05
对11株菌进行形态鉴定时发现所有菌落形态一致,在此仅展示XDNZ_PK05的结果,如图1所示。在WL营养琼脂培养基观察其形态特征,菌落呈圆形,颜色为乳白色,不透明,表面粗糙,凸起,表面及边缘呈菌丝状,四周平整;显微镜下观察,大多为长椭圆形的单细胞,生殖方式为出芽繁殖,是典型的酵母特征。
生理生化试验结果如表1所示,11株菌的结果是一致的,可发酵的糖类为葡萄糖和蔗糖,不可发酵的糖类为蔗糖和淀粉;碳源同化试验显示菌株可以利用果糖和半乳糖,不能利用木糖和阿拉伯糖;氮源同化试验显示菌株均不能利用尿素、(NH4)2SO4、KNO3。

表1 菌株的生理生化试验结果Table 1 Results of physiological and biochemical tests of strains
26S rDNA序列比对结果如图2所示,XDNZ_PK01和XDNZ_PK02与其余9株菌亲缘关系较远,这暗示着这2株菌的生长或是发酵性能与其他菌株可能存在较大的差别。值得注意的是,菌株XDNZ_PK05与P.kudriavzeviiY1-9聚于一支,而P.kudriavzeviiY1-9与前期从贵州茅台酒醅中筛选获得的高耐乳酸酵母菌株P.kudriavzeviiMT-Y01具有较高的亲缘关系,这意味着菌株XDNZ_PK05可能具有与MT-Y01类似的发酵特性。
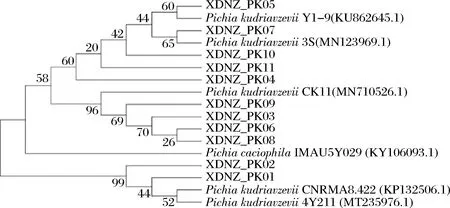
图2 11株酵母菌株基于26S rDNA基因序列构建的系统发育树Fig.2 Phylogenetic tree of 11 yeast strains based on 26S rDNA gene sequences
综合菌落形态、生理生化试验以及26S rDNA序列比对,确定这11个菌株均为库德里阿兹威氏毕赤酵母,分别命名为XDNZ_PK01~XDNZ_PK11。
2.2 菌株的耐受性评价
温度对微生物的生长代谢具有重要的影响。白酒酿造外界环境温度和微生物发酵所产生的生物热是影响发酵体系温度最主要的2个因素,尤其是生物热更是推动微生物群系演替的推动力[15],而酵母的生长代谢是生物热的主要来源之一。如果酿造体系中酵母耐热性能较差,随着发酵体系温度的升高,酵母生长代谢将受到显著抑制,使得生物热无法得到继续积累,从而严重影响发酵进程。以酱香型白酒堆积发酵阶段为例,堆子顶温>50 ℃才能达到工艺要求。由此可见,耐高温是白酒功能酵母的重要属性。菌株XDNZ_PK01~XDNZ_PK11在42 ℃培养条件下生长良好,其中XDNZ_PK04和XDNZ_PK05可以在45 ℃生长(图3),这也与目前报道的库德里阿兹威氏毕赤酵母可耐受的最高温度一致[16]。

图3 45 ℃高温胁迫条件下菌株生长情况Fig.3 Growth of strains under high temperature stress at 45 ℃
酸和醇是白酒酿造体系中微生态调控风向标,发酵初期酸度的提高有利于控制杂菌的过度繁殖,中后期的醇浓度提高有助于抑制产酸菌的生长,2个因素共同控制,从而确保产品的“量”和“质”。因此,发酵体系中的功能酵母应具有较好的耐酸、耐乙醇特性,从而确保发酵体系内菌群的平衡。
在白酒酿造过程中,乙酸和乳酸是发酵体系中酸度的主要贡献者[17],因此考察了筛选获得菌株在不同乳酸、乙酸浓度下的生长状况。结果如图4-a所示,XDNZ_PK01~XDNZ_PK11均可在5 g/L乙酸条件下正常生长。而对于乳酸压力胁迫而言,这些菌株表现出了不同的耐受能力,XDNZ_PK03~XDNZ_PK11都可以在70 g/L乳酸条件下生长,其中XDNZ_PK03、XDNZ_PK06、XDNZ_PK08以及XDNZ_PK11对乳酸的耐受能力显著高于其他菌株(图4-b)。
酵母是发酵体系中乙醇最主要的生产菌株,然而随着体系中乙醇的不断积累,高浓度乙醇会对酵母生长代谢产生抑制,从而影响基酒产量。因此,高乙醇耐受性是白酒功能酵母所必备的性能。将11株菌株分别置于含有14%(体积分数)乙醇的YPD平板上,30 ℃培养2 d。如图4-c所示,除菌株XDNZ_PK08和XDNZ_PK11之外,其他菌株均可以正常生长。由此可知,这些菌株通过在酿造环境中长期的驯化,已进化获得了更好的乙醇耐受特性。

a-5 g/L乙酸;b-70 g/L乳酸;c-14%乙醇图4 菌株在不同胁迫条件下生长情况Fig.4 Growth of strains under different stresses
2.3 菌株发酵性能和代谢特征评价
除了耐受性质之外,酵母菌株的代谢特性也是影响基酒质量的重要因素。利用玉米浓醪模拟白酒发酵,对这11株菌的发酵性能和风味物质的合成情况进行了系统分析,并以实验室保藏的酿酒酵母AY12作为对照菌株。工业酿酒酵母AY12具有优良的发酵及产酒性能[18]。如图5所示,菌株XDNZ_PK01~XDNZ_PK11的发酵速度显著低于酿酒酵母AY12,除了菌株XDNZ_PK09之外,其他菌株的乙醇产量也显著低于AY12,且发酵失重与乙醇产量之间呈现很好的相关性。

a-失重变化;b-乙醇产量;c-失重与乙醇产量的关联分析图5 菌株在玉米浓醪发酵条件下代谢特性分析Fig.5 Analysis of metabolic characteristics of strains under corn concentrated mash fermentation注:图b显著性分析均是以AY12为对照进行分析:ns代表无显著性差异,*P<0.05,**P<0.01,***P<0.001,****P<0.000 1(下同)
同时,利用气相色谱法对这些菌株发酵所产生的主要风味物质进行了检测,结果如表2所示。
库德里阿兹威氏毕赤酵母作为生香酵母可以显著提高乙酸乙酯的含量,是酿酒酵母AY12乙酸乙酯产量的3.51~31.01倍,其中XDNZ_PK02的乙酸乙酯产量最高,达到了(796.92±1.84) mg/L。值得关注的是,菌株XDNZ_PK03和XDNZ_PK06的乳酸乙酯产量分别为(36.2±0.51)和(34.6±1.15) mg/L,显著高于酿酒酵母AY12和其他库德里阿兹威氏毕赤酵母的乳酸乙酯产量。此外,菌株XDNZ_PK01~XDNZ_PK11的高级醇产量显著降低,仅为酿酒酵母AY12的45.43%~75.92%。由此推测,将库德里阿兹威氏毕赤酵母作为强化菌剂应用于传统白酒发酵过程可以起到提酯降高级醇的效果。
根据菌株耐受性、发酵能力和风味化合物合成能力分析,结果发现菌株XDNZ_PK03和XDNZ_PK06虽然具有较好的耐高温和耐酸性能,但其乙醇产量过低,不能满足实际生产的需要。而菌株XDNZ_PK09的乙醇产量达到(139.7±0.98) g/L,显著高于其他菌株,且与酿酒酵母AY12产醇能力相当,但其延滞期较长,因此也不符合实际生产应用的要求。进一步分析显示,与酿酒酵母AY12相比,菌株XDNZ_PK02、XDNZ_PK05合成的总酯分别提升了27.21倍和20.40倍,总高级醇分别降低了31.65%和36.37%。此外,XDNZ_PK05菌株可以在45 ℃条件下生长,耐热性能优于XDNZ_PK02。
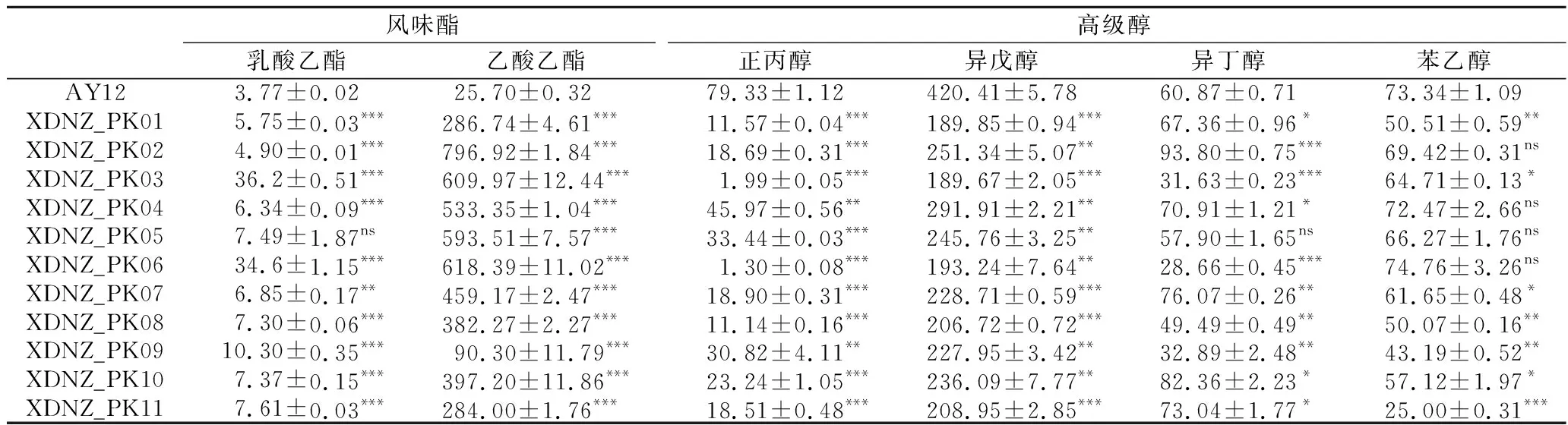
表2 不同菌株在玉米浓醪发酵条件下风味化合物的产量 单位:mg/L
2.4 强化菌剂原位发酵实验
根据以上菌株耐受性能分析和玉米浓醪模拟发酵的结果,选择菌株XDNZ_PK05作为强化菌株进行原位生产发酵验证。菌株XDNZ_PK05培养液按照106CFU/g的接种量应用于第7轮次发酵生产过程中,堆积阶段和窖池阶段原位发酵的位置如图6所示。
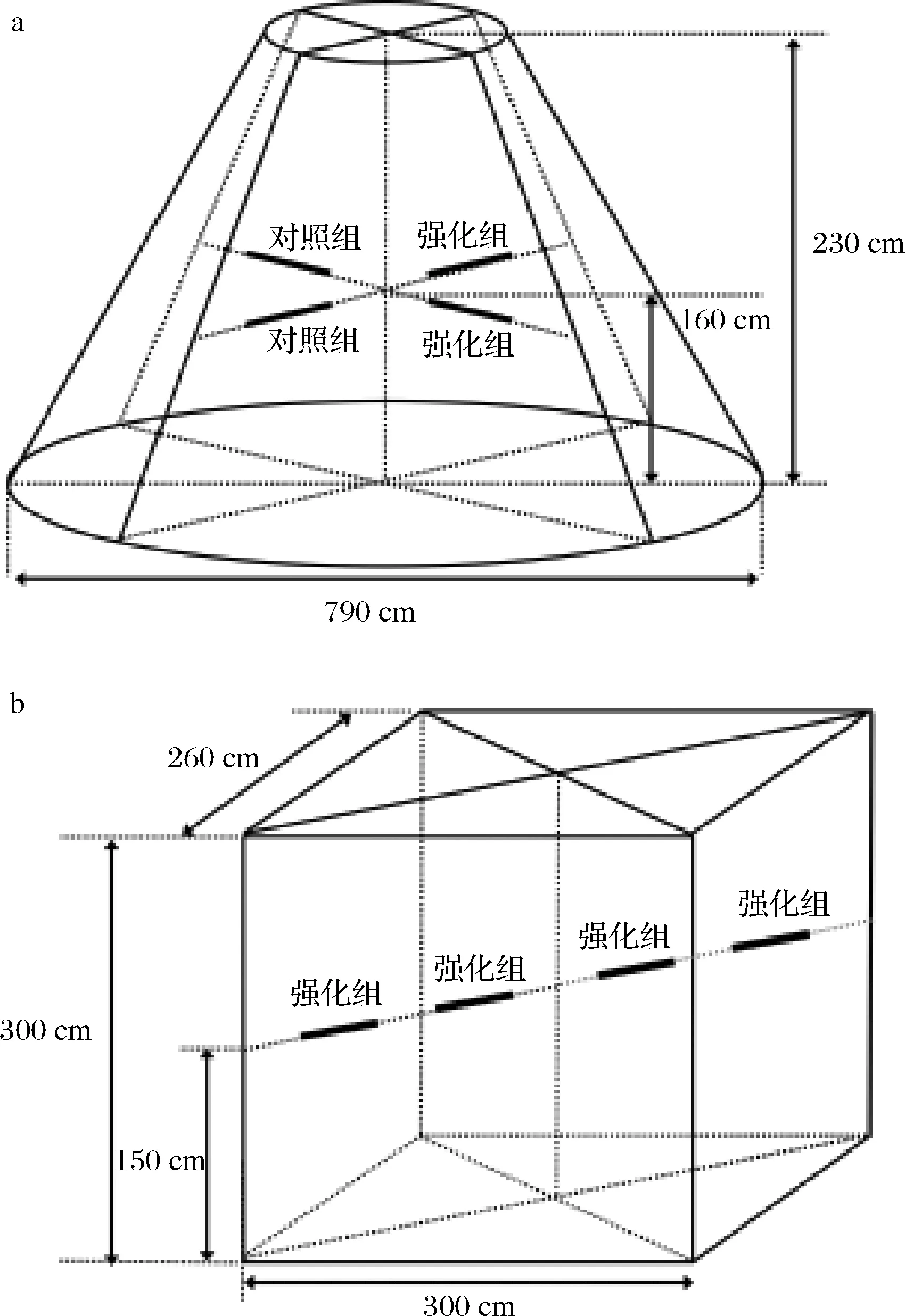
a-堆积阶段;b-窖池阶段图6 原位堆积发酵和窖池发酵样品位置示意图Fig.6 Location diagram of samples during the in-situ stacking fermentation and pit fermentation
由表3可知,添加了XDNZ_PK05可以显著提高原料的利用,堆积末残淀粉从对照组的(14.4±0.18)%降低到了(12.10±0.04)%,利用率提高了15.97%,出窖时残淀粉从(12.10±0.04)%降低到了(9.59±0.05)%,淀粉利用率提高了20.74%。尽管菌剂强化组的堆积发酵阶段淀粉消耗增多,但酒醅中乙醇含量并未发生显著变化,强化组窖池发酵结束后酒醅中的乙醇含量显著提高了15.26%,从对照组的(6.42±0.17) g/L提升到了(7.40±0.10) g/L,这与基酒中乙醇产量提高的比率相似。对照组基酒中乙醇含量为(293.71±13.37) g/L,强化组基酒乙醇含量为(332.46±11.73) g/L,提高了13.19%。

表3 酒醅中淀粉和乙醇含量Table 3 The starch and ethanol contents in Jiupei
这些结果证实了耐酸菌剂的使用可以显著提升高酸胁迫条件下原料利用率,解决发酵力不足、产能下降的实际生产问题。尽管目前鲜有关于利用库德里阿兹威氏毕赤酵母作为强化菌剂进行人工发酵调节的相关研究,但已有报道耐酸非酿酒酵母用于应对异常天气导致的糟醅酸度过高的问题,如贵州国台酒业有限公司利用耐酸粟酒裂殖酵母作为强化菌剂,并开发与之适配的调控技术,可以显著提高基酒产量13.47%~25.97%[19]。由此可以推断,高耐非酿酒酵母的筛选及相应技术的开发,是解决发酵力不足、高酸掉排这些实际生产问题的有效策略。
风味物质分析结果如表4所示,对照组基酒中正丙醇含量为(1 334.29±80.17) mg/L,而强化组中含量仅为(620.75±50.56) mg/L,显著降低了53.48%,这意味库德里阿兹威氏毕赤酵母的应用可以有效降低基酒中高级醇的含量,有利于改善饮后舒适度,提升产品质量。
与之相类似的,在小曲清香型白酒酿造过程中,酿酒酵母是高级醇的主要生产菌株,而毕赤酵母对降低高级醇有着积极贡献[20]。在白云边酒酿造过程中库德里阿兹威氏毕赤酵母的应用可以降低正丙醇含量27.4%[21]。然而,在葡萄酒酿造过程中,采用酿酒酵母和库德里阿兹威氏毕赤酵母顺序发酵工艺显著提升高级醇产量20%左右[22]。由此可见,库德里阿兹威氏毕赤酵母对高级醇的调控与发酵工艺息息相关。
此外,先前的玉米浓醪模拟发酵实验显示库德里阿兹威氏毕赤酵母可以显著提高发酵体系中乙酸乙酯的产量(表2)。然而,强化组基酒中酯含量并没有显著变化。除此之外,其他风味指标无显著性变化,不会对基酒品质造成不良影响。
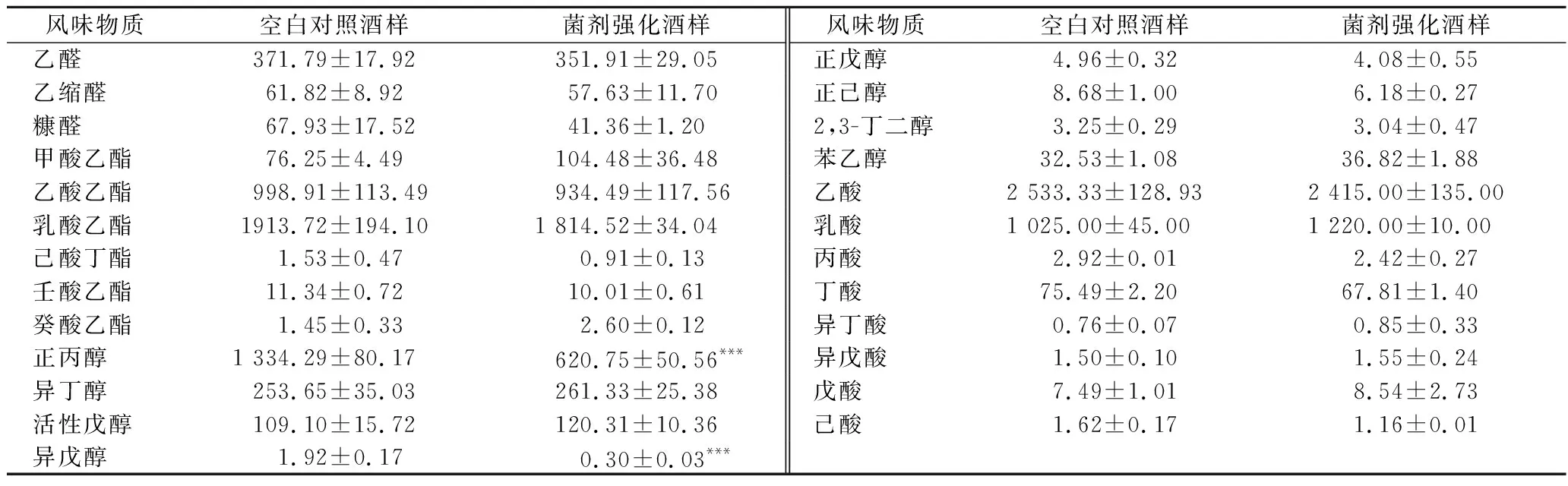
表4 酒样中风味物质含量 单位:mg/L
3 结论
传统白酒开放式的发酵方式在赋予酒体独特风味的同时也给生产的稳定性和安全性带来了潜在的隐患。酿造环境的异常波动会给酿造体系功能微生物带来额外的胁迫压力,从而导致菌群失调,造成“减产降质”的问题。本研究以开发耐酸胁迫人工可控发酵技术为目标,从酱香型白酒酒醅中筛选获得了具有不同代谢特征和耐受能力的库德里阿兹威氏毕赤酵母11株,优选出XDNZ_PK05菌株作为强化菌剂,进行了原位发酵实验。结果显示高耐性酵母XDNZ_PK05的使用可以克服高酸压力,提高粮食利用率,提升乙醇产量13.19%,有效降低高级醇含量50%以上,且不改变其他风味指标。本研究筛选获得的高耐性酵母和形成的发酵调控技术为酱香型白酒可控发酵调控技术的开发提供了良好的素材,也为创建基于合成功能微生物组的现代酿造调控技术提供了重要的理论支撑,对我国传统酿造行业的技术升级具有重要的应用价值。