餐厨垃圾发酵产乳酸菌种的筛选、鉴定及应用
余培斌,吴殿辉,蔡国林,陆健
1(粮食发酵与食品生物制造国家工程研究中心(江南大学),江苏 无锡,214122) 2(江南大学 生物工程学院,江苏 无锡,214122)
餐厨垃圾是城市生活垃圾的重要组成部分,是指家庭、学校、机关、公共食堂以及餐饮行业的食物废料、餐饮剩余物、食品加工废料等各类混合物[1]。随着人民生活水平日益提高,餐厨垃圾数量也在不断增加,一般可以达到生活垃圾总量的30%~50%,每年还在以8%~10%的速度增长[2]。如何简单高效地处理餐厨垃圾,实现餐厨垃圾的减量化、资源化和无害化已经成为目前需要迫切解决的难题[3]。从化学组成上看,餐厨垃圾主要为淀粉、纤维素、蛋白质、脂肪和少量无机盐等几大常见类别[4]。餐厨垃圾凭借高有机物、高含水率、营养丰富等特点,成为宝贵的可再生资源,蕴含着较大的回收和再利用价值[5-7]。微生物处理技术由于其具有高效环保的优势,在餐厨垃圾资源化利用方面越来越受到人们的重视[8-10]。
乳酸作为一种重要的有机酸,广泛应用于食品、化工等领域,聚乳酸类可生物降解塑料的开发使包装材料的白色污染问题得到减轻[11]。目前,乳酸的工业生产方法主要有化学合成法和微生物发酵法[12]。化学合成法生产成本高、环境污染严重且较难合成单一构型的乳酸,微生物发酵法生产乳酸不仅可以克服上述弊端,还具有发酵条件温和、过程清洁、效率高等优点[13]。因此微生物发酵产乳酸的研究越来越受到关注[14]。其中,利用充足且低成本的发酵原料(如餐厨垃圾等有机废弃物)厌氧发酵产乳酸既能获得品质较高的乳酸,又可以在实现有机废物自身减量的同时达到变废为宝的目的,因此逐渐成为餐厨垃圾资源化利用研究中的一个重要方向[15-17]。
本研究从自然发酵完全腐熟的餐厨垃圾有机肥料中,筛选出适合餐厨垃圾发酵产乳酸的土著乳酸菌,并对其进行菌种鉴定和耐受性研究,丰富餐厨垃圾乳酸发酵理论,以期为餐厨垃圾回收再利用提供更多的信息,为筛选适合国内餐厨垃圾发酵乳酸的菌剂提供借鉴。
1 材料与方法
1.1 实验材料
1.1.1 实验样品
样品来源:取自江南大学食堂,经过预处理的餐厨垃圾分别堆放于不同土壤环境中至完全腐熟,采集样品于4 ℃冰箱保存备用。
枯草芽孢杆菌YB1,本实验室筛选保藏菌种;大肠杆菌,本实验室保藏。
1.1.2 主要试剂
K2HPO4、乙酸钠、MgSO4·7H2O、MnSO4·H2O、柠檬酸氢二铵、葡萄糖、吐温-80、NaOH、溴甲酚紫、牛肉浸膏、酵母膏、KH2PO4,均为分析纯,上海国药集团化学试剂有限公司;NaCl工作基准试剂,优级纯,天津市化学试剂三厂;琼脂粉、蛋白胨,均为化学纯,阿拉丁试剂厂。
1.1.3 培养基
LB培养基(g/L):牛肉膏3.0,蛋白胨10.0,NaCl 5.0,琼脂20.0,pH 7.4~7.6。
MRS液体培养基(g/L):K2HPO410.0,乙酸钠5.0,MgSO4·7H2O 0.5,MnSO4·H2O 0.25,柠檬酸氢二铵2.0,葡萄糖5.0,蛋白胨10.0,吐温-80 1.0,牛肉膏10.0,酵母膏5.0,pH 6.4。
MRS固体培养基:在MRS液体培养基中加2%琼脂,1.6%溴甲酚紫1.5 mL。
餐厨垃圾发酵培养基:餐厨垃圾经过分拣后打碎成泥状,取湿基200 g,水500 mL,混合均匀,加入辅料麸皮,调节C/N比25∶1~30∶1,同时加入1%(质量分数)CaCO3,不灭菌。
1.1.4 主要仪器
电热恒温鼓风干燥箱、DFP-9082型电热恒温培养箱,上海森信实验仪器有限公司;全钢通风柜,无锡市普瑞达实验装备有限公司;FE20型pH计,梅特勒-托利多仪器有限公司;W201-D恒温水浴锅,上海申顺生物科技有限公司;UVmini-1240紫外分光光度计,日本岛津有限公司;XSP-8C生物显微镜,上海精密仪器仪表有限公司;TC-5000PCR 仪,英国Techne公司;Pico 17型离心机,Thermo Scientific公司;双人净化工作台,苏州净化集团安泰公司;高压蒸汽灭菌器,上海博讯实业有限公司医疗设备厂;精度磅秤,上海耀华称重系统有限公司;超声波破碎仪,美国Sonics公司;漩涡振荡仪,Sigma公司;M-100型生物传感器分析仪,深圳市西尔曼科技有限公司。
1.2 实验方法
1.2.1 菌种的初筛与分离纯化
菌种富集:称取堆肥样品20 g,加入已灭菌的装有适量玻璃珠的MRS液体培养基(250 mL三角瓶,180 mL培养液),37 ℃摇床培养24 h以上。
菌种初筛:取富集培养的菌液0.1 mL加入到已灭菌的装有0.9 mL无菌水的试管中,漩涡混匀,依次梯度稀释得10-1~10-6的菌液。取10-4、10-5、10-63个梯度各0.2 mL稀释菌液涂布于MRS固体培养基上,共做3个平行,37 ℃真空培养箱中培养48 h以上观察。
菌种分离纯化:挑选能够在MRS培养基上生长,并使培养基由紫色变为黄色的单菌落,对菌落进行编号,然后接种到新鲜MRS培养基上划线培养。反复进行同样的操作2~3次,直至分离出的单菌落形态稳定一致。
菌种保藏:将获得的单菌落转接于MRS斜面培养基上,待菌落在斜面生长良好后将其置于4 ℃冰箱保藏。同时转接2组,一组用于后续实验的开展。
1.2.2 菌株形态学观察及生理生化鉴定
平板菌落观察:将分离的菌种分别接种到MRS固体培养基平板上,37 ℃厌氧培养48 h后观察菌落的大小、颜色、形态等特征。
显微形态观察:依据革兰氏染色原理,显微观察菌体染色情况及菌体形态。将通过实验获取的革兰氏阳性菌(G+)暂定为乳酸菌并进一步实验研究。
1.2.3 菌株的生理生化鉴定
参照文献[18-20]考察疑似乳酸菌菌株的生理生化特征。通过过氧化氢酶实验、运动性实验、明胶液化实验、H2S产生实验、糖发酵实验等,对菌种进行进一步鉴定。
1.2.4 菌种耐受性试验
取活化后菌种悬液按5%(体积分数,下同)接种量接种于NaCl质量分数4%~9%及pH 3~8的MRS液体培养基中,在37 ℃厌氧条件下培养24 h后取样。在波长600 nm处测定培养液的OD值,不接菌的培养液OD值为空白对照,比较观察菌种生长状况判断菌种对盐度和酸碱度耐受性。取活化菌悬液按照5%接种于MRS液体培养基中,分别置于不同温度(35~60 ℃)真空培养箱内培养24 h后取样。同样通过比较600 nm处培养液OD值判断菌种对温度的耐受性。
1.2.5 分子生物学鉴定
采用细菌16S rDNA提取与扩增专用试剂盒(大连宝生物工程有限公司)。扩增引物为细菌通用引物,正向引物5’-GAGCGGATAACAATTTCACACAGG-3’,反向引物5’-CGCCAGGGTTTTCCCAGTCACGAC-3’。PCR反应体系为50 μL反应体系:4 μL裂解上清液,25 μL PCR Premix Taq,正向引物与反向引物各0.5 μL,20 μL超纯水。PCR扩增条件:94 ℃预变性5 min,(94 ℃变性1 min,55 ℃退火1 min,72 ℃延伸1.5 min)×30个循环,72 ℃终延伸5 min。扩增产物送样至上海生工生物工程有限公司测序。
获得序列经NCBI网站BLAST并利用DNAMAN 4.0、MEGA 5.1软件进行多重序列比较后构建系统发育树,Bootstrap值设定为1 000。
1.2.6 乳酸含量测定
采用酶电极法,利用生物传感分析仪M-100测定。
1.2.7 菌种抑菌性试验
采用管碟法测定筛选菌种对枯草芽孢杆菌YB1和大肠杆菌的抑菌性。将筛选菌株接种于10 mL MRS培养液中,37 ℃厌氧培养24 h待用。将指示菌接种至LB液体培养基中37 ℃振荡培养24 h,取100 μL稀释100倍的培养液涂布于LB固体培养基平板,在超净台上将灭好菌的牛津杯按在已涂布指示菌的平板上,向各牛津杯中分别注入100 μL筛选菌株培养液,观察牛津杯周围抑菌圈情况。
1.2.8 餐厨垃圾发酵产乳酸试验
取200 mL的餐厨垃圾发酵培养基置于250 mL锥形瓶中,先接入枯草芽孢杆菌YB1,后接入筛选得到的乳酸菌混合菌剂,接种量均为5%,于45 ℃恒温培养,每隔6 h测定乳酸的含量。
2 结果与分析
2.1 菌株的分离和筛选
从不同环境中腐熟的餐厨垃圾有机肥中取得堆肥样品共计15份。经过MRS培养基平板划线,共获得34株能在MRS平板上生长,使培养基变成黄色并产生形态各异的菌株。
通过菌落形态和细胞形态观察,排除相似及疑似菌株后共获得6株形态各异的菌株,分别编号为B1、M2、M3、M4、M5和M6。将这6株菌在MRS培养基平板上进行三区划线,待长出单菌落后,观察菌落形态,如图1所示。
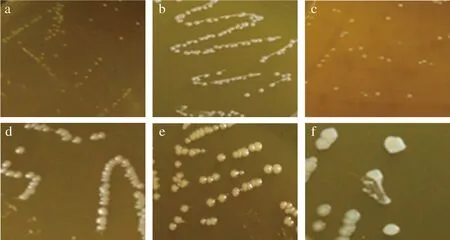
a-B1;b-M2;c-M3;d-M4;e-M5;f-M6图1 筛选菌株的菌落形态Fig.1 Colony morphology of the screened strains
将筛选到的6株菌株进行革兰氏染色后,在光学显微镜(10×100)油镜下观察细胞形态特征及染色情况,菌株显微形态见图2。
由图2可知,6株菌均为革兰氏阳性菌,能在MRS培养基上生长并使培养基变色。M2和M4为球形或近似球形,B1、M3和M5为短杆状,M6为长杆状。经过与乳酸菌常见形态比对发现6株菌符合其基本属性,初步确定为疑似乳酸菌并作进一步实验研究。
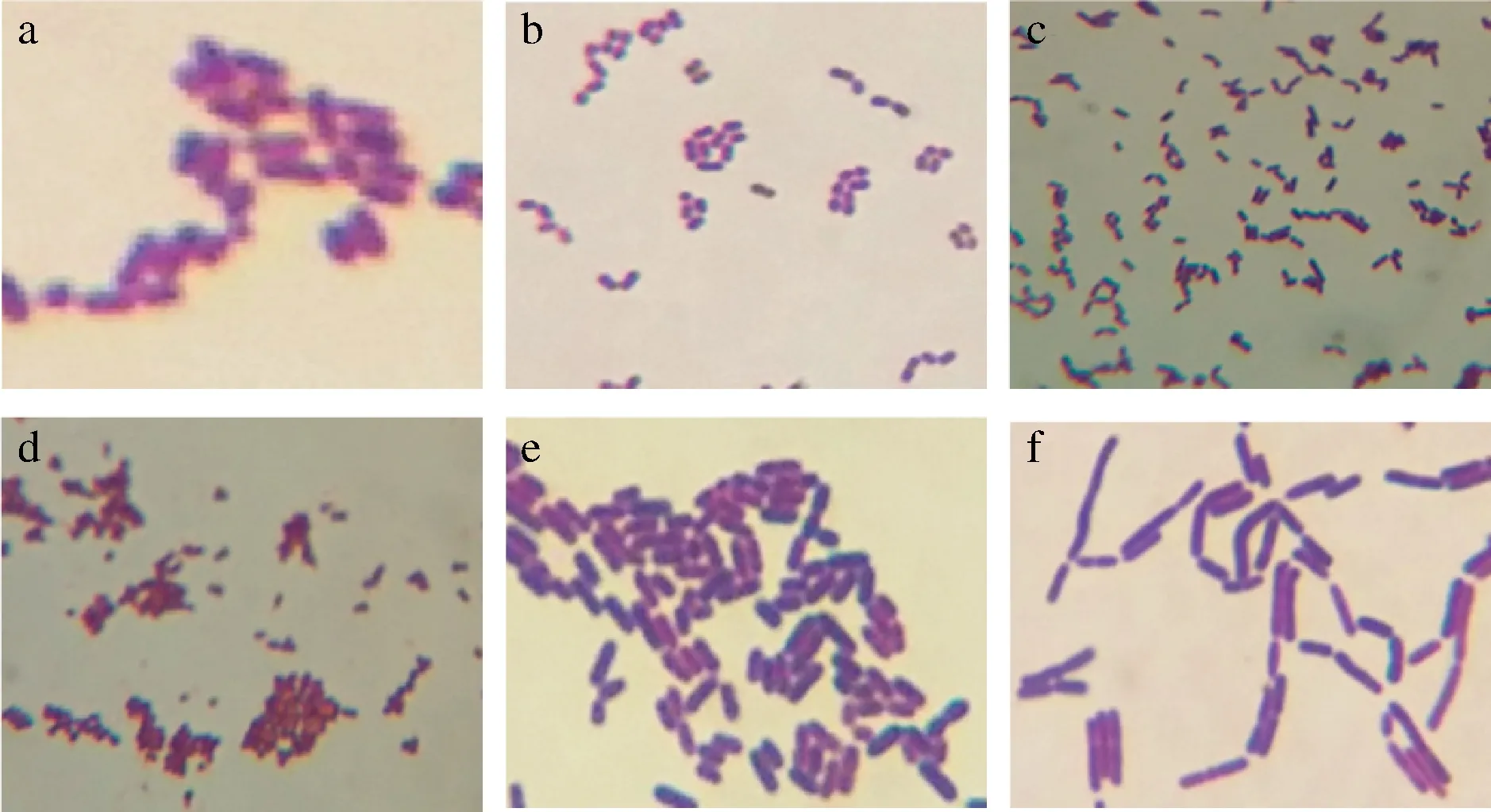
a-B1;b-M2;c-M3;d-M4;e-M5;f-M6图2 筛选菌株的显微形态Fig.2 Microscopic morphology of the screened strains
2.2 菌株的生理生化特征
对6株疑似乳酸菌进行接触酶实验、运动性实验、明胶液化实验等,各菌株生理生化实验结果见表1。
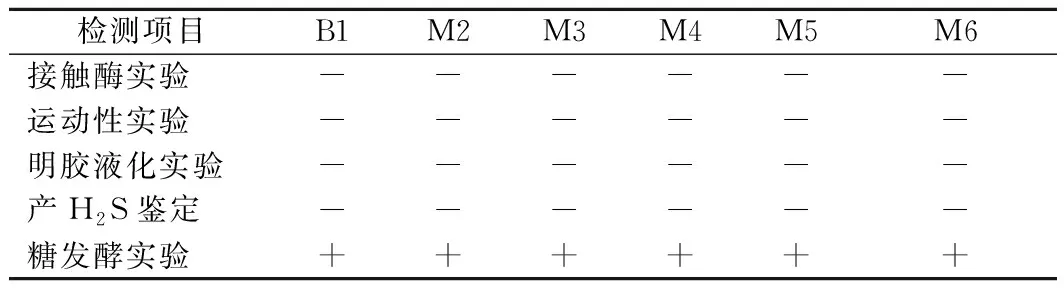
表1 筛选菌株生理生化特征Table 1 Physiological and biochemical characteristics of the screened strains
将表中结果与《乳酸细菌分离鉴定及试验方法》[21]和《伯杰氏手册》对照,确定筛选所得6株疑似乳酸菌均符合乳酸菌生理生化特征,具备分子鉴定前提条件,初步将其划分列入乳酸菌。
2.3 菌株的耐受性
餐厨垃圾在自然发酵过程中,培养基中心温度能较长时间保持在50 ℃以上,在这种温度环境中一般的微生物很难生长。同时发酵过程中,随着微生物的不断作用,培养基中酸碱度变化加大,会影响菌种的活性。其次餐厨垃圾的高含盐率也是我国餐厨垃圾区别于其他国家的主要特征。已有研究表明,中国不同地区的不同饮食习惯导致餐厨垃圾中含盐率有很大的差异[22]。盐对微生物具有Na+毒性,未经驯化的微生物在Na+质量浓度为500~2 000 mg/L时即受轻度抑制[23]。且对于一般微生物而言,高盐度会直接抑制其厌氧发酵过程,从而影响有机酸的生成[24]。因此筛选具有高温耐受性、酸碱耐受性和高盐耐受性的微生物十分重要。
2.3.1 温度耐受性
将6株乳酸菌分别接种于MRS液体培养基中,置于不同温度下厌氧培养24 h,紫外分光光度计测量600 nm处吸光值。各菌株及空白对照吸光值如图3所示。
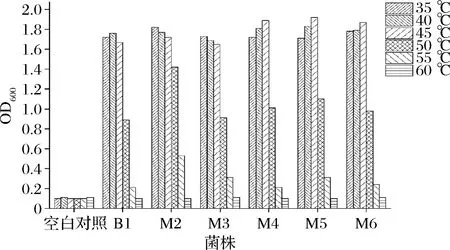
图3 不同温度下乳酸菌生长情况Fig.3 Growth of lactic acid bacteria at different temperatures
由图3可知,6株乳酸菌在35~50 ℃下生长旺盛,对温度有良好的适应性。温度≥55 ℃时生长能力明显减弱,其中M4、M5和M6在45 ℃均表现出最强的生长能力。一定范围内,菌株的生长能力随温度的升高而变强,达到最适生长温度后生长能力随着温度的升高而降低。一般情况下乳酸菌的最适生长温度为30~35 ℃,本实验中乳酸菌M4、M5和M6生长情况不适用于此规律。推测原因可能是本实验获得的乳酸菌菌株均筛选于餐厨垃圾堆肥后的有机肥样品,餐厨垃圾在堆肥过程中,肥堆中心温度长期稳定在40~50 ℃。本实验中乳酸菌经高温环境长期驯化,对高温的适应能力增强。
2.3.2 盐度耐受性
将6株乳酸菌分别接种到不同盐度(NaCl质量分数4%~9%)的MRS液体中,37 ℃厌氧培养24 h,紫外分光光度计测量600 nm处吸光值。各菌株及空白对照吸光值如图4所示。
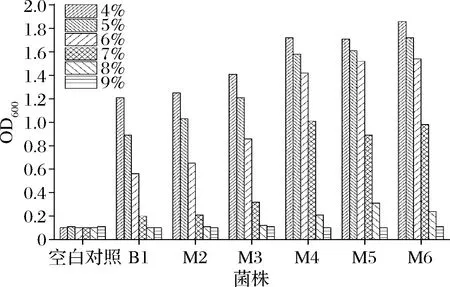
图4 不同盐度下乳酸菌生长情况Fig.4 Growth of lactic acid bacteria at different salt concentrations
筛选得到的6株菌对培养基中的NaCl均有一定耐受性,NaCl质量分数<7%时各菌株均有一定生长表现。总体而言,筛选得到的6株菌生长情况随着盐浓度的增大而不断减弱,特别是NaCl质量分数>7%以后,菌株生长严重受限。菌株之间相互比较发现:B1、M2和M3对盐度的耐受性总体较差,M4、M5和M6总体耐受性较强。当超过7%时,M4、M5和M6还能表现出一定的生长能力。
2.3.3 酸碱度耐受性
将6株乳酸菌分别接种到不同pH的MRS液体培养基中,37 ℃厌氧培养24 h,紫外分光光度计测量600 nm处吸光值。各菌株及空白对照吸光值如图5所示。
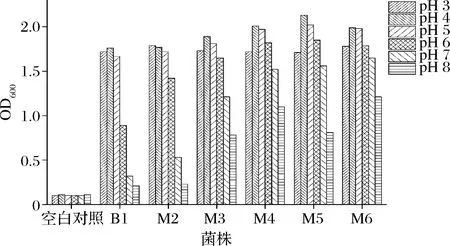
图5 不同酸碱度下乳酸菌生长情况Fig.5 Growth of lactic acid bacteria at different pH levels
由图5可知,pH的变化对乳酸菌的生长影响较大。6株乳酸菌pH在3~8范围内都能生长,在pH为4~5时生长能力最强。此后生长能力随pH的增加而呈现缓慢下降趋势,其中B1和M2下降明显,当pH值增加至8时,其生长受到极大限制。M4下降较为平稳,M3、M5和M6则均匀缓慢下降,这4株菌在碱性条件下依然能够生长。且M4和M6在pH为8时生长情况也表现较好。综上所述,本次筛选的菌株不仅能在偏碱性条件下生长,且具有较好的耐酸性能,实际生产中具有一定的实用性。
2.4 分子生物学鉴定
综合考虑各菌株的温度耐受性、酸碱耐受性及含盐量耐受性,取M4、M5和M6作为潜力菌株,用于后续餐厨垃圾发酵产乳酸试验,使用试剂盒扩增3株菌的16S rDNA序列片段,并送上海生工公司测序,将各菌株的碱基序列输入NCBI,应用BLAST程序,将所得序列与数据库中存在的细菌16S rDNA序列进行相似性比对,取其与结果显示相似度最近的菌,结果统计见表2。
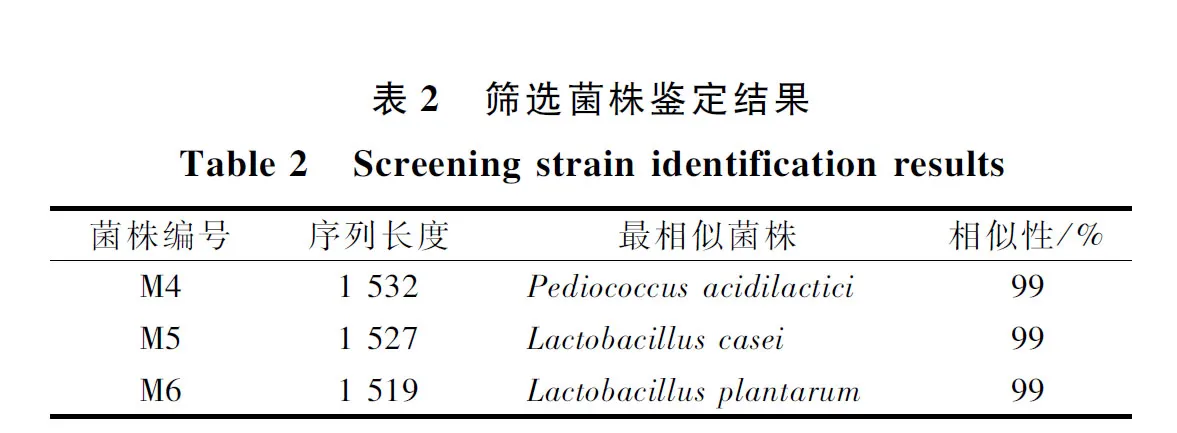
由表2可知,3株菌的序列比对相似性都达到了99%,综合生理生化实验结果,可以确定M4、M5和M6为乳酸菌。其中,M4为乳酸片球菌(Pediococcusacidilactici),M5为干酪乳杆菌(Lactobacilluscasei),M6为植物乳杆菌(Lactobacillusplantarum)。
2.5 筛选乳酸菌株的抑菌性
实验以枯草芽孢杆菌YB1和大肠杆菌为指示菌进行抑菌实验。枯草芽孢杆菌YB1为本实验室从餐厨垃圾自然堆肥后完全腐熟的有机肥样品中筛选得到,具有耐盐、耐高温特性,并且产淀粉酶、蛋白酶、纤维素酶和脂肪酶能力较强,具体特征见文献[25]。在平板上,其中3个牛津杯内分别添加筛选得到的乳酸菌株M4、M5和M6,另一个为添加相应抗生素的对照组,实验结果如图6所示。
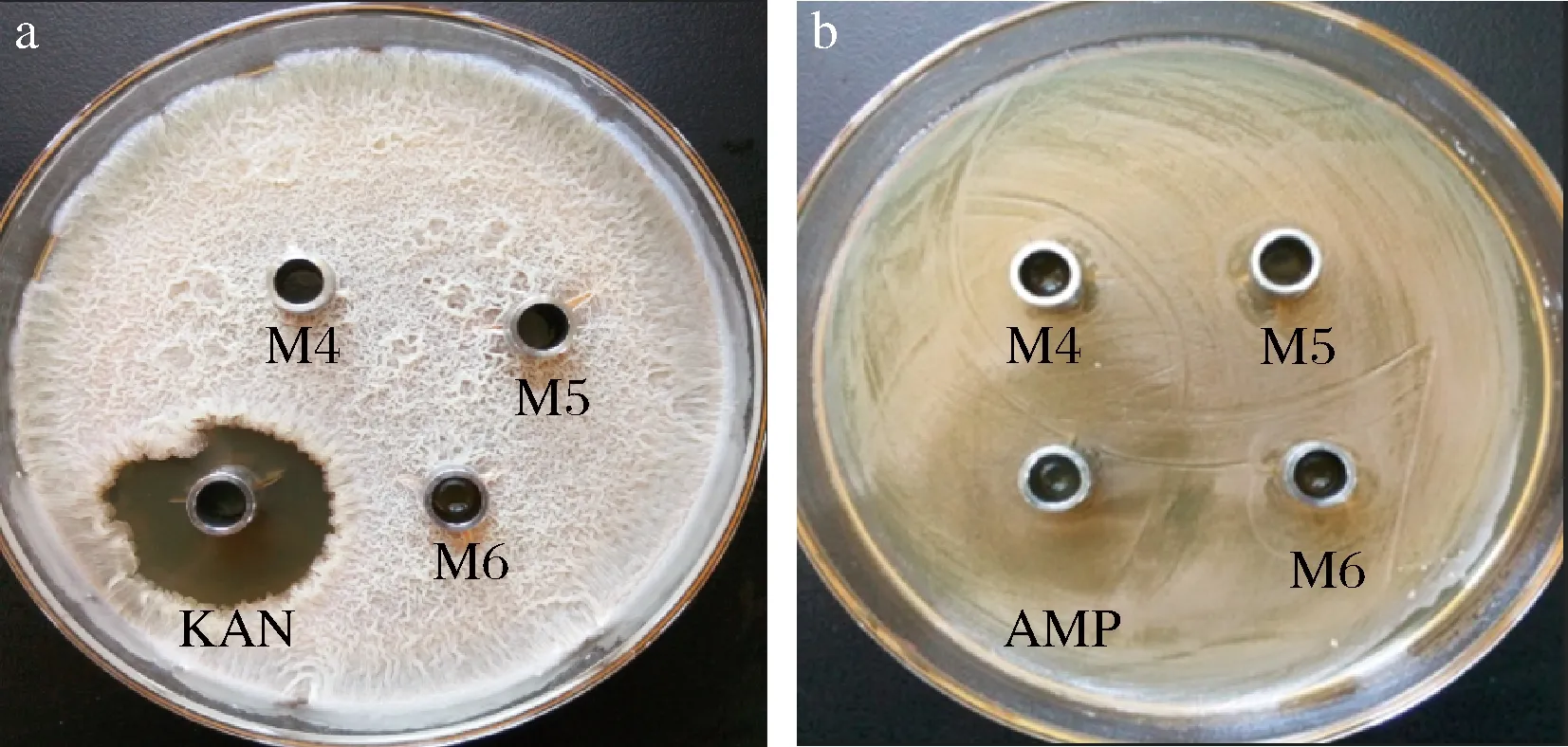
a-枯草芽孢杆菌YB1;b-大肠杆菌图6 筛选乳酸菌对指示菌的抑菌效果Fig.6 Screening of lactic acid bacteria for bacterial inhibition against indicator bacteria注:KAN-卡那霉素;AMP-氨苄西林
乳酸菌株M4、M5和M6对大肠杆菌具有一定的抑菌性,而对枯草芽孢杆菌YB1没有抑菌性,可与枯草芽孢杆菌YB1相互混合制备混合菌剂,用于后续餐厨垃圾发酵产乳酸研究。
2.6 复合菌剂发酵餐厨垃圾产乳酸
枯草芽孢杆菌菌种制备:将枯草芽孢杆菌YB1接种至LB液体培养基(含NaCl 6%),45 ℃培养48 h的培养液作为接种菌种。
乳酸菌复合菌剂的制备:将筛选获得的M4、M5和M6这3株潜力菌株在MRS液体培养基中培养(含NaCl 6%),45 ℃培养48 h的培养液按体积比1∶1∶1混合制作组合菌剂。
在接种枯草芽孢杆菌后,实验组接种5%乳酸菌混合菌剂,对照组1(空白对照)接种5%灭菌LB培养基空白液,对照组2接种5% MRS液体培养基空白液。实验结果如图7所示。
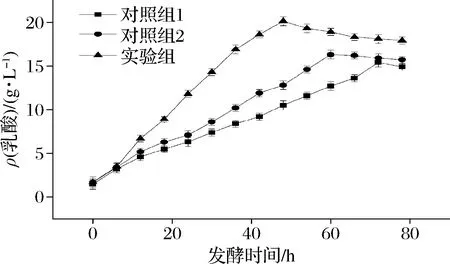
图7 不同实验条件下乳酸浓度随发酵时间变化Fig.7 Variation of lactic acid concentration with fermentation time under different experimental conditions
由图7可知,发酵开始后6 h,实验组及2组对照组发酵液中乳酸含量均缓慢上升,3组乳酸含量差别不大。发酵6 h向实验组接种乳酸菌复合菌剂后,发酵液乳酸含量急剧上升;发酵至48 h时,实验组发酵液中乳酸含量达到最高值(20.5±0.6) g/L;随着发酵时间的延长,实验组发酵液中乳酸含量稳定在最高值附近,略有降低。对照组1中虽然没有外加产酶的芽孢杆菌及后续乳酸菌,但是餐厨垃圾利用自身的土著菌群也产生了一些乳酸;由于没有外接菌种,对照组1中乳酸含量上升缓慢,发酵至72 h时,才达到最高值,仅为实验组在48 h时产乳酸量的61.1%。对照组2中虽然接种了芽孢杆菌,由于没有接种乳酸菌剂,发酵液中乳酸生成情况与对照组1较接近,但总体含量略微高了一些。对照组2发酵至60 h时,乳酸含量即达到最高值。总体而言,餐厨垃圾发酵产乳酸过程中,接种枯草芽孢杆菌和乳酸菌复合菌剂均能影响乳酸产量,且缩短乳酸含量达到最高值的发酵时间。筛选获得的乳酸菌种用于餐厨垃圾发酵产乳酸具有较大潜力。
3 结论
本研究从餐厨垃圾有机肥样品中进行乳酸菌菌种筛选,通过MRS固体培养基平板分离纯化、菌落形态和细胞形态观察,共获得6株形态各异的菌株,分别编号为B1、M2、M3、M4、M5和M6。经生理生化鉴定,所有菌株均为革兰氏阳性菌,且均符合乳酸菌生理生化特征。
耐受性实验结果表明,6株菌均具有一定的温度、盐度和酸碱度耐受性,但菌株M4、M5和M6的耐受性较高。综合考虑各菌株的耐受性,确定M4、M5和M6为潜力菌株,用于后续餐厨垃圾发酵产乳酸研究。经过分子生物学鉴定,确定M4、M5和M6分别为乳酸片球菌(Pediococcusacidilactici),干酪乳杆菌(Lactobacilluscasei)和植物乳杆菌(Lactobacillusplantarum)。抑菌性试验表明:菌株M4、M5和M6对枯草芽孢杆菌YB1没有抑菌性,可制备复合菌剂。与枯草芽孢杆菌YB1混合接种用于餐厨垃圾乳酸发酵实验,结果表明,接种乳酸菌复合菌剂能明显提高餐厨垃圾发酵产乳酸含量,与空白发酵液相比,能将乳酸产量提高63.6%,同时大大缩短了乳酸达到最高含量时的发酵时间。

