miR-149通过促进线粒体融合诱导结肠癌HT-29细胞的凋亡效应
史江颖, 毕 彩, 纪晓丹, 单树花, 李卓玉
(山西大学生物技术研究所,化学生物学与分子工程教育部重点实验室, 太原 030006)
结肠癌是最常见的消化道恶性肿瘤,死亡率高,是全世界癌症相关死亡的主要原因之一,近20年结肠癌发病率升高趋势尤为明显[1,2]。早期诊断和根治性切除可以改善患者的预后[3,4],然而,结肠癌患者缺乏早期阶段的症状,一旦发现通常已经是结肠癌晚期,导致一半的结肠癌患者容易复发和转移[5]。鉴于此,早期发现和一级预防成为显著降低结肠癌患者死亡率的有效举措[6]。目前,临床检测结肠癌的手段主要依赖于内窥镜检查和血清癌胚抗原筛查,但其临床应用受到灵敏度和特异度低的限制[7-9]。因此,筛选具有高灵敏度和特异性的新型分子标记物,阐明其在结肠癌发生发展的分子机制,可以显著优化临床治疗方法为患者带来益处。
越来越多的研究表明,肿瘤细胞即使在氧气充足的条件下,依然采用有氧糖酵解替代正常细胞的氧化磷酸化(oxidative phosphorylation,OXPHOS)产能,线粒体作为细胞的能量来源在癌细胞从氧化磷酸化到有氧糖酵解的代谢重编程中发挥着重要作用[10,11]。MicroRNAs (miRNAs/miR)是一种小型非编码RNA,负责调节转录后基因的表达,在癌症的发展过程中发挥关键作用已被不断证实[12]。Zhang等[13]比较了457例结肠癌组织与8例癌旁组织差异表达的miRNA发现,miR-149在结肠癌患者中显著降低,暗示 miR-149 在早期大肠癌发育和进展过程中发挥重要作用,可以作为潜在的结肠癌诊断标志物和治疗靶点。但是,miR-149在结肠癌细胞中的生物学功能及作用机制仍需进一步的研究探索。
因此,本研究探讨了miR-149在结肠癌HT-29细胞中的生物学功能,进一步评估了miR-149抗结肠癌HT-29细胞的活性,并从线粒体形态和结构变化的角度探讨miR-149抑制结肠癌HT-29细胞的作用机制,为miR-149进一步成为肿瘤标记物或治疗靶点奠定实验基础和理论依据。
1 材料与方法
1.1 材料
人结肠癌细胞系HT-29购自中国科学院上海生命科学研究院细胞资源中心;RPMI-1640培养基购于Hyclone公司;无支原体胎牛血清购买于上海生工生物工程有限公司;青霉素-链霉素-庆大霉素混合溶液(100×三抗)、DMSO、DAPI、PMSF、MTT、胰酶、高灵敏Western印迹发光试剂、SDS-PAGE试剂购自北京索莱宝生物科技有限公司;细胞裂解液和BCA试剂盒购自碧云天生物科技有限公司;Drp1、Mfn2、Fis1、GAPDH、BAX、BCL-2、活化胱天蛋白酶3(activated-caspase-3)、活化胱天蛋白酶9(activated-caspase-9)蛋白抗体购买自Proteintech公司,线粒体荧光探针MitoTracker®CMXRos、转染试剂Lipofection 3000购买自Invitrogen公司;JC-1探针试剂盒购自美国Sigma公司;蛋白质分子量标记物(marker)购自北京全式金生物技术有限公司。
1.2 细胞培养与转染
HT-29细胞使用RPMI1640培养基。培养基中含有青霉素-链霉素-庆大霉素混合溶液(100×三抗)与10%胎牛血清(FBS),细胞株置于含5%CO2的37 ℃恒温培养箱中培养。待细胞密度达到80%~90%时,用0.25%胰酶消化传代。
miRNA-149抑制剂(inhibitor):(序列5′-GGGAGUGAAGACACGGAGCCAGA-3′),抑制剂阴性对照(inhibitor N.C):(序列5′-CAGUACUUUUGUGUAGUACAA-3′),模拟物(mimic):(序列5′-GAGUGA AGACACGGAGCCAGAUU-3′),模拟物阴性对照(mimic N.C):(序列5′-UUGUCCGAACGU GUCACGUTT-3′)由Invitrogen公司合成。miR-149的阴性对照(N.C)、抑制剂、激活剂和转染试剂需分别混匀在不含血清的培养基中,室温反应15 min,将上述配制好的混合液加入培养基中,继续培养6 h,换新鲜含血清的培养基。转染的48~72 h期间,进行检测及相关后续实验。
1.3 MTT法检测细胞存活能力
将生长状态良好的HT-29细胞,以适合的细胞数量按照每孔100 μL的体积植入96孔板中过夜培养,待其密度达70%~80%时,向96孔板中分别转染miR-149的阴性对照(N.C)、激活剂和抑制剂处理48 h;向每个培养孔中加入20 μL MTT,继续培养4 h。吸弃旧培养基,用移液枪加入150 μL DMSO,低速震荡,使用酶联免疫荧光检测仪测定各孔在570 nm处的吸光度值。
1.4 集落形成实验
将生长状态良好的HT-29细胞接种到24孔板中,采用血球计数板进行计数,适当稀释细胞浓度至3×104/孔,待细胞贴壁,分别转染miR-149的阴性对照(N.C)、激活剂和抑制剂处理,处理48 h,在Olympus 倒置显微镜下观察肿瘤细胞的形态变化情况 (×20)。
1.5 线粒体形态观察
将HT-29细胞接种在培养板中的盖玻片上,分别用miR-149的阴性对照(N.C)、抑制剂和激活剂处理48 h;离心收集细胞,将细胞与经过37oC水浴预热的MitoTracker® Red CMXRos(100 nmol/L)共同孵育15 min;用PBS清洗3次,用含有3.7%福尔马林的完全培养液37 ℃孵育15 min,吸出多余固定液,PBS清洗收集细胞;用预冷丙酮通透5 min,PBS清洗细胞;使用DAPI染色标记细胞核,在37 ℃恒温箱中避光孵育1.5 h,PBS洗去多余染液;滴加防荧光淬灭剂,甘油封闭,使用免疫荧光显微镜观察细胞中线粒体的形态变化,通过Image J 软件统计处理组线粒体的总数量,然后用大于对照组平均线粒体长度的数量除以处理组线粒体的总数量,即为线粒体融合率。
1.6 Western免疫印迹分析
将生长状态良好的HT-29细胞接种在小皿中培养,待细胞贴壁后分别转染miR-149的阴性对照(N.C)、激活剂和抑制剂处理48 h;收集细胞加入适量细胞裂解液,冰上裂解30 min;离心收集的上清即为细胞蛋白质;BCA法进行蛋白质浓度测定,SDS-PAGE分离各蛋白质样品(每孔上蛋白质样品量为60 μg),使用脱脂牛奶溶液封闭PVDF膜上非特异的蛋白质位点;分别接入Drp1、Fis1、Mfn2、BAX、BCL-2、活化胱天蛋白酶3、活化胱天蛋白酶9蛋白质的一抗,在摇床上4oC过夜孵育,使用1×TBST缓冲液漂洗膜3次,除去未特异性结合的抗体,每次8 min;接入酶联二抗室温孵育2 h。使用1×TBST缓冲液漂洗膜3次,每次8 min,去除未特异性结合的抗体,在膜上加入化学发光液,使用X光片压片、显像,观察Drp1、Fis1、Mfn2、BAX、BCL-2、活化胱天蛋白酶3、活化胱天蛋白酶9蛋白质在细胞中的表达量的变化,并使用Image J软件统计蛋白质表达量。
1.7 细胞线粒体膜电位检测
将HT-29细胞按1×106个细胞数接种于共聚焦细胞专用培养皿中,待细胞贴壁,加入miR-149阴性对照(N.C)、抑制剂和激活剂处理细胞48 h,离心收集细胞,按照说明书配制JC-1工作液将细胞吹散,培养箱中孵育15~20 min,收集细胞,用1×染色结合液清洗细胞,再用等体积的1×染色结合液吹悬细胞,进行流式细胞仪检测。
1.8 细胞凋亡检测
将HT-29细胞接种于6孔板培养,待细胞贴壁,采用miR-149的阴性对照(N.C)、抑制剂和激活剂处理细胞48 h;吸掉含有miR-149的阴性对照(N.C)、抑制剂和激活剂的旧培养基,使用预冷的PBS清洗1次(收集液体)。未含EDTA的胰酶消化细胞后,加入等体积新鲜的RPMI-1640培养基终止消化,离心收集细胞PBS 洗涤 2 次,加入 100 μL 结合缓冲液(binding buffer) 重悬细胞,加入 5 μL Annexin V-FITC和 5 μL PI 染色液(staining solution),轻轻混匀,室温避光孵育 10 min,加入 400 μL结合缓冲液,采用流式细胞仪检测细胞凋亡情况。
1.9 统计学分析
*表示差异显著(P<0.05);运用SPSS 17.0统计软件对所得数据统计分析,两组独立样本间均数比较采用t检验,以P<0.05为差异显著。
2 结果
2.1 miR-149抑制结肠癌HT-29细胞的增殖
为了验证miR-149在结肠癌HT-29细胞中的生物学功能,采用miR-149的模拟物(mimic)与miR-149的抑制剂(inhibitor)分别构建过表达和敲减miR-149的结肠癌HT-29细胞模型。通过MTT检测敲减和过表达miR-149对结肠癌HT-29细胞增殖的影响。结果显示,miR-149 inhibitor能够显著促进结肠癌细胞HT-29的增殖,与miR-149 inhibitor N.C组相比,HT-29细胞的存活率上调20%±2.9%;miR-149 mimic能够显著抑制HT-29细胞的增殖,与miR-149 mimic N.C组相比,HT-29细胞的存活率下降到62%±4.4%(Fig.1A)。集落形成实验进一步验证了miR-149的抗结肠癌活性,结果显示,与miR-149 inhibitor N.C组相比,转染了miR-149 inhibitor后的HT-29细胞形状与对照一致呈多角型,细胞密度显著增加,细胞生长旺盛。miR-149 mimic处理后HT-29细胞与miR-149 mimic N.C组相比部分细胞变为圆形,细胞数量明显减少,细胞密度变稀疏(Fig.1B,C)。以上结果证明,miR-149高表达能够抑制结肠癌HT-29细胞的增殖。

Fig.1 miR-149 inhibits the proliferation of HT-29 cells (A) MTT assays showed the viability of HT-29 cells after transfected with miR-149 inhibitor or miR-149 mimic for 48 hours. (B) Colony formation assays were used to detected the cell growth capacity of HT-29 cells that were transfected with miR-149 inhibitor or miR-149 mimic for 48 hours. (C) Statistical results of colony formation assays. Data were presented as means ± SD (n=3). *P< 0.05, **P < 0.01 compared with control
2.2 miR-149低表达促进结肠癌HT-29细胞线粒体的分裂
为了确定miR-149低表达对结肠癌HT-29细胞线粒体形态的影响,采用线粒体荧光探针标记miR-149 inhibitor处理HT-29细胞后观察线粒体的形态。线粒体荧光标记结果显示,与miR-149 inhibitor N.C组相比,miR-149 inhibitor干预后细胞内红色小点并未发生聚集连接成线,表明miR-149 inhibitor并未促进线粒体的融合(Fig.2A,B)。已有研究证明,线粒体分裂动力蛋白质相关蛋白DRP1(dynamin-related protein1),线粒体分裂蛋白FIS1(mitochondrial fission protein1)和线粒体融合蛋白MFN2(mitofusin2)在调节线粒体分裂和融合过程中扮演着重要角色[14-17]。因此,本文进一步检测了miR-149 inhibitor处理后对结肠癌HT-29细胞内MFN2、DRP1、FIS1蛋白质的表达变化。Western 印迹结果证明,miR-149 inhibitor能够显著降低MFN2的表达、同时促进DRP1和FIS1的表达(Fig.2C,D)。这些结果揭示了miR-149低表达能够通过促进结肠癌HT-29细胞中DRP1和FIS1的表达,抑制MFN2的表达从而促进线粒体分裂。

Fig.2 Low expression of miR-149 promotes mitochondrial division in HT-29 cells HT-29 cells were seeded on coverslips in 24-well plates and treated with miR-149 inhibitor N.C or miR-149 inhibitor for 48 hours. (A) Representative images of mitochondrial morphology. HT-29 cells were infected with miR-149 inhibitor N.C or miR-149 inhibitor for 48 hours. Mitochondrial morphology was observed by confocal fluorescent microscope with Mitotracker dye. Cell nuclei were counter-stained by DAPI. (B) Statistical analysis of mitochondrial fusion rate was performed using Image J software. Data were presented as means ± SD (n=3). *P< 0.05, **P< 0.01 compared with control. (C) Western blotting assays showed the expression of DRP1, FIS1 and MFN2 in HT-29 cells transfected with miR-149 inhibitor N.C or miR-149 inhibitor. (D) Relative protein levels of DRP1, FIS1 and MFN2 were analyzed by Image J software. Data were presented as means ± SD (n=3). *P< 0.05, **P< 0.01 compared with control
2.3 miR-149高表达诱导结肠癌HT-29细胞线粒体融合
为了进一步探究miR-149对线粒体融合的影响,用线粒体荧光探针标记miR-149 mimic后观察HT-29细胞线粒体的形态。结果显示,相较于miR-149 mimic N.C组,miR-149 mimic处理后红色小点连接呈线,融合现象增加(Fig.3A,B)。表明miR-149能够诱导线粒体融合。为了进一步证明miR-149高表达对线粒体分裂和融合行为的调节作用,本文采用Western印迹技术检测了miR-149 mimic处理后HT-29细胞中线粒体分裂和融合相关蛋白质的表达情况。结果表明,miR-149 mimic处理组与miR-149 mimic N.C组相比MFN2的表达量明显上调,而DRP1、FIS1的表达量明显下调(Fig.3C,D)。以上结果进一步证明,miR-149高表达促进HT-29细胞线粒体融合。

Fig.3 High expression of miR-149 induces mitochondrial fusion in HT-29 cells HT-29 cells were seeded on coverslips in 24-well plates and treated with miR-149 inhibitor N.C or miR-149 inhibitor for 48 hours. (A) Representative images of mitochondrial morphology. HT-29 cells were infected with miR-149 mimic NC or miR-149 mimic for 48 hours. Mitochondrial morphology was observed by confocal fluorescent microscope with Mitotracker dye. Cell nuclei were counter-stained by DAPI. (B) Statistical analysis of mitochondrial fusion rate was performed using Image J software. Data were presented as means ± SD (n=3). *P< 0.05, **P< 0.01 compared with control. (C) Western blotting assays showed the protein levels of DRP1, FIS1 and MFN2 in HT-29 cells that were transfected with miR-149 mimic NC and miR-149 mimic. (D) Relative protein levels of DRP1, FIS1 and MFN2 were analyzed by Image J software. Data were presented as means ± SD (n=3). *P < 0.05, **P < 0.01 compared with control
2.4 miR-149通过促进结肠癌HT-29细胞线粒体融合诱导线粒体膜电位下降
为了确定miR-149促进结肠癌HT-29细胞线粒体过度融合后对线粒体功能状态的影响。进一步采用流式细胞仪检测miR-149对结肠癌HT-29细胞线粒体膜电位的变化,结果显示,miR-149 inhibitor处理后与miR-149 inhibitor N.C组相比,细胞线粒体膜电位升高;而miR-149 mimic处理组与miR-149 mimic N.C组相比,细胞线粒体膜电位降低(Fig.4A-B)。表明miR-149介导结肠癌HT-29细胞线粒体融合诱导线粒体膜电位下降。据文献[18]报导,BCL-2调控线粒体内、外膜的完整性,能够增加线粒体基质内质子的外流,抑制线粒体膜电位的下降;BAX通过与线粒体外膜上的电压依赖性阴离子通道(voltage-depedent anion channel, VDAC)结合,使线粒体PT孔(permeability transition pore)开放,从而诱导线粒体膜电位的下降。因此,本文通过检测BAX和BCL-2蛋白质的表达水平,评价miR-149诱导结肠癌HT-29细胞线粒体融合对线粒体膜电位的影响。Western 印迹结果显示,miR-149 inhibitor处理后与miR-149 inhibitor N.C组相比,BAX的表达水平显著下调,BCL-2的表达水平显著上调;而miR-149 mimic处理后与miR-149 mimic N.C组相比,BAX的表达水平显著上调,BCL-2的表达水平显著下调(Fig.4C)。综上所述,miR-149通过促进线粒体融合诱导结肠癌HT-29细胞线粒体膜电位下降。

Fig.4 miR-149 induces a decrease of mitochondrial membrane potential by promoting the fusion of mitochondria in HT-29 cells (A) HT-29 cells were transfected with miR-149 inhibitor N.C, miR-149 inhibitor, miR-149 mimic N.C or miR-149 mimic for 48 hours. The mitochondrial membrane potential level of HT-29 cells was detected by flow cytometry. (B) Statistical analysis of mitochondrial membrane potential was performed using Image J software. Data were presented as means ± SD (n=3). *P < 0.05,**P < 0.01 compared with control. (C) Western blotting for BAX and BCL-2 protein expression in HT-29 cells. HT-29 cells were transfected with miR-149 inhibitor N.C, miR-149 inhibitor, miR-149 mimic N.C or miR-149 mimic
2.5 miR-149通过促进结肠癌HT-29细胞线粒体融合诱导线粒体介导的细胞凋亡
线粒体在细胞凋亡中发挥重要的作用,线粒体内跨膜电位的降低,是细胞凋亡级联反应的早期事件[19]。为明确miR-149促进结肠癌细胞线粒体融合是否诱发线粒体介导的细胞凋亡。进一步采用流式细胞技术评价miR-149对结肠癌细胞的凋亡作用。结果显示,miR-149 inhibitor处理后与miR-149 inhibitor N.C组相比,细胞凋亡率未见显著变化;miR-149 mimic处理组与miR-149 mimic N.C组相比,细胞凋亡率增加了5.64倍(Fig.5A,B)。研究表明,线粒体融合与线粒体膜电位降低,都是线粒体凋亡的指标[14]。本文通过Western免疫印迹检测了miR-149对HT-29细胞中凋亡相关蛋白质活化胱天蛋白酶3与活化胱天蛋白酶9与表达水平的影响。结果表明,miR-149 inhibitor处理后与miR-149 inhibitor N.C组相比,活化胱天蛋白酶3与活化胱天蛋白酶9表达水平下调;miR-149 mimic处理组与miR-149 mimic N.C组相比,活化胱天蛋白酶3与活化胱天蛋白酶9表达水平显著上调(Fig.5C)。以上结果进一步证明,miR-149通过促进结肠癌细胞线粒体融合诱导结肠癌HT-29细胞的凋亡。
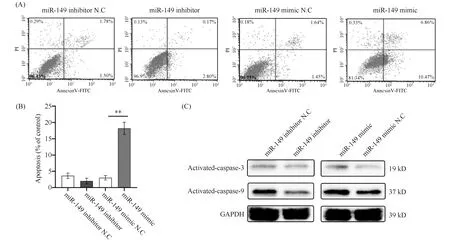
Fig.5 miR-149 induces colon cancer cell apoptosis by promoting mitochondrial fusion of HT-29 cells (A) HT-29 cells were transfected with miR-149 inhibitor N.C, miR-149 inhibitor, miR-149 mimic N.C or miR-149 mimic for 48 hours. The apoptosis levels of HT-29 cell were detected by flow cytometry. (B) Statistical analysis of apoptosis level for HT-29 cells was performed using Image J software. Data were presented as means ± SD (n=3). *P < 0.05, **P < 0.01 compared with control. (C) Western blotting assays showed the levels of activated-caspase-3 and activated-caspase-9 in HT-29 cells that were transfected with miR-149 inhibitor N.C, miR-149 inhibitor, miR-149 mimic N.C or miR-149 mimic
3 讨论
结肠癌的高死亡率和预后差使其成为全世界癌症相关死亡的主要原因之一,已有的研究表明,由于结肠癌患者早期症状不明显,导致诊断晚,易发生癌转移,使得大肠癌早期患者的5年生存率从90%急剧下降至10%以下[20,21]。然而,目前结肠癌的主要筛查手段仍存在敏感性和特异性较低等缺陷。因此,迫切需要筛选新的生物标记物作为结肠癌的诊治靶点,阐明其在结肠癌发生发展中的分子机制,推动新生物标记物的进一步临床转化。
大量研究已经揭示了miRNAs 参与各种疾病的发生发展,特别是与癌症的发病紧密相关。相关研究表明,miR-149的上调可以靶向c-myc的3′-UTR从而抑制丙酮酸激酶同工酶2(Pyruvate kinase isozyme typeM2,PKM2)介导的有氧糖酵解,发挥抗结肠癌活性,miR-149 基因 rs2292832多态性位点具有降低消化道肿瘤患者易感性和复发率的风险[22-25],揭示了miR-149在结肠癌中发挥着关键作用。本研究结果证明,miR-149的抑制剂能够显著促进结肠癌细胞HT-29的增殖,而对于miR-149的激活剂则能够显著抑制HT-29细胞的增殖,本研究结果揭示,miR-149高表达能够抑制结肠癌细胞的增殖,这与文献调研的结果一致 。
肿瘤细胞与正常细胞的氧化磷酸化产能相比无论在有氧还是无氧的条件下均采用有氧糖酵解产能,这种能量代谢重编程的现象是肿瘤细胞的基本特征之一,线粒体是重要的能量代谢加工场,肿瘤细胞的线粒体明显异于正常细胞[10],阐明线粒体结构的变化对肿瘤细胞线粒体功能异常与肿瘤发生发展尤为重要。已有文献报道[14],线粒体通过分裂和融合不断地影响着线粒体的形态结构和功能的改变。线粒体融合则导致线粒体形态延长和结构损伤,并且线粒体融合蛋白Mfn2升高可降低线粒体膜电位,促使细胞色素C从线粒体释放入胞质内;同时可以激活胱天蛋白酶家族,下调BCL-2表达,上调BAX表达,增加BAX/BCL-2比率,触发线粒体介导的细胞内源性凋亡通路。因此,本文将探明miR-149与线粒体结构和功能异常的关系,揭示miR-149抑制结肠癌HT-29细胞增殖的作用机制。线粒体的形态变化受到许多调节因子的影响,目前,研究较多的是DRP1、FIS1和MFN2[26]。多个DRP1在线粒体分裂位点上组装成聚合体,并能通过聚合体的收缩调控线粒体分裂进程;FIS1定位于线粒体外膜,其在线粒体分裂进程中负责召集分布在线粒体内的DRP1移动到线粒体外组装成聚合体[27];而MFN2能诱导乳腺癌细胞阻滞在G0/G1期,并且会引起线粒体过度聚集进而诱导细胞凋亡[28],可见线粒体融合与细胞增殖的调控息息相关。本研究结果证实,miR-149能够通过促进MFN2的表达,抑制DRP1和FIS1的表达诱导结肠癌HT-29细胞中线粒体融合。线粒体是细胞凋亡的调控中心,在线粒体结构发生异常变化时线粒体外膜通道打开,激活胱天蛋白酶介导的内源性凋亡蛋白质的表达。本研究结果显示,miR-149高表达促进了线粒体膜电位下降,进而促进了线粒体介导的内源性细胞凋亡。综上,本文的研究结果证明,miR-149通过抑制线粒体分裂蛋白质DRP1和FIS1的表达,促进线粒体融合蛋白质MFN2的表达诱导线粒体融合致使线粒体膜电位下降,进而触发了线粒体介导的结肠癌细胞内源性凋亡,从而抑制了结肠癌细胞的增殖,发挥了抗结肠癌效应。本研究进一步丰富了miRNAs参与肿瘤治疗的理论研究,为miR-149进一步成为肿瘤标记物或治疗靶点奠定实验基础和理论依据。

