转谷氨酰胺酶2通过mTOR通路和自噬调控全反式维甲酸诱导的白血病细胞HL60和U937的髓系分化
张梅超, 孟依灵, 应影霞, 李 栋
(上海交通大学医学院附属第九人民医院 放疗科, 上海 201999)
急性髓系白血病是由正常髓系细胞分化的发育过程中不同阶段造血细胞恶性变转化而来,是造血系统的髓系原始细胞的克隆性恶性增殖疾病[1]。现已证实,全反式维甲酸(all trans retinoic acid,ATRA)是其中急性早幼粒细胞白血病(acute promyelocytic leukemia,APL)特异相关基因靶向的治疗药物,其敏感性与APL中PML-RARα融合基因高度相关[2]。自采用ATRA治疗以来,APL预后大为改观,成为唯一的一种只需化疗而不需要骨髓移植就能治愈的白血病[3]。ATRA的应用不仅取得了高完全缓解率,且奠定了由“杀伤”到“诱导”的白血病治疗新思路。研究表明,除了PML-RARα融合的APL,ATRA在无PML-RARα融合的急性髓系白血病中也有一定的治疗效果[4]。ATRA治疗也会引起一些并发症(例如高白细胞综合症、维甲酸综合征等)或发生愈后复发。因此,对ATRA诱导分化调控机制的研究非常重要,以期寻找能够促进ATRA诱导分化、缩短治疗时间、维持治疗效果、减少并发症等的方法。
转谷氨酰胺酶 2 (transglutaminase 2,TGM2) 属于转谷氨酰胺酶家族,它是在哺乳动物组织中普遍表达的多功能酶[5,6]。TGM2具有Ca2+依赖性蛋白质翻译后修饰功能,催化肽链上的谷氨酰胺和多种伯胺之间形成共价键,包括肽链上赖氨酸的γ氨基,或单胺和多胺,形成不可逆的 e-(c-glutamyl)-lysine交联,从而产生交联或胺化的蛋白质。TGM2 还具有多种酶活性,包括水解酶、蛋白质二硫键异构酶和蛋白激酶活性[5-7]。TGM2 还与多种生物学功能相关,包括细胞凋亡、细胞迁移和细胞黏附等[5,6,8,9]。TGM2能够参与多种信号通路的调控,例如NF-κB 信号通路、mTOR信号和自噬等[10-12]。
ATRA能诱导TGM2表达,从而导致增殖抑制和细胞分化等。在人支气管表皮细胞中,ATRA能诱导TGM2表达上调,导致细胞增殖受到抑制[13];ATRA诱导的上皮细胞向黏膜表皮细胞转分化过程中也需要TGM2的作用[14]。ATRA诱导APL细胞NB4分化时,TGM2表达升高;TGM2被敲低,则分化受到抑制[15]。但其调控细胞分化的机制及涉及的信号通路尚不明确,且TGM2在ATRA治疗其它急性髓系白血病中的作用和机制也不明确。本研究旨在进一步确认TGM2在ATRA诱导白血病细胞分化中的表达变化和作用,并初步探究其作用机制。
1 材料与方法
1.1 抗体与试剂
Western印迹中使用的抗体如下:兔源一抗mTOR(2983)、p-mTOR(2971)、S6K1(9202)、p-S6K1(9208)、p-ULK1(14202)、ULK1(8054)、LC3A/B(12741)、P62(5114)购自Cell Signaling Technology;兔源一抗p-eIF4EBP1(AP0032)、eIF4EBP1(A19045)购自武汉埃博泰克生物科技有限公司;鼠源一抗β-肌动蛋白(HC-201)购自北京全式金生物技术股份有限公司。二抗抗兔IgG-HRP(7074)、抗鼠IgG-HRP(7076)购自Cell Signaling Technology,一抗按1∶1 000用一抗稀释液(P0023A,碧云天)稀释,二抗按1∶5 000用5%脱脂牛奶稀释。
10 mmol/L 浓度的ATRA(HY-14649)购自MedChemExpress,用DMSO倍比稀释为5 mmol/L、2.5 mmol/L、1.25 mmol/L、0.625 mmol/L、0.3125 mmol/L及1 mmol/L,-20 ℃保存。
1.2 细胞培养
HL60细胞和U937细胞接种于添加有10%胎牛血清(FBS;Sigma-Aldrich)、2 mmol/L 谷氨酰胺(Sigma-Aldrich)、100 U/mL青霉素和100 μg/mL 链霉素溶液(Sigma-Aldrich)的RPMI1640培养基(Sigma-Aldrich)中。以上细胞皆静置在37 ℃、5% CO2培养箱中培养。
1.3 病毒包装和感染细胞筛选
基于慢病毒载体pLKO.1-TRC构建干扰TGM2的shRNA质粒,shRNA序列如下:
Sh1:5′-CCGGCCACCCACCATATTGTTTGATCT CGAGATCAAACAATATGGTGGGTGGTTTTTG-3′;sh2:5′-CCGGACAGCAACCTTCTCATCGAGTCTCGAGAC TCGATGAGAAGGTTGCTGTTTTTTG-3′。
根据pLKO.1-TRC载体说明书包装病毒并收集病毒液,4 ℃ 3 000 r/min离心15 min。每1×106细胞用2 mL病毒液重悬铺入6孔板,并加入10 ng/mL聚凝胺,混匀后放入培养箱孵育过夜,离心去掉病毒液,细胞用新鲜培养基重悬后,继续培养24 h,加入5 ng/mL嘌呤霉素筛选培养,每d离心去除死亡细胞,直至稳定培养并收集部分细胞用于检测敲低效率。
1.4 实时定量荧光PCR检测
细胞离心沉淀后去上清,并用PBS洗2次。细胞沉淀用RNAiso plus试剂(9109,TAKARA),并根据说明书抽提总RNA。RNA定量后,使用PrimeScript? One Step RT-PCR Kit Ver.2(RR055A,TAKARA)反转录成cDNA,并使用SYBR Green Master Mix Reagent (11201ES03,上海翌圣)在罗氏Light Cycler 480荧光定量PCR仪进行检测。
使用的引物:分化抗原簇分子11b(cluster of differentiation molecule 11b,CD11b)上游引物:5′-ACTTGCAGTGAGAACACGTATG-3′,下游引物:5′-TCATCCGCCGAAAGTCATGTG-3′;TGM2上游引物:5′-CAAGGCCCGTTTTCCACTAAG-3′,下游引物:5′-GAGGCGATACAGGCCGATG-3′,以GAPDH为内参,采用2-ΔΔCt法分析CD11b和TGM2 mRNA的相对表达量。
1.5 Western印迹分析
采用细胞裂解液(P0013,碧云天)提取细胞总蛋白质,并使用BCA法(P0010,碧云天)进行蛋白质定量,经聚丙烯酰胺凝胶电泳分离,转至PVDF膜,加入5%脱脂牛奶,室温封闭2 h,加入一抗,4 ℃ 孵育过夜,洗膜缓冲液洗膜,加入二抗(稀释比例为1∶5 000),室温孵育1 h,化学发光显影。
1.6 统计学方法
使用 GraphPad Prism 8.0分析软件处理数据, 组间数据比较采用 Student’st检验分析。所有数据均重复3次。P<0.05被认为差异具有统计学意义。
2 结果
2.1 全反式维甲酸能诱导HL60和U937细胞中CD11b表达上调
有文献报道,ATRA能够诱导HL60和U937两种细胞的髓系分化[16]。对这2种细胞在ATRA处理下的分化特性进行了验证。首先,用不同浓度的ATRA(0、0.3125、0.625、1.25、2.5、5 μmol/L)处理HL60和U937两种细胞24 h,检测髓系分化标志CD11b的mRNA水平。在HL60细胞中,与0 μmol/L ATRA处理的相比,不同浓度的ATRA处理分别使CD11b的mRNA升高10.1倍、31.2倍、42.4倍、71.8倍、82.7倍;而在U937细胞中,分别升高1.16倍、1.36倍、2.84倍、6.33倍、6.61倍(P<0.05,Fig.1A)。由此可见,ATRA处理24 h后,2种细胞中CD11b的mRNA水平均升高,且呈现浓度梯度依赖性的升高。结合文献,1 μmol/L的ATRA 经5 d诱导,可使大部分HL60细胞分化[17],CD11b表达上调,且第5 d之后细胞开始大量凋亡[18]。因此,1 μmol/L的ATRA被用来分别处理HL60和U937两种细胞0、1、2、3、4、5 d,检测HL60和U937两种细胞髓系分化标志CD11b的mRNA水平的时相变化。检测发现,2种细胞中CD11b的mRNA水平均升高:其中,HL60细胞在ATRA处理3 d时,CD11b的mRNA水平均升至最高,为0 d的60.4倍,之后升高倍数降低;而U937细胞在ATRA处理5 d时升至最高,为0 d的4.18倍(P<0.05,Fig.1B)。这些数据表明,ATRA能够诱导HL60和U937细胞分化,并呈现浓度梯度依赖特性,且随时间延长分化增强。
2.2 全反式维甲酸能诱导HL60和U937细胞中转谷氨酰胺酶2表达上调
经进一步检测在HL60和U937细胞中ATRA处理对TGM2的影响。结果显示,1 μmol/L ATRA处理细胞,使HL60细胞中TGM2的mRNA水平在第3 d达到最高,为0 d的5.65倍;而在U937细胞中,TGM2的mRNA水平第1 d升至最高,为0 d的4.98倍,之后升高倍数降低,但仍维持在0 d的2倍以上(P<0.05,Fig.2A)。在HL60细胞中,TGM2蛋白质水平随刺激天数升高,第5 d达到最高;在U937细胞中,TGM2蛋白质水平第1 d升至最高,之后维持较高水平(P<0.05,Fig.2B)。这些结果表明,ATRA能诱导HL60和U937细胞中的TGM2表达上调。

Fig.2 Effects of ATRA on TGM2 expression in HL60 and U937 cells (A) HL60 and U937 cells were plated into 6-well plates at 1×106 cells/well. ATRA at a final concentration of 1 μmol/L was added, and samples were collected at 0, 1, 2, 3, 4 and 5 days to detect the mRNA level of TGM2 by qPCR. Values are the mean ± SD of three separate experiments. *P<0.05, compared with 0 day. (B) HL60 and U937 cells were plated into 6-well plates at 1×106 cells/well, ATRA at a final concentration of 1 μmol/L was added, and samples were collected at 0, 1, 3 and 5 days to detect the protein level of TGM2 by Western blotting. Three separate experiments were performed, and similar results were obtained
2.3 转谷氨酰胺酶2敲低削弱全反式维甲酸在HL60和U937细胞中诱导的CD11b表达增加
为了探究TGM2在ATRA诱导HL60和U937细胞分化中的作用,本文构建包含TGM2 shRNA序列的慢病毒载体,并筛选出稳转细胞株,通过Western印迹检测,2个shRNA序列均能有效敲低TGM2(P<0.05,Fig.3A)。HL60和U937稳转细胞分别经1 μmol/L ATRA处理3 d和5 d,检测CD11b的mRNA水平。结果显示,与对照NC相比,诱导后HL60细胞敲低组中,CD11b的mRNA水平都明显降低,2个敲低细胞株分别降低44.3%、39.1%;诱导后U937细胞的2个敲低细胞株的CD11bmRNA水平分别比NC组降低59.1%、54.3%(P<0.05,Fig.3B)。上述结果表明,在HL60和U937细胞中TGM2敲低可抑制ATRA诱导的髓系分化。
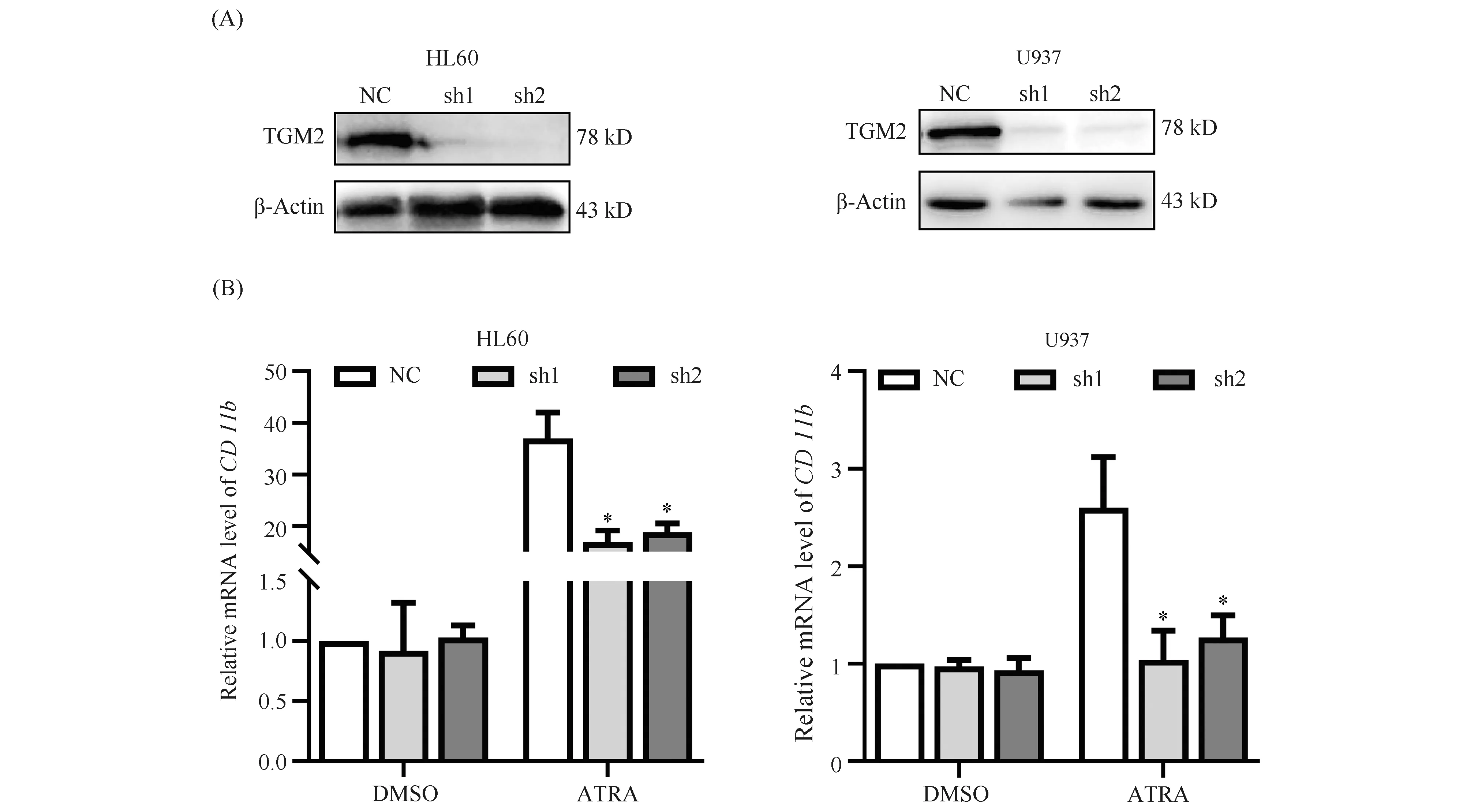
Fig.3 Effects of TGM2 knockdown on ATRA-induced differentiation of HL60 and U937 cells (A) Lentiviral vectors containing TGM2 shRNA sequences were constructed, and stably transfected cells were screened. 1×106 cells of each were taken to extract proteins, and Western blotting was performed. Three experiments were performed, and similar results were obtained. (B) The cells were plated into 6-well plates at 1×106 cells/well, and were added with 2 μL DMSO or ATRA (1 mmol/L), respectively. After 3 days of induction for stably transfected HL60 cells, and 5 days for stably transfected U937 cells, samples were collected to detect the mRNA level of CD11b. Values are the mean ± SD of three separate experiments. *P<0.05, compared with NC
2.4 转谷氨酰胺酶2敲低可减弱全反式维甲酸对mTOR信号通路的抑制
为了进一步探究TGM2调控ATRA诱导的HL60和U937细胞分化的作用机制,本文检测了TGM2敲低的细胞在ATRA诱导时mTOR信号通路的改变。结果显示,同DMSO对照相比,加入ATRA诱导24 h,mTOR和其下游的核糖体S6蛋白激酶1(ribosomal protein S6 kinase 1,S6K1)、真核翻译起始因子4E结合蛋白 1(recombinant eukaryotic translation initiation factor 4E binding protein 1,eIF4EBP1)、UNC-51样自噬激活激酶1(UNC-51-like autophagy activating kinase 1,ULK1)的磷酸化水平明显降低 (#P<0.05,Fig.4),结果提示,ATRA能够抑制mTOR信号通路,这与文献报道一致[19]。而TGM2敲低后,mTOR和其下游的S6K1、eIF4EBP1、ULK1的磷酸化水平均明显升高(*P<0.05,Fig.4),这提示TGM2敲低能够增强mTOR信号通路。同时,TGM2的敲低能够部分恢复ATRA处理导致的mTOR和S6K1磷酸化水平的降低 (Fig.4)。上述结果表明,TGM2可增强ATRA对mTOR信号通路的抑制。

Fig.4 Effects of TGM2 knockdown and ATRA induction on the mTOR signaling pathway (A) The stably transfected HL60 cells with TGM2 knockdown were plated into 6-well plates at 1×106 cells/well, and 2 μL of DMSO or ATRA (1 mmol/L) were added, respectively. After 24 hours, samples were collected, and Western blotting was used to detect the correlation of the mTOR signaling pathway. The gray value of each band was measured and the relative levels of p-mTOR/mTOR, p-S6K1/S6K1, p-eIF4EBP1/eIF4EBP1 and p-ULK1/ULK1 were calculated. Values are the mean ± SD of three separate experiments. *P<0.05, compared with NC; #P<0.05 vs compared with the DMSO group. (B) The stably transfected U937 cells with TGM2 knockdown were plated into 6-well plates at 1×106 cells/well, and 2 μL of DMSO or ATRA (1 mmol/L) were added, respectively. After 24 hours, samples were collected, and Western blotting was used to detect the correlation of the mTOR signaling pathway. The gray value of each band was measured and the relative levels of p-mTOR/mTOR, p-S6K1/S6K1, p-eIF4EBP1/eIF4EBP1 and p-ULK1/ULK1 were calculated. Values are the mean ± SD of three separate experiments. *P<0.05, compared with NC; #P<0.05 vs compared with DMSO group
2.5 转谷氨酰胺酶2敲低可减弱全反式维甲酸诱导的自噬增强
前述结果显示,TGM2敲低能够促进mTOR下游的ULK1上757位的丝氨酸磷酸化水平升高,而其磷酸化会抑制自噬[20]。为了探究TGM2敲低对ATRA诱导的HL60和U937细胞分化的抑制作用是否通过自噬途径,本文检测了自噬标志P62和LC3 Ⅱ与LC3 Ⅰ的比率(LC3 Ⅱ/Ⅰ)。结果显示,同DMSO对照相比,加入ATRA诱导24 h,自噬标志P62蛋白水平降低,LC3 Ⅱ/Ⅰ的比值升高(#P<0.05,Fig.5)。而TGM2敲低后,P62蛋白水平升高,LC3 Ⅱ/Ⅰ的比值降低(*P<0.05,Fig.5)。TGM2敲低能够部分恢复ATRA处理导致P62降低、LC3 Ⅱ/Ⅰ升高(Fig.5)。结果表明,TGM2敲低可减弱ATRA诱导的自噬增强。

Fig.5 Effects of TGM2 knockdown and ATRA induction on autophagy (A) The stably transfected HL60 cells with TGM2 knockdown were plated into 6-well plates at 1×106 cells/well, and 2 μL of DMSO or ATRA (1 mmol/L) were added, and the samples were collected 24 hours later, and the indicated markers of autophagy were detected by Western blotting. The gray value of each band was measured and the relative levels of P62/β-Actin and LC3 II/I were shown. Values are the mean ± SD of three separate experiments. * P<0.05, compared with NC; N.S., no significance, #P<0.05 vs compared with the DMSO group. (B) The stably transfected U937 cells with TGM2 knockdown were plated into 6-well plates at 1×106 cells/well, and 2 μL of DMSO or ATRA (1 mmol/L) were added. The samples were collected 24 hours later, and the indicated markers of autophagy were detected by Western blotting. The gray value of each band was measured and the relative levels of P62/β-Actin and LC3 II/I were shown. Values are the mean ± SD of three separate experiments. * P<0.05, compared with NC; #P<0.05 vs compared with DMSO group
综合以上结果,本研究发现:ATRA能诱导HL60和U937细胞的CD11b和TGM2表达升高;而TGM2敲低则抑制ATRA诱导的CD11b升高。在HL60和U937中,ATRA能抑制mTOR信号通路、诱导自噬;TGM2敲低则增强mTOR信号通路并抑制自噬,且能部分恢复ATRA导致的mTOR信号通路抑制和自噬增强。这提示,TGM2可能通过mTOR信号通路和自噬调控ATRA诱导髓系分化。
3 讨论
已有研究报道,在APL细胞NB4中,ATRA能够诱导TGM2表达上调,而TGM2被敲低,ATRA诱导的分化标志表达水平降低,分化的细胞增殖能力增强,黏附、迁移和吞噬能力降低[15]。为了进一步确定TGM2在ATRA诱导白血病细胞分化中的作用,并研究其作用机制,本文选用了HL60和U937细胞。ATRA诱导HL60和U937细胞分化存在浓度梯度和时间依赖的特征,其中HL60细胞的髓系标志CD11b的mRNA表达改变倍数比U937细胞更高(Fig.1)。而ATRA同样能够诱导TGM2在mRNA水平和蛋白质水平升高(Fig.2)。进一步将TGM2敲低能够抑制ATRA诱导的髓系分化(Fig.3)。这些结果表明,TGM2对ATRA诱导的HL60和U937细胞的髓系分化有正调控作用,且ATRA诱导的TGM2的升高及TGM2的调控作用并不是NB4细胞特异的,具有一定的广泛性。
有文献报道,在NB4和HL60中,ATRA能够抑制mTOR信号通路,用雷帕霉素进一步抑制mTOR信号通路时分化增强[19,21]。与文献报道相似,本研究发现,ATRA均能够抑制HL60和U937细胞中mTOR及其下游分子的磷酸化,且诱导其分化。且结果进一步表明,TGM2被敲低,mTOR及其下游分子的磷酸化增强,而且被ATRA抑制的mTOR信号通路得到部分恢复,同时ATRA诱导的髓系分化被部分抑制。上述结果提示,TGM2可能通过mTOR信号通路调控ATRA诱导的髓系分化。
ATRA能够诱导自噬,通过自噬途径降解异常融合蛋白PML-RARα促进APL细胞分化[22,23];而在肿瘤细胞中,TGM2能够调控自噬[12,24]。通过Western印迹检测自噬标志P62及LC3 II/I,本文发现,在HL60和U937细胞中,ATRA均能够抑制促进自噬;TGM2敲低后则自噬被抑制,且由ATRA增强的自噬被适当减弱。结合TGM2敲低抑制ATRA诱导的髓系分化的结果推测,TGM2可通过增强自噬促进ATRA诱导的白血病细胞髓系分化。
另外,ULK1是mTOR的底物之一,其757位丝氨酸可被mTOR磷酸化,从而抑制ULK1的活性,导致自噬减弱[20]。本研究发现,ATRA能抑制ULK1磷酸化,而TGM2敲低则促进ULK1磷酸化。这提示,TGM2可能通过mTOR信号通路调控自噬并进一步调控ATRA诱导的髓系分化。但是,TGM2在ATRA诱导HL60和U937细胞分化中调控mTOR信号通路和自噬的具体机制尚需进一步的研究。
本研究确认了TGM2在ATRA诱导髓系白血病细胞分化中的作用,并初步揭示了其通过调控mTOR信号通路和自噬参与了ATRA诱导的髓系白血病细胞分化的作用机制。该研究将有利于更深入地了解ATRA诱导AML细胞分化的过程和机制,也有利于加深对TGM2的多功能性的认识;有助于对AML等白血病及其它癌症的药物诱导疗法的探讨。

