基于vWF/GPIb-IX-V信号通路的丹红注射液对急性血瘀大鼠模型活血化瘀作用及机制研究
刘 旭,吴宿慧,陈小菲,张宇航,李寒冰*,唐进法*
基于vWF/GPIb-IX-V信号通路的丹红注射液对急性血瘀大鼠模型活血化瘀作用及机制研究
刘 旭1,吴宿慧1,陈小菲2,张宇航1,李寒冰1*,唐进法2*
1. 河南中医药大学 河南省中医药“治未病”健康重点实验室,河南 郑州 450046 2. 河南中医药大学第一附属医院 河南省中药临床应用、评价与转化工程研究中心,河南 郑州 450000
观察丹红注射液对急性血瘀大鼠模型的影响,探讨丹红注射液调控血瘀证血小板功能的作用机制。60只SD大鼠随机分为空白组、模型组、舒血宁注射液(1.8 mL/kg)组和丹红注射液高、中、低剂量(1.4、0.7、0.35 mL/kg)组,尾iv给予药物干预11 d后,采用sc肾上腺素联合冰水浴制备急性血瘀证大鼠模型,再给予药物干预1 d后,检测血流变指标、凝血功能指标,血小板活化黏附、聚集、释放相关指标;观察耳廓微循环、心电图和心尖、腹主动脉组织病理变化;采用qRT-PCR和Western blotting检测心肌组织蛋白激酶B1(protein kinase B1,Akt1)、p38、细胞外信号调节激酶1/2(extracellular signal-regulated kinases1/2,ERK1/2)的表达。与空白组比较,模型组大鼠血液流变学、血管性血友病因子(von Willebrand factor,vWF)、纤连蛋白(fibronectin,FN)、血栓素B2(thromboxane B2,TXB2)、β-血栓环蛋白(β-thromboglobulin,β-TG)、血小板第四因子(platelet factor 4,PF4)指标显著升高(<0.05、0.01),6-酮-前列腺素F1α(6-keto-prostaglandin F1α,6-keto-PGF1α)、耳廓微循环血流量显著降低(<0.01),心肌组织p-Akt1、p-ERK1/2、p-p38蛋白表达以及、、基因表达水平均显著升高(<0.01)。与模型组比较,丹红注射液能够不同程度地降低血液流变学指标、vWF、FN、TXB2、β-TG、PF4(<0.05、0.01),升高6-keto-PGF1α(<0.05、0.01),显著提高凝血酶时间(thrombin time,TT)值(<0.05、0.01),保护心脏,增加耳廓微循环血流量(<0.05)。心尖、腹主动脉组织HE染色结果显示,模型组大鼠心肌、血管内膜出现轻微损伤,弹力纤维破坏,由于斑块脱落导致开始出现空泡;丹红注射液组大鼠心肌、血管内膜和内皮细胞以及弹力纤维显著改善。丹红注射液可以恢复血液流变学、凝血功能,改善血管内皮细胞、心肌细胞功能,通过调控vWF/GPIb-IX-V介导的信号通路及血小板功能,对大鼠急性血瘀有较好的保护和治疗作用。
丹红注射液;急性血瘀;心血管疾病;血小板功能;血管性血友病因子;表面受体糖蛋白Ib-IX-V
血瘀证为中医常见证候,是瘀血内阻,以疼痛、肿块、出血、瘀血为主要表现的病证,凡离开经脉之血不能及时消散和瘀滞于某一处,停留体内使得血运不畅,或血流循行迟缓不流畅,郁积于经脉或器官之内呈凝滞状态均为瘀血[1]。微循环障碍是血瘀证的基本病理变化和客观指标[2],当凝血功能出现障碍时,会造成明显的微循环障碍,血流缓慢[3]。血小板的活化、聚集和释放是造成血瘀的重要生理和病理基础,血液在组织器官中呈瘀滞状态[4],血小板的活化、聚集、释放等功能增强,均会使血液处于高凝状态,血行不畅,形成血栓。血小板功能活化和瘀血最终都会导致血瘀证。血瘀会阻碍气血运行,导致气血运行缓慢,如果血瘀长期得不到有效的治疗,会在局部形成肿块。还会导致心脏供血不足,长此以往,会逐渐发展为冠心病,引起胸闷、疼痛等症状。现代研究表明血小板功能障碍是造成心血管疾病的重要因素之一,而且由于其调控机制复杂、药物的作用靶点繁多等原因,目前关于血小板功能的相关研究已经成为如何治疗心血管疾病的关键。其中,中药抗血小板的作用显著[5]。
丹红注射液是一种中药注射剂,主要由丹参、红花组成。丹参性苦、微寒,归心、肝经,具有活血祛瘀、通经止痛、清心除烦、凉血消痈的功效;红花辛、温,归心、肝经,具有活血通经、散瘀止痛的功效[6-8];二者合用,是近代医家常用的经典药对,常用于治疗“胸痹”等心血管疾病[9]。现代药理学研究表明,丹红注射液具有抗凝[10]、抗炎、抗氧化、调血脂、促血管新生的功效[11-12],但其对治疗血瘀和抗血小板功能的作用机制研究未见详细报道,本课题组前期成功建立了基于抗凝血活性的丹红注射液生物效价的测定方法,明确了丹红注射液抗凝血活性可作为其质量评价的标准[13],在此基础上,本研究通过建立急性血瘀大鼠模型,在整体上探讨丹红注射液活血化瘀作用的特点,并围绕抗凝和抗血小板功能,从分子水平上还原丹红注射液治疗血瘀及抗血小板功能的作用机制,为丹红注射液临床治疗血瘀证及心血管疾病提供科学依据。
1 材料
1.1 动物
SPF级雄性SD大鼠60只,6周龄,体质量170~200 g,由浙江维通利华实验动物技术有限公司提供,许可证号SCXK(浙)2019-0001,合格证号20211117Aazz0619000332。动物于标准化室温(22±2)℃、相对湿度(55±5)%、12 h昼夜交替的环境中适应性饲养1周,自由进食饮水。动物实验经河南中医药大学实验动物伦理审查批准(批准号DWLLGZR202202018)。
1.2 药品与试剂
丹红注射液(国药准字Z20026866,10 mL/支,批号21051006)购自山东丹红制药有限公司;舒血宁注射液(国药准字Z14021871,批号21061911,10 mL/支)购自朗致集团万荣药业有限公司;氯化钠注射液(国药准字H41023828,批号A22040405A)购自河南科伦药业有限公司;盐酸肾上腺素注射液(国药准字H31021062,批号10210406,1 mL/支)购自上海禾丰制药有限公司;戊巴比妥钠(批号TP20160910)购自国药集团化学试剂有限公司;多聚甲醛(批号CR2103050)购自武汉塞维尔生物科技有限公司;活化部分凝血活酶时间(activated partial thromboplastin time,APTT)测定试剂盒(批号STY50201-48-5)、凝血酶时间(thrombin time,TT)测定试剂盒(批号STY50301-39-4)、凝血酶原时间(prothrombin time,PT)测定试剂盒(批号STY50101-38-3)、纤维蛋白原(fibrinogen,FIB)测定试剂盒(批号STY50401-31-2)购自泰州中勤世帝生物技术有限公司;纤连蛋白(fibronectin,FN)ELISA试剂盒(批号Jul 2022)、血管性血友病因子(von Willebrand factor,vWF)ELISA试剂盒(批号Jul 2022)、6-酮-前列腺素F1α(6-keto-prostaglandin F1α,6-keto-PGF1α)ELISA试剂盒(批号Jul 2022)、血栓素B2(thromboxane B2,TXB2)ELISA试剂盒(批号Jul 2022)、β-血栓环蛋白(β-thromboglobulin,β-TG)ELISA试剂盒(批号Jul 2022)、血小板第四因子(platelet factor 4,PF4)ELISA试剂盒(批号Jul 2022)购自江苏酶免实业有限公司;山羊抗兔二抗(批号20000243)、蛋白激酶B1(protein kinase B1,Akt1)抗体(批号00107910)、细胞外信号调节激酶1/2(extracellular signal-regulated kinases1/2,ERK1/2)抗体(批号00095149);p-ERK1/2抗体(批号00106696)、p-Akt1抗体(批号00092705)、p-p38抗体(批号00105889)购自武汉三鹰生物技术有限公司;p38抗体(批号26)购自美国CST公司;β-actin抗体(批号AA0718B8088ZJ2)购自Bioworld公司。
1.3 仪器
SW-CJ型超净工作台(苏州苏洁净化设备有限公司);SC40型半自动凝血分析仪(泰州中勤世帝生物技术有限公司);SD-100型动态血沉/压积测试仪(北京赛科希德科技股份有限公司);PeriFlux System 5000型激光多普勒微循环系统(瑞典百灵威Perimed公司);BL420F型生理记录仪(成都泰盟科技有限公司);Fresco 17型高速冷冻离心机、QuantStudio 7 FleX实时荧光定量PCR仪(美国Thermo Fisher Scientific公司);ChemiDocTM MP全能型凝胶成像分析系统、PowerPac Universal电泳仪电源(美国Bio-Rad公司);LabCycler型PCR扩增仪(SensoQuest公司)。
2 方法
2.1 造模、分组及给药
动物适应性饲养7 d后,随机分为空白组、模型组、舒血宁注射液(1.8 mL/kg)组和丹红注射液高、中、低剂量(1.4、0.7、0.35 mL/kg,分别相当于临床剂量的2、1、0.5倍)[14]组,每组10只。各给药组每日9: 00时尾iv药物,空白组和模型组尾iv等体积生理盐水,1次/d,连续给药11 d后开始造模,空白组sc生理盐水,其余各组sc盐酸肾上腺素(0.8 mg/kg),2 h后将各组大鼠置于0~4 ℃冰水中游泳5 min,擦干背毛,2 h后再次sc盐酸肾上腺素(0.8 mg/kg),造模后各组禁食不禁水12 h以复制急性血瘀模型。第12天给药30 min后,ip 2%戊巴比妥钠(3 mL/kg)麻醉,观察耳廓微循环、心电图;腹主动脉取血,检测血液流变学指标、凝血功能指标,解剖后取心尖及以上1 cm组织、腹主动脉组织。
2.2 大鼠一般状态观察
实验期间,每天给予充足饲料及饮水,使各组大鼠体质量呈稳态增长,每日观察各组大鼠体质量变化。造模后对大鼠毛色、精神状态、活动情况、排便情况、进食饮水情况、边缘耳廓瘀点情况等均进行观察。
2.3 血液流变学指标测定
末次给药30 min后,大鼠ip 2%戊巴比妥钠麻醉,腹主动脉取血,肝素钠抗凝,室温静置20 min后,采用血液流变测试仪检测1/s、5/s、50/s、100/s、200/s切变率下的全血黏度。使用一次性使用负压采血管(枸橼酸钠1∶4)抗凝,动态血沉/压积测试仪测定血沉,血沉测定结束后,3000 r/min离心30 min,测定红细胞压积。
2.4 凝血功能指标测定
大鼠麻醉后,腹主动脉取血,一次性使用负压采血管(枸橼酸钠1∶9)抗凝,3500 r/min离心10 min,取上层血浆用于APTT、PT、TT、FIB的测定。
2.5 心电图测定
将麻醉后的大鼠仰卧固定于大鼠固定板上,采用生物机能实验系统,记录心电的5个电极一端与信号采集与处理系统硬件相连接,另一端夹子分别夹在穿过大鼠右前肢(红)、左前肢(黄)、右后肢(黑)、左后肢(绿)及胸部(白)皮下的针式电极上,记录标准肢体导联——II导联心电图,每只大鼠稳定后记录2 min。软件参数设置为:采样频率1 kHz,量程2 mV,放大滤波器100 Hz。
2.6 耳廓血流量监测
使用激光多普勒系统测定耳廓血流量,血流仪先进行20 min预热并用校准液进行校准,选用多普勒血流探头固定于俯卧大鼠右侧距耳廓边缘5 mm光滑平坦处双面胶固定,血流仪将采集的信号转换成灌注量单位(perfusion unit,PU),采用配套软件进行PU值曲线的输出、记录,取稳定的1 min曲线值的平均值作为其耳廓血流量值。
2.7 腹主动脉、心脏组织病理学观察
取各组大鼠腹主动脉、心脏,经过4%多聚甲醛固定、脱水透明后石蜡包埋,切片(厚1 mm)后进行苏木素-伊红(HE)染色,于显微镜下观察并拍照,利用CaseViewer软件进行分析。
2.8 血清中FN、vWF、TXB2、6-keto-PGF1α、β-TG和PF4含量测定
各组大鼠腹主动脉取血后,室温自然凝固30 min,3000 r/min离心20 min,取上层血清,按照ELISA试剂盒说明书测定FN、vWF、TXB2、6-keto-PGF1α、β-TG和PF4含量。
2.9 心肌组织Akt1、p38和ERK mRNA表达检测
取各组大鼠心肌组织,按照试剂盒说明书提取总RNA并合成cDNA,进行qRT-PCR分析。引物序列:上游引物5’-GAGCCACCAATCCA-CACAGA-3’,下游引物5’-AGACCTCTATGCCAA-CACAGT-3’;上游引物5’-CTGGAGGACAAC-GACTATGGC-3’,下游引物5’-AGCCTCTGTGTAG-GGTCCTTCTT-3’;上游引物5’-ACCTAAAGC-CCAGCAACCT-3’,下游引物5’-GTCATTTCGTC-ATCAGTGTGC-3’;上游引物5’-GGGCA-CCAACCATTGAGCA-3’,下游引物5’-CAAGAG-CTTGTAAAGGTCCGTC-3’。
2.10 心肌组织p-Akt1、Akt1、p-p38、p38、p-ERK和ERK蛋白表达检测
取各组大鼠心肌组织,剪碎后按加入裂解液裂解30 min,加入小钢珠匀浆,4 ℃、14 000×离心5 min,取上清,用BCA试剂盒进行蛋白定量,100 ℃水浴10 min使蛋白变性,于−20 ℃冰箱保存。蛋白样品经十二烷基硫酸钠-聚丙烯酰胺凝胶电泳,转至PVDF膜,室温封闭2.5 h,粪便加入β-actin抗体(1∶5000)、Akt1抗体(1∶1000)、p-Akt1抗体(1∶1000)、ERK1/2抗体(1∶500)、p-ERK1/2抗体(1∶1000)、p38抗体(1∶1000)和p-p38抗体(1∶1000),4 ℃孵育过夜;加入二抗,室温摇床孵育1 h,显影后进行Image J分析。
2.11 统计学分析

3 结果
3.1 丹红注射液对急性血瘀大鼠一般状态的影响
如表1所示,给药11 d后,各组间大鼠体质量无统计学意义。造模后大鼠出现精神不振、蜷缩不动或活动减少,反应迟钝,弓背、耸毛、皮毛无光泽,喜扎堆、畏寒喜暖、四肢发冷、寒战,爪尾部、舌部紫暗,耳廓出现瘀点紫暗(图1),饮水、进食量减少,大便湿烂、肛门污秽等证候表现,上述证候符合中医血瘀的辨证诊断。

表1 丹红注射液对急性血瘀大鼠体质量的影响(, n = 10)
3.2 丹红注射液对急性血瘀大鼠血液流变学的影响
如表2所示,与空白组比较,模型组大鼠全血黏度在1/s、5/s、50/s、100/s、200/s切变率均显著上升(<0.05、0.01);与模型组比较,丹红注射液高剂量组大鼠在1/s、5/s、50/s、100/s、200/s切变率下的全血黏度均显著降低(<0.01),丹红注射液中剂量组大鼠在200/s切变率下的全血黏度显著降低(<0.01),舒血宁注射液组大鼠在1/s、50/s、100/s、200/s切变率下的全血黏度均显著降低(<0.05、0.01)。
如表3所示,与空白组比较,模型组压积、红细胞聚集指数、卡松黏度均显著升高(<0.05、0.01);与模型组比较,丹红注射液高剂量组压积、红细胞聚集指数、卡松黏度均显著降低(<0.05、0.01),舒血宁注射液组卡松黏度显著降低(<0.05)。

箭头表示造模后耳廓形成的瘀点位置

表2 丹红注射液对急性血瘀大鼠血液流变学指标的影响(, n = 5)
与空白组比较:*<0.05**<0.01;与模型组比较:#<0.05##<0.01,下表同
*< 0.05**< 0.01blank group;#< 0.05##< 0.01model group, same as below tables

表3 丹红注射液对急性血瘀大鼠血沉、压积及血液流变转化的影响(, n = 5)
3.3 丹红注射液对急性血瘀大鼠凝血功能的影响
如表4所示,与空白组比较,模型组APTT、PT显著缩短(<0.01),FIB显著增加(<0.01);与模型组比较,丹红注射液各剂量组TT均显著延长(<0.05、0.01)。
3.4 丹红注射液对急性血瘀大鼠心电图ST段的影响
如图2所示,模型组大鼠Q波异常,损伤型ST段明显抬高,心率无改变,提示出现心肌缺血。如表5所示,与空白组比较,模型组ST段显著抬高(<0.01);与模型组比较,各给药组ST段均显著降低(<0.05、0.01)。

表4 丹红注射液对急性血瘀大鼠凝血四项指标的影响(, n = 5)

图2 丹红注射液对急性血瘀大鼠心电图的影响

表5 丹红注射液对急性血瘀大鼠心电图ST段的影响(, n = 5)
3.5 丹红注射液对急性血瘀大鼠耳廓血流量的影响
如表6所示,与空白组比较,模型组大鼠PU显著降低(<0.01),说明急性血瘀证模型大鼠可以导致耳廓局部微循环障碍;与模型组比较,各给药组PU均显著升高(<0.05、0.01),表明DHI可改善急性血瘀证微循环障碍。
3.6 丹红注射液对急性血瘀大鼠腹主动脉病理变化的影响
如图3所示,空白组大鼠动脉内、中、外膜结构完整,层次分明,弹性纤维层结构基本清晰,走向基本一致,排列较整齐;模型组大鼠主动脉各层结构松散无序,内膜出现轻微损伤,弹力纤维破坏,由于斑块脱落导致开始出现空泡;各给药组大鼠内皮结构基本完整,丹红注射液高剂量组大鼠主动脉结构松散无序,丹红注射液中剂量组大鼠主动脉结构弹力纤维被破坏,但结构基本清晰,与模型组相比损伤程度较低。

表6 丹红注射液对急性血瘀大鼠耳廓血流量的影响(, n = 5)
3.7 丹红注射液对急性血瘀大鼠心尖组织病理变化的影响
如图4所示,空白组心肌纤维结构排列整齐紧密,心肌及内膜细胞连续完整,心肌细胞染色均匀,细胞核致密,无水肿,未见炎细胞浸润;模型组可见心肌细胞排列稍乱,心肌纤维间隔增宽、肿胀、断裂,出现空泡变性,可见部分肌纤维坏死,心肌细胞加宽,细胞核增大变圆。各给药组也出现心肌纤维增宽,但较模型组均有不同程度的改善,空泡变性也有所改善,均趋于空白组。与模型组比较,各给药组表现出较好的心肌保护作用,心肌排列较整齐,空泡现象轻于模型组,舒血宁注射液组和丹红注射液高剂量组细胞核形状趋于空白组。
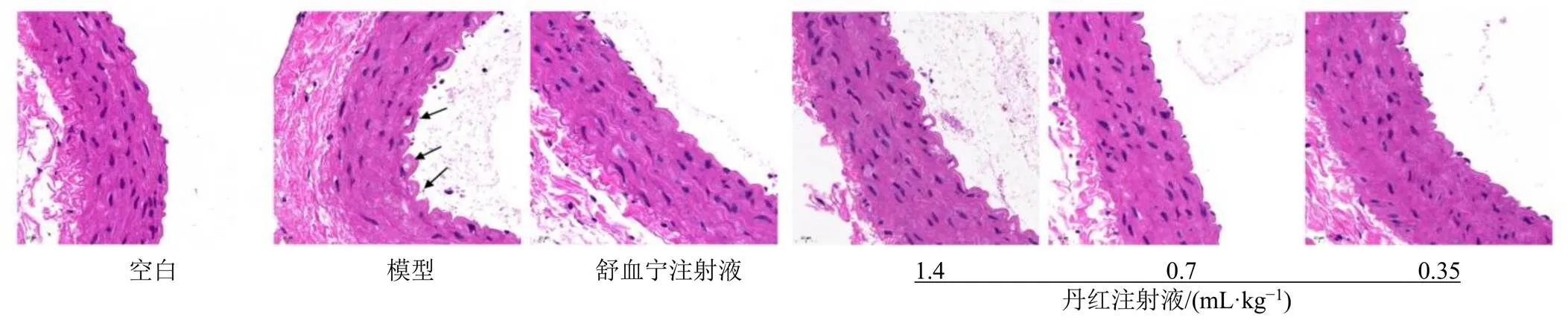
图3 丹红注射液对急性血瘀大鼠腹主动脉病理变化的影响 (HE, ×400)

图4 丹红注射液对急性血瘀大鼠心尖组织病理变化的影响(HE, ×400)
3.8 丹红注射液对急性血瘀大鼠血清中FN、vWF、TXB2、6-keto-PGF1α、β-TG和PF4含量的影响
3.8.1 血小板活化黏附相关指标 如表7所示,与空白组比较,模型组FN、vWF含量显著上升(<0.01);与模型组比较,各给药组FN、vWF含量显著下降(<0.01)。
3.8.2 血小板聚集性相关指标 如表8所示,与空白组比较,模型组TXB2含量和TXB2/6-keto-PGF1α值显著上升(<0.01),6-keto-PGF1α含量显著下降(<0.01);与模型组比较,舒血宁注射液组和丹红注射液中剂量组TXB2含量显著下降(<0.05、0.01),各给药组TXB2/6-keto-PGF1α值显著降低(<0.01),6-keto-PGF1α含量显著升高(<0.05、0.01)。

表7 丹红注射液对急性血瘀大鼠血清中FN和vWF含量的影响(, n = 6)

表8 丹红注射液对急性血瘀大鼠血清中TXB2、6-keto-PGF1α含量及TXB2/6-keto-PGF1α的影响(, n = 6)
3.8.3 血小板释放相关指标 如表9所示,与空白组比较,模型组β-TG、PF4含量显著上升(<0.01);与模型组比较,各给药组PF4含量显著降低(<0.05、0.01),舒血宁注射液组和丹红注射液高、中剂量组β-TG含量显著下降(<0.05、0.01)。
3.9 丹红注射液对急性血瘀大鼠心肌组织Akt1、p38和ERK mRNA表达的影响
如表10所示,与空白组比较,模型组心肌组织内、、的mRNA表达水平均显著上升(<0.01);与模型组比较,各给药组、、的mRNA表达水平均显著下降(<0.01)。

表9 丹红注射液对急性血瘀大鼠血清中β-TG和PF4含量的影响(, n = 6)

表10 丹红注射液对急性血瘀大鼠心肌组织Akt1、p38和ERKmRNA表达的影响(, n = 3)
3.10 丹红注射液对急性血瘀大鼠心肌组织p-Akt1/Akt1、p-p38/p38和p-ERK/ERK蛋白表达的影响
如图5和表11所示,与空白组比较,模型组心肌组织p-Akt1/Akt1、p-p38/p38、p-ERK/ERK蛋白表达水平显著上升(<0.01);与模型组比较,各给药组心肌组织p-Akt1/Akt1、p-p38/p38、p-ERK/ERK蛋白表达水平均显著下降(<0.05、0.01)。

图5 丹红注射液对急性血瘀大鼠心肌组织p-Akt1/Akt1、p-p38/p38和p-ERK/ERK蛋白表达的影响

表11 丹红注射液对急性血瘀大鼠心肌组织p-Akt1/Akt1、p-p38/p38和p-ERK/ERK蛋白表达的影响(, n = 3)
4 讨论
本研究采用注射肾上腺素模拟人体暴怒时所引起的心率加快、体温升高的状态,再结合冰水浴,在刺激神经和寒邪二者共同作用下复制寒凝血瘀的模型,可很好地印证中医对于血瘀证“寒则凝,凝则成瘀”的认识[15-17]。寒凝血瘀是导致多种疾病发生发展的病理基础,全血黏度增加、血液流动性减弱、凝血时间缩短、微循环障碍、血管损伤与血小板活化、释放和聚集等均与寒凝血瘀证相关[18]。微循环是心血管系统在组织内真正发挥功能的部位,微循环障碍会造成血液理化性质的改变,使管腔狭窄,血流减慢或血栓形成,使局部组织缺血缺氧甚至坏死,引起一系列的临床症状。微循环与血瘀证息息相关,临床上常运用活血化瘀的药物改善微循环以达到活血通络化瘀的功效[19]。
本研究结果显示,模型组大鼠的行为状态、瘀证表现、TT、耳廓微循环血流量显著减少,血液全血黏度显著上升,以上评价指标符合在1982年经中国中西医结合学会活血化瘀委员会批准的血液流变学可作为判断血瘀证和血瘀证治疗效果的依据[20],证明血瘀证大鼠模型造模成功。与模型组比较,丹红注射液组大鼠耳廓瘀点减轻,TT、全血黏度与耳廓微循环均有明显改善,可见丹红注射液有活血化瘀、通脉活络、改善微循环、降低血黏度的效果,能从整体上改善血瘀症状,该作用与阳性对照药物舒血宁注射液有所不同,舒血宁注射液虽能够改善微循环和血液流变学指标[21],对心肌和血管内皮具有一定程度的保护作用,对血小板功能具有不同程度的改善,但却无明显抗凝作用。
现代医学表明,寒凝血瘀会导致血管收缩、血管内皮损伤,其特征之一是TXA2与前列环素(prostacyclin,PGI2)的失衡,TXA2与PGI2的平衡状态可维持冠脉张力和血小板内环境稳定。正常条件下,血小板功能被PGI2等抗凝物质抑制,而在炎症条件下,vWF与其表面受体糖蛋白Ib-IX-V(platelet glycoprotein Ib-IX-V complex,GPIb-IX-V)复合物被激活,二者结合活化整合素αIIb/β3,使其与vWF或纤维蛋白原结合,促进血小板聚集、活化以及血栓的形成[22],vWF能够使血小板黏附于血管内皮细胞,发挥止血功能,还可作为判断血管内皮的损伤程度及血栓风险的重要指标[23-24],vWF与GPIb-IX-V的结合可以诱导其下游的重要信号通路磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase,PI3K)/Akt和依赖性蛋白激酶(cGMP-dependent protein kinase,PKG)/丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)分子的激活[25],即Akt和P38以及ERK的活化[26],同时PI3K/Akt和MAPK信号通路可以显著增强凝血因子释放和TXA2产生[27],若TXA2等促凝物质生成增加,PGI2等抗凝物质生成减少,进一步促进血管收缩、血小板活化、聚集、血栓形成等病理表现[28]。该病理过程刺激血小板产生大量的PF4、β-TG,出现凝血、炎症等生理反应[29],形成恶性循环。TXA2由血小板微粒体合成释放,不稳定,其水解产物为稳定的TXB2;PGI2具有较强的抑制血小板功能的作用,半衰期很短,一般检测指标为其稳定的代谢产物6-keto-PGF1α[30]。PF4是血小板活化的特异性指标,血小板活化后被大量释放,黏附于受损的血管内皮表面[31],促进炎性巨噬细胞分化,抑制血管再生[32];β-TG是血小板α颗粒内的糖蛋白,机体缺血后β-TG被释放至血小板外[33],二者能够反映血小板活性。FN可以促进细胞的黏连生长,加强血小板的黏附过程,在损伤的局部形成血小板血栓,具有保护血管内皮细胞的功能[34]。本研究中,模型组大鼠心肌细胞纤维断裂、出现空泡和凋亡现象,并且腹主动脉血管内皮出现损伤,心电图显示模型组ST段显著抬高,提示心肌缺血严重;同时,TXB2/6-keto-PGF1α值升高,PF4、β-TG、FN、vWF水平升高,vWF/GPIb-IX-V信号通路激活,其下游分子Akt1、p38、ERK水平上调,表明模型组大鼠体内有血小板聚集、活化等病理过程。给药后,丹红注射液组大鼠心肌细胞纤维排列较整齐、空泡凋亡现象减少,对腹主动脉血管内皮也有不同程度的改善,心电图恢复正常,同时,TXB2降低,6-keto-PGF1α升高,表明丹红注射液可以保护心肌和血管内皮细胞,减少心脏损伤、血管内皮损伤及炎症状态,化瘀血生新络,调节TXB2/6-keto-PGF1α的平衡关系,降低PF4、β-TG、FN、vWF水平,显著下调Akt1、p38和ERK的水平,抑制GPIb-IX-V信号通路介导的血小板活化、聚集和释放,发挥抗凝和抗血小板功能的作用,增加微循环血流量,维持血流正常状态,起到治疗血瘀证的效果。
本研究成功复制急性血瘀证大鼠模型,丹红注射液能够从整体上改善寒凝血瘀证模型大鼠中医证候,保护细胞内膜和纤维完整,并通过调控vWF/GPIb-IX-V下游信号通路相关蛋白及基因表达,降低vWF、FN、TXB2/6-keto-PGF1α、PF4和β-TG水平,从而保护心肌、改善凝血和血小板功能,达到治疗冠状动脉粥样硬化性心脏病、心绞痛、心肌缺血等临床疾病[12]的作用,为其在中医防治血瘀证及治疗心血管疾病方面提供了参考。
利益冲突 所有作者均声明不存在利益冲突
[1] 李灿东, 吴承玉. 中医诊断学 [M]. 第3版. 北京: 中国中医药出版社, 2012: 148.
[2] 张米镎, 徐霄龙, 郭玉红, 等. 微循环障碍的中医药治疗进展 [J]. 中国中医急症, 2020, 29(8): 1496-1500.
[3] 何浩强, 陈光, 高嘉良, 等. 气滞血瘀证生物学基础研究进展 [J]. 中华中医药杂志, 2019, 34(9): 4167-4171.
[4] 胡文娟, 张秉韬, 吴锐. 炎症损伤、血小板活化与血瘀证的关系 [J]. 南昌大学学报: 医学版, 2012, 52(4): 81-83, 90.
[5] 唐家杨, 苏聪平, 罗慧, 等. 血小板活化机制及调节血小板中药的研究进展 [J]. 中华中医药杂志, 2021, 36(11): 6620-6626.
[6] 唐德才. 中药学 [M]. 第3版. 北京: 人民卫生出版社, 2016: 229-230.
[7] 万新焕, 王瑜亮, 周长征, 等. 丹参化学成分及其药理作用研究进展 [J]. 中草药, 2020, 51(3): 788-798.
[8] 王梦梦, 吉兰芳, 崔树娜. 丹参功效的物质基础研究进展 [J]. 中医学报, 2019, 34(5): 944-949.
[9] 朱北星. 丹红注射液对慢性稳定性心绞痛 (血瘀证) 临床疗效的影响 [D]. 哈尔滨: 黑龙江中医药大学, 2016.
[10] 李乐春, 井晟, 孙晓, 等. 丹红注射液联合骨肽注射液对老年骨质疏松性髋部骨折术后患者凝血功能及骨代谢指标的影响 [J]. 中国老年学杂志, 2019, 39(18): 4479-4481.
[11] 李志威, 王玉, 杜海霞, 等. 丹红注射液对高脂血症大鼠脑缺血再灌注损伤的影响及其机制研究 [J]. 中国药学杂志, 2020, 55(15): 1259-1265.
[12] 李娜, 王阿红, 吴玉华. 丹红注射液联合磺达肝癸钠对肺栓塞患者免疫学指标及凝血-纤溶系统的影响[J]. 药物评价研究, 2020, 43(7): 1322-1325.
[13] 张宇航, 杨静, 吴宿慧, 等. 基于抗凝血活性的丹红注射液生物效价测定方法的建立 [J]. 中草药, 2022, 53(8): 2348-2355.
[14] 李仪奎. 中药药理实验方法学 [M]. 第2版. 上海: 上海科学技术出版社, 2006: 164-165.
[15] 郝少君, 谢国旗, 李重先, 等. 莪红片对急性血瘀证模型大鼠血液流变学及血栓形成相关指标的影响 [J]. 中国药房, 2018, 29(18): 2488-2491.
[16] 李伟霞, 黄美艳, 唐于平, 等. 大鼠急性血瘀模型造模方法的研究与评价 [J]. 中国药理学通报, 2011, 27(12): 1761-1765.
[17] 王常瞵, 丛竹凤, 刘国飞, 等. 水蛭不同炮制品对急性血瘀模型大鼠血液流变学及凝血指标的影响 [J]. 中国药房, 2020, 31(16): 1984-1988.
[18] 褚剑锋. 寒凝血瘀成因及病理 [J]. 中国中西医结合杂志, 2022, 42(6): 669-671.
[19] 李雍, 秦勇, 刘伟, 等. 玫瑰枸杞发酵饮品对大鼠耳廓微循环的改善作用 [J]. 中国食品学报, 2021, 21(6): 138-143.
[20] 王阶, 姚魁武. 血瘀证诊断标准研究述要及思考 [J]. 中国中医药信息杂志, 2004, 11(1): 17-19.
[21] 郭玉东, 王志斌, 左泽平, 等. 舒血宁注射液对急性血瘀模型大鼠血液流变学及血栓形成的影响 [J]. 中药药理与临床, 2012, 28(2): 157-159.
[22] 章凡, 王哲, 胡琨, 等. 血小板在炎症中的作用: 促血栓形成与免疫功能 [J]. 中国临床药理学杂志, 2022, 38(17): 2089-2093.
[23] 司雨, 李乐, 陈小玲, 等. 西洋参总皂苷对急性血瘀模型大鼠的作用研究 [J]. 中南药学, 2021, 19(5): 851-856.
[24] 黄欣欣, 应燕萍, 蒋庆娟, 等. 抗阻运动对大鼠血清vWF含量及导管相关性血栓形成的实验研究 [J]. 循证护理, 2022, 8(3): 317-321.
[25] Fan X, Chen X, Wang C,. Drospirenone enhances GPIb-IX-V-mediated platelet activation [J]., 2015, 13(10): 1918-1924.
[26] 方金花. 流场下vWF-A活化机制及vWF-A1介导的血小板P-选择素原位表达 [D]. 广州: 华南理工大学, 2021.
[27] Nam G S, Nam K S. Arctigenin attenuates platelet activation and clot retraction by regulation of thromboxane A2synthesis and cAMP pathway [J]., 2020, 130: 110535.
[28] 王朋, 杨明会, 李绍旦, 等. 冠心病心绞痛寒凝血瘀证动物模型的建立 [J]. 中国中医基础医学杂志, 2014, 20(3): 309-311.
[29] 王红丽, 汪晶晶. 血浆β-TG、PF4和外周血S-100B蛋白在急性脑梗死患者中的表达及临床意义 [J]. 保健医学研究与实践, 2021, 18(6): 93-99.
[30] 李娴, 张丽, 丁安伟. 丹皮炭对大鼠血小板功能和纤溶活性的影响 [J]. 中草药, 2010, 41(2): 264-266.
[31] Kasper B, Winoto-Morbach S, Mittelstädt J,. CXCL4-induced monocyte survival, cytokine expression, and oxygen radical formation is regulated by sphingosine kinase 1 [J]., 2010, 40(4): 1162-1173.
[32] Aidoudi S, Bikfalvi A. Interaction of PF4 (CXCL4) with the vasculature: A role in atherosclerosis and angiogenesis [J]., 2010, 104(5): 941-948.
[33] Smyth S S, Monroe D M, Wysokinski W E,. Platelet activation and its patient-specific consequences [J]., 2008, 122(4): 435-441.
[34] 牛雯颖, 袁茵, 邓思瑶, 等. 补阳还五汤对气虚血瘀模型大鼠血小板生物学指标的影响 [J]. 中华中医药杂志, 2019, 34(7): 3261-3265.
Effect and mechanism of Danhong Injection on promoting blood circulation and removing blood stasis in rats with acute blood stasis based on vWF/GPIb-IX-V signal pathway
LIU Xu1, WU Su-hui1, CHEN Xiao-fei2, ZHANG Yu-hang1, LI Han-bing1, TANG Jin-fa2
1. Henan Provincial Key Laboratory of “Prevention of Disease” Health of Traditional Chinese Medicine, Henan University of Chinese Medicine, Zhengzhou 450046, China 2. Henan Province Engineering Research Center for Clinical Application, Evaluation and Transformation of Traditional Chinese Medicine, The First Affiliated Hospital of Henan University of Chinese Medicine, Zhengzhou 450000, China
To observe the effect of Danhong Injection (丹红注射液) on acute blood stasis rats model, and explore the mechanism of Danhong Injection on regulating platelet function of blood stasis syndrome.A total of 60 SD rats were randomly divided into blank group, model group, Shuxuening Injection (舒血宁注射液, 1.8 mL/kg) group and Danhong Injection high-, medium- and low-dose (1.4, 0.7, 0.35 mL/kg) groups. After 11 d of drug intervention, rat model of acute blood stasis syndrome was prepared with sc adrenaline combined with ice water bath. After 1 d of drug intervention, hemorheology index, coagulation function index, platelet activation, adhesion, aggregation and release related indexes were measured; The auricle microcirculation, ECG and histopathological changes of cardiac apex and abdominal aorta were observed; The expressions of protein kinase B1 (Akt1), p38 and extracellular signal-regulated kinase 1/2 (ERK1/2) in myocardium was detected by qRT-PCR and Western blotting.Compared with blank group, hemorheology, von Willebrand factor (vWF), fibronectin (FN), thromboxane B2(TXB2), β- thrombocyclin (β-TG), platelet factor 4 (PF4) were significantly increased in model group (< 0.05, 0.01), 6-keto-prostaglandin F1α (6-keto-PGF1α) and auricle microcirculation blood flow were significantly decreased (< 0.01), p-AKT1, p-ERK1/2 and p-p38 protein expressions and,, andgene expressions in myocardial tissue were significantly increased (< 0.01). Compared with model group, Danhong Injection decreased the hemorheological indexes, vWF, FN, TXB2, β-TG, PF4 in different degrees (< 0.05, 0.01), increased 6-keto-PGF1α and thrombin time (TT) (< 0.05, 0.01), protected heart, increased auricle microcirculation blood flow (< 0.05). HE staining results of cardiac apex and abdominal aorta showed that myocardial and vascular intima of rats in model group were slightly damaged, elastic fibers were damaged, and vacuoles began to appear due to the plaque shedding; The myocardial, vascular intima, endothelial cells and elastic fibers of rats in Danhong Injection group were significantly improved.Danhong Injection can restore hemorheology and coagulation function, improve the function of vascular endothelial cells and cardiac myocytes, and has better protective and therapeutic effects on acute blood stasis in rats by regulating platelet function mediated by vWF/GPIb-IX-V signal pathway.
Danhong Injection; acute blood stasis; cardiovascular disease; platelet function; von Willebrand factor; platelet glycoprotein Ib-IX-V complex
R285.5
A
0253 - 2670(2023)04 - 1173 - 11
10.7501/j.issn.0253-2670.2023.04.017
2022-09-29
河南省中医药科学研究专项(20-21ZY1001);河南省高校科技创新团队(23IRTSTHN026)
刘 旭,女,硕士研究生,研究方向为中药药理实验技术。E-mail: 2695350081@qq.com
李寒冰,男,博士生导师,教授,主要从事中药学研究。E-mail: lhb8899@163.com
唐进法,男,主任药师,研究方向为中药质量评价及合理应用。E-mail: a0519@163.com
[责任编辑 李亚楠]

