子宫内膜异位症相关性卵巢癌研究进展
陈 宇,陈 倩,郝春燕,王立杰,杨兴升
(山东大学齐鲁医院妇产科,济南 250012)
子宫内膜异位症(endometriosis,EMs)是一种常见的、严重威胁女性生命质量及生育功能的疾病。据统计,EMs在育龄期女性中的发病率约为10%~15%,在合并盆腔疼痛或不孕女性中的发病率可达20%~60%[1]。EMs被认为是良性疾病,但其具有类似恶性肿瘤的特征,如侵袭、黏附、转移等,且与卵巢透明细胞癌(ovarian clear cell carcinoma,OCCC)及卵巢子宫内膜样癌(ovarian endometrioid carcinoma,OEC)密切相关[2]。在临床实践中已将EMs视作相关恶性肿瘤的癌前病变。本综述拟通过对子宫内膜异位症相关性卵巢癌(endometriosis associated ovarian cancer,EAOC)的临床特点、发病机制、分子遗传学相关研究进展进行回顾,旨在进一步明确EMs恶变的高危因素及早期生物学标志物,以指导临床实践中对EMs恶变易感人群的筛查、密切随访及早期诊断,同时对后续基础研究及临床转化方向进行展望,以期通过EMs实现卵巢癌患者的分层管理及个性化治疗。
1 EAOC的流行病学特点
EMs和卵巢癌在流行病学方面有高度的相关性。Pearce等[2]综合13项病例对照研究分析发现,EMs患者罹患OCCC和OEC的风险分别是普通女性的3.05倍和2.04倍,卵巢癌患者中EMs病史比例是对照组的1.5倍。研究显示,即使绝经及临床症状消失后,EMs恶变风险仍然存在[3];此外,EMs病史超过10年、EMs合并不孕的患者罹患卵巢癌风险进一步增加,分别是普通女性的2.51倍和无内异症原发性不孕女性的2.72倍[4]。故临床及病理医生在实践中应提高对EMs恶变的认知及警惕,以实现其诊断及治疗的关口前移。
2 EAOC的临床特征
EAOC患者更年轻,有更多手术机会,肿瘤FIGO期别更早,级别更低[5],肿瘤往往表现出更加惰性的临床行为,即侵袭性小且生长缓慢,并常与相应的癌前病变共存,这与卵巢癌二元论模型中I型卵巢癌的特点相一致。一项队列研究[5]显示,EAOC患者总生存期更长,其预后均显著改善,即便在调整了混杂因素后也是如此。这可能与EMs患者及时就诊、具有更为活跃的免疫系统以及口服避孕药治疗有关,也不能除外EAOC本身即是一种特殊类型的、具有更好预后特征的卵巢癌。未来对卵巢癌治疗和预后的研究应考虑根据是否合并EMs对其进行分层,以阐明EMs在卵巢癌的发生、发展及转归中的作用。
3 非典型子宫内膜异位症与EAOC
非典型子宫内膜异位症(atypical endometriosis,aEM)在病理学上可分为细胞学异型性和结构性异型性(即增生)。流行病学发现,12%~35%的卵巢子宫内膜异位囊肿中可见aEM;出现aEM时,超过2/3进展为EAOC[6]。EM-aEM-EAOC在组织空间上的直接过渡[7]以及EAOC与其邻近aEM的共同分子遗传学改变均表明aEM是EMs恶变的重要中间环节及重要证据,被视作EAOC的癌前病变(图1)。
细胞学异型性与增生的临床意义不同。细胞学异型性可能是对炎症的反应性改变,而增生代表了EMs恶变中更重要的风险因素[8],后者更多见于卵巢癌患者,与预后不良相关。目前尚未发现能应用于临床实践中以证明aEM存在的可靠的生物学标志物,故aEM可作为EAOC进一步研究的突破点,通过筛选出其中有意义的分子遗传学标志物以证明其存在,并为预测EMs恶变风险以及识别、管理高危人群提供理论基础。
4 EAOC分子遗传学机制
4.1 铁相关氧化应激 经血逆流及EMs病灶的周期性出血往往导致EMs患者的盆腹腔及病灶中铁过载。铁通过影响癌症代谢、基因组稳定性和肿瘤微环境与癌症发病机制相关[9]。铁及其代谢产物通过Fenton反应等可产生大量的活性氧簇,同时体内的抗氧化防御系统也被激活,进而有学者提出了氧化应激的“两步学说”[10](图2)。同时铁相关氧化应激导致腹膜间皮的破坏,从而有利于异位内膜及肿瘤细胞的黏附与转移,故将氧化应激视作EAOC发生过程中的一把“双刃剑”。
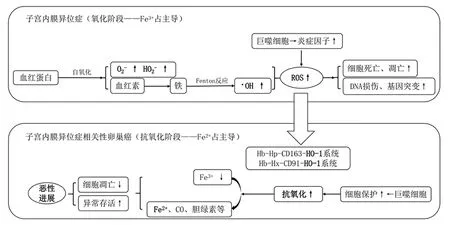
图2 EMs恶变——铁相关氧化应激
血红素氧合酶-1(heme oxygenase-1,OH-1)由血红素诱导,主要在巨噬细胞中表达。研究发现,EM与EAOC-OCCC病灶的巨噬细胞中OH-1及其他促炎因子表达增加。实验证实,巨噬细胞中OH-1缺乏可抑制卵巢癌细胞生长,而低剂量外源性血红素可促进卵巢癌细胞系的生长。故EM及EAOC中血红素代谢的紊乱可能是促进肿瘤发生发展的重要因素[11]。此外,与铁稳态作为癌细胞的一种标志相反,铁死亡在抑制肿瘤进展中起着关键作用,而特异性靶向癌症干细胞(cancer stem cells,CSC)对铁死亡表现出非常高的敏感性,尤其在耐药肿瘤中,这为探索CSC治疗EAOC提供了新思路[9]。未来可进一步探索反映氧化应激水平的指标以评估EMs患者手术指征及预测其恶变风险,并针对EMs恶变过程中氧化失衡环节开辟出更有效的治疗方法。
4.2 激素及其受体 EMs是一种激素相关性疾病,主要表现为雌激素依赖及孕激素抵抗,雌激素水平过高及孕激素相对不足会增加EAOC的风险。高雌激素可促进EMs病灶中细胞增殖、积累DNA损伤及致癌改变;并可增强子宫内膜上皮细胞的迁移和侵袭能力,从而起促癌作用。同时,EMs病灶在mRNA及蛋白水平缺乏孕激素受体B(progesterone receptor B,PR-B)表达,而雌激素受体-β(estrogen receptor-β,ER-β)过度表达,这在EMs的激素失调及恶性转化中起核心作用[7](图3),使EMs病灶的微环境更利于基因突变。
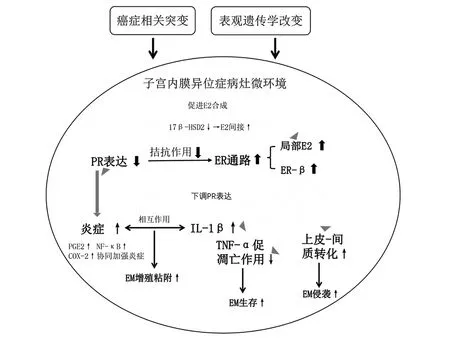
图3 EMs及其恶变过程中激素与炎症信号转导分子变化
通过激素的不同致癌及促癌环节,针对性地选择相应干预靶点将有助于治疗EMs及预防其恶变新药物的开发,如针对ER-β,以减少目前激素治疗的副作用并提高其疗效。
4.3 免疫应答与炎症反应 慢性炎症及免疫失调是EMs重要的微环境和病理生理特点。免疫细胞可释放各种细胞因子及炎症介质,在促进EMs病灶的存活、生长、侵袭、分化、血管生成和免疫逃逸等方面起着重要的作用。肿瘤相关炎症可通过招募免疫细胞、表达促进肿瘤的趋化因子和细胞因子以及诱导血管生成,显著促进肿瘤生长和癌细胞存活;同时诱导抑制针对肿瘤的免疫反应,降低肿瘤的免疫监视作用。EMs病灶中可见肿瘤样炎性特征。研究显示,半乳糖凝集蛋白(galectins)是炎症的重要调节剂,也是各种炎症性疾病和相关肿瘤发生的研究靶标,galectins-1、-3和-9在EMs患者在位和异位子宫内膜中过度表达,galectin-3与KRAS蛋白相互作用,有助于EMs病灶中的细胞生长、增殖、炎症以及EMs的维持和传播,同时半乳糖凝集蛋白与EAOC发生发展密切相关,并在EAOC中表达上调,这使其成为EMs及EAOC诊断的生物学标志物及抗癌治疗的潜在靶标[12]。
生物治疗及免疫治疗是EAOC未来研究的新方向,许多免疫生物学标志物及炎症调节因子可能成为逆转EMs恶变的新靶点,有望改善晚期透明细胞癌化疗耐药和预后不良的治疗现状。
4.4 基因突变
4.4.1 ARID1A ARID1A是经典的抑癌基因,也是EAOC中最常见的分子遗传学改变。研究发现[13],ARID1A缺失会导致染色质可及性增加并促进超级增强子的RNA转录及过度激活,从而增强侵袭性。在ARID1A缺失所过度激活的增强子中,SERPINE1(PAI-1)被确定为驱动ARID1A突变子宫内膜侵袭的重要靶基因,可考虑将其作为EAOC精准治疗的靶点。然而ARID1A基因突变后的具体致癌机制尚不清楚,同时仅肿瘤驱动基因突变不足以导致恶性转化,故进一步明确染色质中受ARID1A失活影响并改变其表达的下游基因以及肿瘤驱动基因以外的协同致癌机制是该领域的研究重点。
4.4.2 PIK3CA和KRAS PIK3CA基因的体细胞突变和扩增是EAOC中常见的分子遗传学改变,也是EAOC的潜在治疗靶点。目前针对PI3K-Akt-mTOR途径的抑制剂开展了多项临床试验,虽尚未被用作标准治疗,但有希望成为一种有效的靶向治疗方案。KRAS基因突变被视作EAOC进展中的晚期事件,其活性增加可能有助于异位内膜的存活和对孕激素治疗诱导细胞凋亡的抵抗[7]。一项体外实验[14]发现,EMs病灶中发生PIK3CA或KRAS突变可通过上调赖氨酰氧化酶(lysyl oxidase,LOX)和五聚素3(pentraxin3,PTX3)表达以显著增强细胞迁移、侵袭和增殖的能力,而siRNA敲除这两个基因后可显著降低其转移能力。因此,使用小分子沉默LOX和PTX3是治疗严重或恶变高危EMs的可选择方案。
5 EAOC早期诊断及生物学标志物
5.1 microRNA microRNA(miRNA)可降解mRNA或干扰其翻译来参与转录后基因表达调控,EMs与EAOC中差异表达的miRNA及其靶标的多态性或与其发病机制相关。EM、OEC的miRNA差异性表达分析显示[15],miR-99b和miR-125a对EMs的诊断价值最高,miR-143对OEC的诊断价值最高,可作为相应疾病的良好预测因子及潜在生物学标志物。通过对体液标本进行miRNA分析显示[16],miR-486-5p在EAOC患者血清和腹水中的表达水平显著升高,且与EMs的严重程度密切相关;miR-486-5p上调及下调可显著增加及降低卵巢子宫内膜异位囊肿细胞的增殖和迁移能力,故可能在EAOC发展过程中起致癌作用,并可作为预测卵巢子宫内膜异位囊肿严重程度及其恶变风险的非侵入性生物标志物。生信分析显示,miR-141的上调、miR-205和miR-125b的下调是导致EMs恶变的遗传起源,在其中起着核心作用[17]。然而由于相关研究的不可重复性,很难绘制EMs中一致的miRNA表达图谱[7],未来研究需采用统一、标准的方法以明确miRNA作为EAOC早期诊断、预后预测的生物学标志物的价值并进行临床转化及应用。
5.2 血液相关生物学标志物 血管内皮生长因子(vascular endothelial growth factor,VEGF)在EMs患者中表达明显升高,而与EMs相比,OCCC及OEC中VEGF水平进一步升高[18],并在超过90%的OCCC中表达。VEGF作为miR-199a-5p的直接和功能性靶标,其下调可减少异位内膜的增殖、运动和血管生成[19],故VEGF或可作为EMs的诊断标志物和新的治疗靶点。
研究显示,血浆肿瘤抗原125(CA125)在识别早期EAOC的敏感性较差,而人附睾蛋白4(HE4)及肿瘤抗原724(CA724)在鉴别EAOC中特异性更高[20]。此外,白细胞、中性粒细胞计数及HE4联合诊断EMs恶变具有较高的灵敏度及较好的效能,故具有一定的临床应用价值[21]。
血液相关生物学标志物具有标本易于获得且创伤小、检测经济便携等特点,有更大的临床应用空间,但由于不同研究间异质性较大,尚无统一结论,需进一步开展大样本研究以明确其中灵敏且特异的指标。
5.3 相关基因及表达产物 对EMs恶变高危患者进行肿瘤驱动基因或其表达产物的检测,可进一步评估其恶变风险。如肝细胞核因子-1β作为一种转录因子,是OCCC的特异性分子标志物,也可用作OCCC分子靶向治疗[22],其过表达与ER表达缺失的同时发生率在aEM中可达23.1%,在OCCC中可达42.3%[23],故可将二者作为联合指标用于EMs恶变为OCCC的风险预测及早期诊断。研究显示,TSPAN1基因可通过触发AMP活化蛋白激酶活性以促进细胞增殖及EMs进展,其mRNA水平在aEM中较EMs增加了2.4~3.4倍,在OCCC中显著增加了80.7~101倍,其蛋白水平同样过表达。因此,TSPAN1可成为EMs恶变高危患者筛查的生物学标志物[24]。此外,RNA结合蛋白Lin28及高迁移率蛋白A2在EAOC中的表达水平显著高于卵巢子宫内膜异位囊肿,与肿瘤的恶性程度及复发率呈正相关,且是EAOC的独立预后因素[25],故两者可作为预测EMs恶变及EAOC复发风险的生物学标志物。
6 目前研究的局限性及展望
EAOC相对罕见,致不同研究间纳入标准不统一且偏倚较大。由于缺乏非子宫内膜异位症相关性卵巢癌的诊断标准,即使病理未见EMs病灶,也不能完全除外是EAOC癌灶浸润、破坏所致。临床及病理医生均应提高对EAOC的认知;此外,应利用下一代测序及全转录组测序等作为个性化诊疗方法识别并确定EMs恶变的驱动突变、候选基因,进行EAOC发病机制及分子遗传学的研究,明确EMs恶变早期诊断的生物学标志物,并进一步建立EMs恶变危险分层及完善卵巢癌分子分型标准,从而实现EAOC的易感人群筛查、风险预测、更合理的临床决策以及患者的分层管理、个性化及靶向治疗。

