miR21-5p靶向转录激活蛋白STAT3减轻高氧性急性肺损伤
周先贵 蒋艳 韩梅 郑杰 覃松
遵义医科大学附属医院1急诊科,2心外科,4重症医学科(贵州遵义 563000);3遵义医科大学临床医学院(贵州遵义 563006)
长时间吸入> 60%浓度的氧气或氧分压>450 mmHg 会导致高氧性急性肺损伤(hyperoxia-induced acute lung injury,HALI),可增加危重患者死亡率,与不良预后密切相关[1]。有研究[2]表明,活性氧簇(reactive oxygen species,ROS)促进了HALI的发生发展。ROS 蓄积可破坏氧化还原平衡损伤肺组织细胞,并促进炎症因子如肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、白介素-1β(IL-1β)和白介素-6(IL-6)等在肺组织中大量募集,造成肺组织细胞凋亡坏死,最终导致急性呼吸窘迫综合征(ARDS)的发生[3]。转录激活蛋白STAT3在调节细胞凋亡、氧化应激及炎症级联反应中的作用不可或缺[4]。部分研究证实,ROS 与STAT3 磷酸化的动态平衡对维持细胞内环境稳定极其重要[5]。此外,STAT3 的过度活化可能造成组织细胞损伤,抑制STAT3 的过度活化可改善血管内皮通透性减轻脂多糖诱导的肺损伤[6-7]。微小RNA21-5p(miR21-5p)参与多种肺部疾病的产生和发展,并被确定为生物标志物或治疗靶点[8]。课题组前期研究发现,抑制STAT3 过度活化可减轻HALI,同时miR21-5p 与STAT3 呈负相关[9]。通过检索miRbase 数据库发现,miR21-5p 可与STAT3 的三处结合位点结合。目前研究表明,STAT3 可促进miR21-5p表达,同时miR21-5p可负反馈调节STAT3表达水平[10-11]。但是关于miR21-5p 与STAT3 在HALI 中的调控作用尚不清楚。因此,本实验拟通过构建HALI 动物模型验证miR21-5p 是否负向调控STAT3 活化抑制凋亡以减轻HALI,以期阐明miR21-5p 与STAT3 在HALI 中的保护作用。
1 材料与方法
1.1 动物 选用8 周龄C57BL/6J 小鼠40 只,雌雄各半,体质量(21~25)g,采购于遵义医科大学实验动物中心,动物合格证号:(SYXK(黔)2021-0004)。各组小鼠分笼饲养于环境温度(20 ± 2)℃、相对湿度(55 ± 5)%的环境中,通风换气12 ~ 18 次/h,昼夜循环照明,给予标准小鼠饲料并自由饮用酸化水(pH:2.5~3.0)适应性饲养一周后进行相关实验。本实验经过遵义医科大学伦理委员会批准(审批号:ZMU21-2202-098),相关操作符合美国《实验动物饲养管理和试用手册》第八版要求。
1.2 主要药物、试剂及仪器 超氧化物歧化酶(superoxide dismutase,SOD)、丙二醛(Malondialdehyde,MDA)、RIPA 裂解液及BCA 蛋白浓度定量试剂盒,DCFH-DA 活性氧ROS 荧光探针和苏木素伊红(HE)染色试剂盒(北京索莱宝生物科技有限公司);TNF-α、IL-1β 及IL-6 酶联免疫吸附试验(enzyme linked immunosorbent assays,ELISA)检测试剂盒(上海江莱生物科技有限公司);STAT3、p-STAT3、B 淋巴细胞瘤-2 基因(B-cell lymphoma-2,Bcl-2)、Bcl-2 相关X 蛋白(Bax)和GAPDH 一抗及辣根过氧化物酶标记的二抗(美国Cell Signaling Technology 公司);Trizol 试剂、miRNA 第一链cDNA合成试剂盒、miRNA 荧光定量PCR 试剂盒及miR21-5p 和U6 PCR 引物设计合成(上海生工生物工程股份有限公司);miR21-5p 腺相关病毒-6(AAV-6)过表达载体及空载体(汉恒生物科技有限公司)。
1.3 动物分组、给药及HALI 模型的建立 40 只C57BL/6J 随机分为常氧组、高氧组、高氧+miR21-5p 组及高氧+空载体组。常氧组饲养于正常空气中,高氧+miR21-5p组和高氧+空载体组分别经气管导管滴入50 μL滴度为(1×1012TU/mL)的miR21-5p-AAV6 或空载体,每组分笼饲养3 周后,参照刘国跃[12]的方法建立HALI 模型:将实验用C57BL/6J小鼠饲养于55 cm×40 cm×35 cm 的密闭有机玻璃容器自制高氧箱中,右侧开孔接单向阀控制的氧气接头;左侧开孔接氧浓度和二氧化碳浓度检测仪。箱底放置钠石灰吸收CO2,维持其CO2浓度< 0.5%;每天持续给氧23.5 h,维持氧浓度90%以上。定时开舱0.5 h 以添加食物、水并更换小鼠垫料。建模48 h,2%戊巴比妥纳以45 mg/kg 腹腔注射麻醉小鼠后处死小鼠取肺组织行相关实验,取肺组织行RT-PCR 检测miR21-5p 表达水平验证转染成功。
1.4 双荧光素酶报告实验 将含有miR21-5p 结合位点的野生型(WT)或含有miR1-5p 结合位点突变序列的突变型(MUT)的3'UTR-STAT3 分别插入psiCHECK2 载体。利用Lipofectamine 2000 试剂将WT/MUT-STAT3 分别与miR21-5p mimics 或miRNC 转染到HEK293T 细胞,转染48h 使用双荧光素酶报告基因检测系统检测HEK293T 细胞荧光素酶活性(以海肾荧光素酶活性与萤光虫荧光素酶活性的比值表示)。
1.5 炎症因子及氧化还原标记物检测 取小鼠肺组织称重50 mg,剪碎后研磨成匀浆,4 ℃4 000 r/min离心10 min,吸取上清液,按照各试剂盒试剂盒说明书操作手册检测肺组织炎症因子和氧化还原标志物。采用双抗夹心法检测炎症因子:TNF-α、IL-1β 及IL-6。氧化还原标志物包括MDA、SOD 和ROS。使用黄嘌呤氧化酶法测定SOD 含量,硫代巴比妥酸反应法测定MDA 含量,荧光探针DCFH-DA法检测ROS 水平。
1.6 肺水含量测定 取小鼠肺组织用滤纸吸干水分后称重,记为肺组织湿质量(W 湿),经过60 ℃烤箱烘烤60 h 后称重,记为肺组织干质量(D 干),肺组织含水量=(W湿-D干)/W 湿×100%。
1.7 肺组织病理学观察及肺损伤病理评分 取小鼠肺组织使用10%福尔马林溶液固定24 h,按照HE 染色试剂盒操作水明书进行HE 染色后,在倒置显微镜下观察肺组织形态学改变并拍照,并在400倍视野下随机选取至少20个视野,采用Matute-Bello[13]的方法进行标准化肺损伤病理评分。
1.8 Tunel 法检测肺组织细胞凋亡 取小鼠肺组织10%福尔马林溶液固定24 h 制作石蜡切片,60 ℃烘箱烘烤15 min 脱蜡;二甲苯脱蜡2×5 min,乙醇(依次100% 2 × 2 min、95% 2 × 1 min、85%1 ×1 min、75% 1 × 1 min)、蒸馏水2 min 水化;加入蛋白酶K 溶液100 μL,37 ℃通透30 min;PBS 洗3 ×5 min;滴加配置好的Tunel 染液100 μL,含DAPI抗荧光淬灭剂封片,拍照。
1.9 小鼠肺组织miR21-5p表达检测 取小鼠肺组织,加入Trizol 裂解液,使用组织细胞破碎仪裂解组织,提取RNA,酶标仪测定总RNA 浓度及纯度。使用miRNA 第一链cDNA 合成试剂盒(加尾法)将总RNA 逆转录为cDNA,进行定量PCR 扩增。采用SYBR GreenI 染料法对microRNA 进行荧光定量检测:反应体系为20 μL:2×miRNA qPCR master mix 10 μL;前后引物各1 μL;Template DNA(miR21-5p)2 μL;ROX Referense Dye(L)/(H),1 μL;加入RNase-free water 至20 μL。PCR 反应条件为:预变性:95 ℃30 s;变性:95 ℃5 s;退火/延伸:60 ℃30 s;共40 个循环。引物序列为:miR21-5p,正向5'-CCGGCTAGCTTATCAGACTGATGTTGA-3'和反向5'-CTCAACTGGTGTCGTGGA-3';U6,正向5'-CTCGCTTCGGCAGCACA-3'和反向5'-AACGCTTCACGAATTTGCGT-3';采用相对定量法检测RNA扩增,以U6 作内参,采用2-ΔΔCt法计算miR21-5p 表达量。
1.10 Western blot 肺组织STAT3、p-STAT3、Bax及Bcl-2 蛋白表达取小鼠肺组织称重,加入RIPA裂解液、蛋白酶和磷酸酶抑制剂,使用组织细胞破碎仪裂解组织,4 ℃12 000 r/min 离心15 min,取上清液使用BCA 法进行蛋白定量后分装,-80 ℃冻存备用。用10%或12%SDS-PAGE 凝胶分离蛋白,转膜后使用5%脱脂奶粉封闭2 h,分别加入STAT3、p-STAT3、Bax、Bcl-2及GAPDH 一抗,4 ℃孵育16 h;PBST 溶液洗膜3 次(5 min/次),加入IgG-HRP 后室温避光孵育1 h,PBST 洗膜溶液3 次(5 min/次),加入ECL 发光液后使用Gel DocTMEZ 全自动凝胶成像系统曝光、拍照。使用Image J 软件进行条带灰度值分析。以GAPDH 为内参照,计算目标蛋白STAT3、p-STAT3、Bax 及Bcl-2 的相对表达量。
1.11 统计学方法 采用IBM SPSS 24.0 统计软件进行数据分析,计量资料以均数±标准差表示,多组比较采用方差分析,两两比较采用LSD-t检验,P<0.05 为差异有统计学意义。
2 结果
2.1 miR21-5p 靶向STAT3 通过在线预测网站Starbase(http://starbase.sysu.edu.cn)预测到miR21-5p 与STAT3 之间存在靶向结合位点(图1)。与miR-NC 组相比,miR21-5p 组WT-STAT3 的293T 细胞荧光活性显著降低,与anti-miR-NC 组相比,antimiR21-5p 组DEFA3 WT 的293T 细胞荧光活性显著升高,见表1。
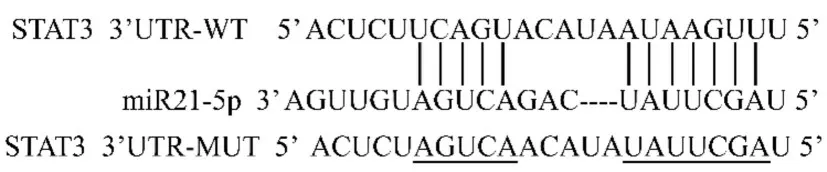
图1 miR21-5p 直接调控STAT3 表达Fig.1 miR21-5p directly regulates expression of STAT3
表1 miR21-5p 结合STAT3Tab.1 miR21-5p binding to STAT3±s

表1 miR21-5p 结合STAT3Tab.1 miR21-5p binding to STAT3±s
组别miR-NC miR21-5p anti-miR-NC anti-miR21-5p F 值P 值荧光活性STAT3 WT 1.06±0.07 0.42±0.06①0.98±0.07 1.87±0.04②615.1<0.001 STAT3 MUT 1.04±0.06 1.00±0.06 0.97±0.07 0.98±0.08 1.179 0.342 8
2.2 miR21-5p对HALI小鼠肺组织形态学、肺组织W湿/D干重比值及肺损伤病理评分的影响 如图2 和表2 所示:常氧组HE 染色见肺泡结构清晰,肺泡壁光滑,偶有中性粒细胞浸润;高氧暴露48 h可见肺泡结构紊乱、间隔增厚,大量炎症细胞浸润,透明膜形成及肺泡萎陷,与常氧组比较,高氧组肺损伤病理评分及肺组织W湿/D干重比值升高(P<0.05);miR21-5p 过表达预处理后,HE 染色可见肺泡结构紊乱不明显,肺间质增厚及炎症细胞浸润程度较高氧组明显减轻,与高氧组比较,高氧+miR21-5p组肺损伤病理评分及肺组织W湿/D干重比值下降(P<0.05)。
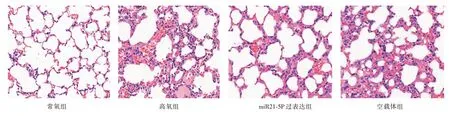
图2 各组小鼠肺组织HE 染色情况(×400)Fig.2 HE staining of lung tissue of mice in each group(×400)
表2 各组小鼠肺组织W 湿/D 干重比值、肺损伤病理评分和miR21-5p 表达的比较Tab.2 Comparison of Wwet/Ddry weight ratio,lung injury pathological score and miR21-5p expression in lung tissue of mice in each group ±s

表2 各组小鼠肺组织W 湿/D 干重比值、肺损伤病理评分和miR21-5p 表达的比较Tab.2 Comparison of Wwet/Ddry weight ratio,lung injury pathological score and miR21-5p expression in lung tissue of mice in each group ±s
注:①与常氧组比较,P<0.05;②与高氧组比较,P<0.05;③与高氧+miR21-5p 组比较,P<0.05
组别常氧组高氧组高氧+miR21-5p 组高氧+空载体组F 值P 值肺W 湿/D 干重比值3.57±0.60 5.65±0.35①4.56±0.33①②5.66±0.33①③34.67<0.001肺损伤病理评分(分)0.10±0.03 0.84±0.04①0.44±0.04①②0.84±0.03①③654.8<0.001 miR21-5p(2-△△Ct)1.00±0.09 0.35±0.04①3.13±0.26①②0.34±0.04①③548.5<0.001
2.3 miR21-5p 对HALI 小鼠肺组织SOD、MDA 及ROS 的影响 如表3 所示,高氧暴露48 h 后各组小鼠肺组织SOD、MDA 及ROS 表达水平比较,差异有统计学意义(P<0.05);与常氧组比较,高氧组、高氧+miR21-5p 组及高氧+空载体组MDA 及ROS水平升高(P< 0.05),SOD 水平降低(P< 0.05);与高氧组比较,高氧+miR21-5p 组ROS 及MDA 水平降低(P<0.05),SOD 水平升高(P<0.05);与高氧+miR21-5p 组比较,高氧+空载体组ROS 及MDA 水平较高氧+miR21-5p 组升高(P< 0.05),SOD 水平降低(P<0.05)。
表3 各组小鼠肺组织SOD、MDA 和ROS 表达的比较Tab.3 Comparison of SOD,MDA and ROS expression in lung tissue of mice in each group ±s

表3 各组小鼠肺组织SOD、MDA 和ROS 表达的比较Tab.3 Comparison of SOD,MDA and ROS expression in lung tissue of mice in each group ±s
注:①与常氧组比较,P < 0.05;②与高氧组比较,P < 0.05;③与高氧+miR21-5p 组比较,P<0.05
组别常氧组高氧组高氧+miR21-5p组高氧+空载体组F值P值SOD(U/mg)61.51±4.71 17.69±3.66①42.74±3.97①②18.28±6.00①③183.4<0.001 MDA(nmol/mg)8.34±0.66 49.62±3.55①27.59±4.86①②51.52±3.85①③194.7<0.001 ROS(U/mg)49.48±4.68 205.56±6.99①124.12±5.12①②207.50±6.66①③966.5<0.001
2.4 miR21-5p 对HALI 小鼠肺组织TNF-α、IL-6及IL-1β 的影响 如表4 所示,高氧暴露48 h 各组小鼠肺组织TNF-α、IL-6 及IL-1β 水平比较,差异有统计学意义(P<0.05);与常氧组比较,高氧组、高氧+miR21-5p 组和高氧+空载体组TNF-α、IL-6及IL-1β水平升高(P<0.05);与高氧组比较,高氧+miR21-5p 组TNF-α、IL-6 及IL-1β 水平降低(P<0.05);与高氧+miR21-5p 组比较,高氧+空载体组TNF-α、IL-6 及IL-1β 水平较升高(P<0.05)。
表4 各组小鼠肺组织TNF-α、IL-6 和IL-1β 表达的比较Tab.4 Comparison of expression of TNF-α,IL-6 and IL-1β in lung tissue of mice in each group ±s

表4 各组小鼠肺组织TNF-α、IL-6 和IL-1β 表达的比较Tab.4 Comparison of expression of TNF-α,IL-6 and IL-1β in lung tissue of mice in each group ±s
注:①与常氧组比较,P < 0.05;②与高氧组比较,P < 0.05;③与高氧+miR21-5p 组比较,P<0.05
组别常氧组高氧组高氧+miR21-5p 组高氧+空载体组F 值P 值TNF-α(ng/mL)18.97±3.46 344.55±5.11①145.84±6.05①②343.73±4.43①③6499<0.001 IL-6(pg/mL)31.43±3.65 200.67±8.98①120.60±3.87①②201.31±8.43①③870.3<0.001 IL-1β(ng/mL)35.36±5.18 144.50±4.48 87.01±6.19 145.43±5.14 599<0.001
2.5 Tunel 法检测肺组织细胞凋亡 如图3 表5 所示:与常氧组比较,高氧组、高氧+miR21-5p 组及高氧+空载体组小鼠肺组织细胞凋亡率升高(P<0.05);miR21-5p 预处理可减轻高氧暴露所致细胞凋亡,与高氧组比较,高氧+miR21-5p 组小鼠肺组织细胞凋亡率降低(P<0.05)。
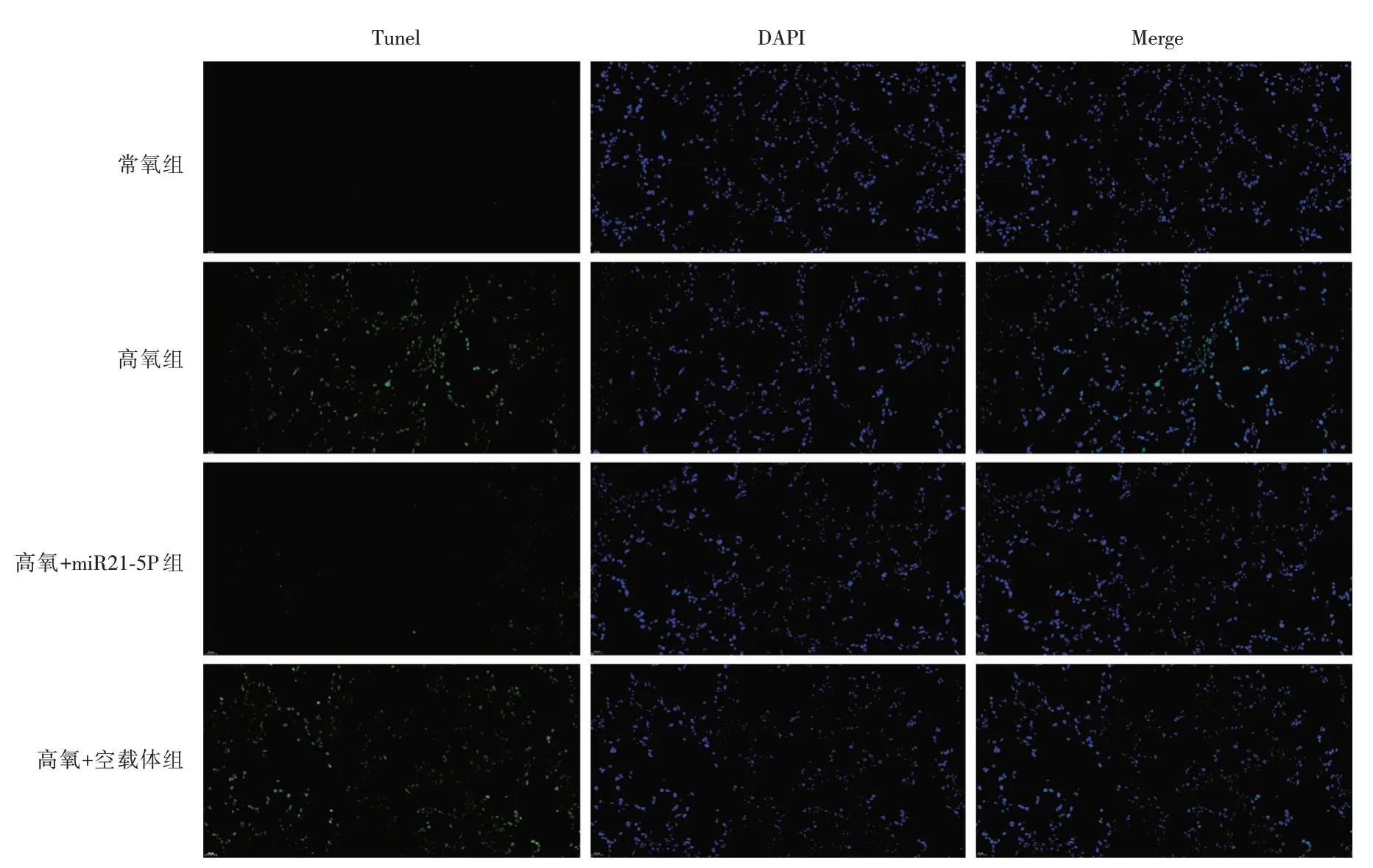
图3 Tunel 法检测肺组织细胞凋亡情况(×200)Fig.3 The Tunel method detects apoptosis of lung histocytes(×200)
2.6 miR21-5p 对HALI 小鼠 肺 组织STAT3、p-STAT3、Bcl-2和Bax蛋白表达的影响 如表5、图3所示,各组小鼠高氧暴露48 h 后肺组织STAT3、p-STAT3、Bcl-2 和Bax 蛋白表达比较,差异有统计学意义(P<0.05),与常氧组比较氧组肺组织STAT3、p-STAT3和Bax蛋白表达水平升高(P<0.05),Bcl-2蛋白表达降低(P< 0.05);与高氧组比较,高氧+miR21-5p 组小鼠肺组织STAT3、p-STAT3 和Bax 蛋白表达水平降低(P<0.05),Bcl-2蛋白表达水平升高(P< 0.05);与高氧+miR21-5p 组比较,高氧+空载体组肺组织STAT3、p-STAT3 和Bax 蛋白表达水平升高(P<0.05),Bcl-2蛋白表达水平降低(P<0.05)。
表5 各组小鼠肺组织STAT3、p-STAT3、Bcl-2 和Bax 蛋白表达的比较Tab.5 Comparison of STAT3,p-STAT3,Bcl-2 and Bax protein expression in lung tissue of mice in each group ±s
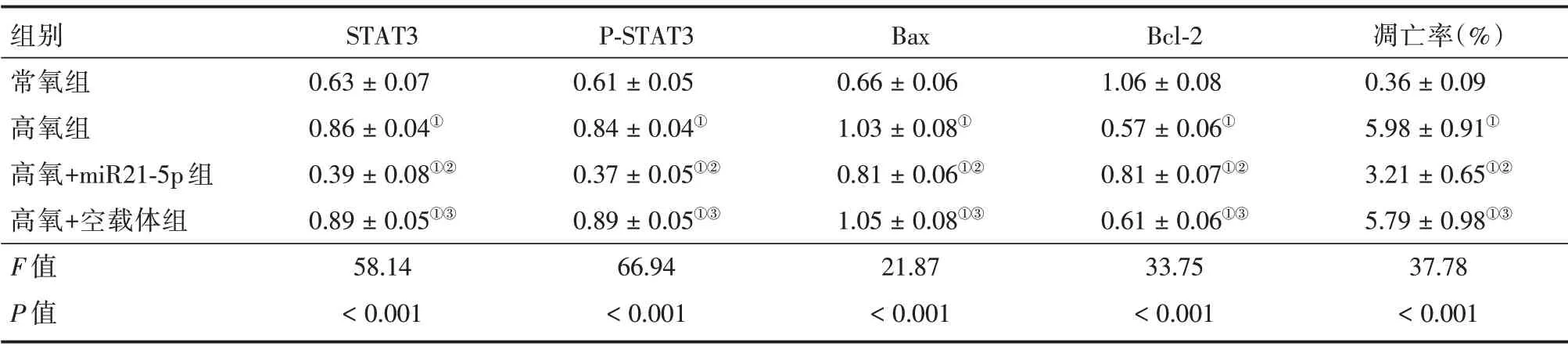
表5 各组小鼠肺组织STAT3、p-STAT3、Bcl-2 和Bax 蛋白表达的比较Tab.5 Comparison of STAT3,p-STAT3,Bcl-2 and Bax protein expression in lung tissue of mice in each group ±s
注:①与常氧组比较,P<0.05;②与高氧组比较,P<0.05;③与高氧+miR21-5p 组比较,P<0.05
组别常氧组高氧组高氧+miR21-5p 组高氧+空载体组F 值P 值STAT3 0.63±0.07 0.86±0.04①0.39±0.08①②0.89±0.05①③58.14<0.001 P-STAT3 0.61±0.05 0.84±0.04①0.37±0.05①②0.89±0.05①③66.94<0.001 Bax 0.66±0.06 1.03±0.08①0.81±0.06①②1.05±0.08①③21.87<0.001 Bcl-2 1.06±0.08 0.57±0.06①0.81±0.07①②0.61±0.06①③33.75<0.001凋亡率(%)0.36±0.09 5.98±0.91①3.21±0.65①②5.79±0.98①③37.78<0.001
3 讨论
HALI 的特征是ROS 蓄积和肺部炎症级联反应[14]。一方面,ROS 可通过脂质与蛋白质过氧化、DNA 损伤等机制造成组织细胞损伤促进炎症进展;另一方面,炎症反应进一步促进ROS 产生,引起肺毛细血管内皮和肺泡上皮细胞凋亡坏死,导致其通透性增加,加重肺水肿和(或)肺不张,促进ARDS 的发生发展[4,15]。而抑制ROS 的超负荷蓄积可阻止肺泡上皮细胞凋亡显著减轻HALI[14]。在本实验中,高氧暴露48 h 后,可见肺组织大量炎症细胞浸润、间隔增厚、透明膜形成和肺泡萎陷;同时肺损伤病理评分、肺水含量及炎症因子升高;说明模型构建成功。而通过miR21-5p 预处理,可减轻肺组织炎症细胞浸润程度及间隔厚度,且肺泡萎陷显著减少,同时肺损伤病理评分、肺水含量及炎症因子表降低,并且STAT3 及p-STAT3 蛋白表达下降,说明miR21-5p 可能通过调控STAT3 活化减轻HALI。
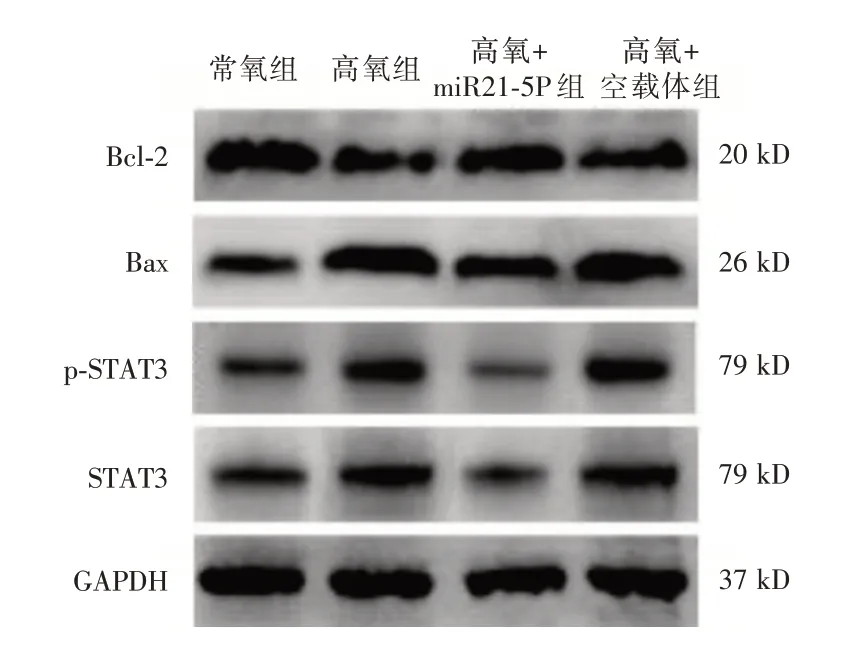
图4 miR21-5p 对HALI 小鼠肺组织STAT3、p-STAT3、Bcl-2 和Bax 蛋白表达的影响Fig.4 Effects of miR21-5p on the expression of STAT3,p-STAT3,Bcl-2 and Bax proteins in the lung tissues of HALI mice
转录激活蛋白家族成员STAT3 在氧化还原平衡、凋亡及炎症反应的作用已成为研究的热点[4]。目前研究认为,适当的ROS 水平可促进STAT3 活化,活化的STAT3 可正向和(或)负向调控ROS 水平,ROS/STAT3 之间的动态平衡在细胞促存活方面发挥重要作用[5]。然而,STAT3 的过度活化可能破坏氧化还原平衡、血管内皮通透和促进细胞凋亡加剧ARDS 的进展,而抑制STAT3 的过度活化可通过调节血管内皮完整性、氧化还原平衡、炎症反应和凋亡减轻脂多糖诱导的急性肺损伤[7,16]。本实验中,高氧暴露48 h 后,可见p-STAT3 水平显著表达,同时MDA、ROS及炎症因子(TNF-α、IL-6、IL-1β)显著升高,而SOD 降低,说明高氧暴露可破坏氧化还原平衡、促进炎症因子表达,而miR21-5p 预处理后,炎症因子及MDA、ROS 水平下降,SOD 水平升高,说明,miR21-5p 可能通过STAT3 调控氧化还原平衡减轻HALI。
microRNAs 是一类进化上高度保守长度约19~25 核苷酸的核苷酸RNA,其通过与靶基因3'非编码区(3'-UTR 区)结合,在转录后水平调控靶基因表达[17]。其通过调控氧化还原平衡、凋亡及炎症反应等病理生理过程在肺部疾病的发生发展中极为重要[18]。而miR21-5p 已被确认为相关肺部疾病的生物标志物、治疗靶点及预后指标的候选者指标[10]。部分研究表明,miR21-5p 过表达可通过抑制TNF-α、IL-6 及IL-1β 的表达和STAT3 活化减轻脂多糖诱导的急性肺损伤[10,19-20]。本实验通过miRbase 数据库发现STAT3 是miR21-5p 靶基因,双荧光素酶报告实验及RT-qPCR 实验结果表明miR21-5p 可靶向负调控STAT3。miR21-5p 过表达预处理后,p-STAT3 水平下降,抗凋亡蛋白Bcl-2 升高,促凋亡蛋白Bax 下降,肺组织细胞凋亡率显著下降。表明,miR21-5p 可通过调控STAT3 过度活化抑制组织细胞凋亡。
综上,miR21-5p 对HALI 具有保护作用,可能通过调控氧化还原平衡、抑制炎症反应并减轻细胞凋亡,并且与转录激活蛋白STAT3 密切相关。但本实验仅通过Western blot 及Tunel 法检测肺组织凋亡,未在细胞分子水平检测如巨噬细胞、肺泡Ⅱ型上皮细胞凋亡水平;故本实验还存在不足之处。课题组下一步将通过沉默STAT3 或使用STAT3 基因敲除鼠进一步在细胞层面探讨miR21-5p 靶向STAT3 在HALI 中的分子机制,以期为临床防治HALI 提供可靠的科学依据。

