大黄素缓解类风湿关节炎痛的机制研究
成鼎文 朱海丽 谢 敏 刘 玲
湖北科技学院医学部药学院,湖北咸宁 437000
类风湿关节炎(rheumatoid arthritis,RA)是一种慢性全身性疾病,可导致关节损伤及病理性疼痛,严重影响患者生活质量[1],其病理机制与氧化应激失调和免疫炎症反应密切相关[2]。核因子E2相关因子2(nuclear factor E2-related factor 2,Nrf2)作为一种重要的抗氧化蛋白,可激活内源性抗氧化通路,清除氧自由基,维持细胞氧化还原平衡,显著抑制RA发展[3]。白介素1β(interleukin 1β,IL-1β)是最常见的炎性细胞因子,在RA疼痛患者中,通过抑制IL-1β分泌,可显著改善患者症状[4]。因此,激活内源性抗氧化通路和抑制脊髓神经炎症可作为治疗RA痛的一个有效手段。
大黄素(1,3,8-三羟基-6-甲基蒽醌)是从药用植物的根和树皮中提取的衍生蒽醌化合物,其具有抗炎、抗氧化等特性[5]。为研究大黄素在RA疼痛中的作用,本研究中构建佐剂型RA疼痛小鼠模型,大黄素腹腔给药后检测其对疼痛的缓解作用,并探讨其作用机制。
1 材料与方法
1.1 实验动物
本实验所使用的C57BL/6小鼠购自湖北省实验动物中心[动物许可证号:SYXK(鄂)2018-0071],共30只,6~8周龄,体重18~22 g。动物饲养在明暗交替的动物房中,并给予适量的食物和水。所有动物实验均经湖北科技学院实验动物伦理委员会批准(2021-05-981)。
1.2 仪器及试剂
冰冻离心机(德国eppendorf公司,型号:5424R);微型垂直电泳仪(北京韦克斯科技有限公司,型号:EP300);迷你手持均质仪(北京兰杰柯科技有限公司,型号:L-C119-0502);荧光倒置显微镜(日本Olympus公司,型号:IX73P1F);凝胶成像分析系统(美国GE公司,型号:29-0050-63)。
大黄素(上海源叶生物科技有限公司);完全弗式佐剂、蛋白酶抑制剂、RIPA裂解液、SDSPAGE凝胶快速配制试剂盒、BCA蛋白浓度测定试剂盒均购于上海碧云天生物技术有限公司;本实验所用一抗如下:兔抗核因子κB(nuclear factor kappa B,NF-κB)、兔抗β肌动蛋白(β-actin)和兔抗IL-1β均购于Affinity公司;兔抗NOD样受体热蛋白结构域相关蛋白3(NOD-like receptor 3,NLRP3)、兔抗环氧化酶2(cyclooxygenase 2,COX-2)和兔抗Nrf2均购于武汉爱博泰克生物科技有限公司,兔抗小胶质细胞标记蛋白游离钙结合适配器蛋 白1(ionized calcium binding adapter protein 1,Iba1)购于碧云天生物科技有限公司;所用二抗为辣根过氧化物酶标记的山羊抗兔IgG购于武汉爱博泰克生物科技有限公司。
1.3 动物造模与给药处理
将30只小鼠随机分为对照组、模型组和大黄素给药组,每组各10只。模型组和大黄素给药组采用左膝关节注射完全弗式佐剂造模。动物适应1周后,开始造模,具体流程如下:完全弗式佐剂与生理盐水1∶1稀释,采用水合氯醛麻醉,小鼠左腿剃毛,使用无菌微量注射器向小鼠左膝关节内缓慢注射完全弗式佐剂混悬液(40 μl),随后用碘伏消毒伤口。建模持续14 d,14 d后观察造模部位,若皮肤发红肿胀或膝关节有红肿,则视为造模成功。造模成功后,10 mg/kg大黄素腹腔给药处理小鼠,连续给药3 d,3 d后检测所有动物行为学变化,行为学检测完以后进行动物麻醉处死,脊髓取材用于后续实验研究。
1.4 动物行为学实验
1.4.1 自发缩足反射次数记录 将小鼠置于20 cm×20 cm×20 cm的透明玻璃盒内,实验开始前适应20 min,过程中观察并记录每5 min内小鼠自发性缩足(或舔爪)反射次数,记录3次,计算其缩足反射平均值。
1.4.2 缩足阈值检测 将动物放置于20 cm×20 cm×20 cm的透明正方体玻璃盒内,适应30 min后,用Von Frey纤维(0.16~2.0 g)垂直刺激小鼠左侧后肢足底正中,持续时间≤5 s,出现舔足或者抬足等行为视为阳性反应,反之则为阴性反应。记录6次数据后结束检测。根据公式50% PWT(g)=(10[Xf+Kδ])/10 000计算各组小鼠的缩足阈值。
1.4.3 转棒运动实验 正式实验开始前3天每天将小鼠放在转棒仪器上适应,设置参数匀速4 r/min的速度适应10 min,间隔休息30 min,重复3次。正式实验时以10 r/min运动10 s,匀加速10 s,以20 r/min运动30 s,匀加速10 s,以20 r/min运动9 min。记录实验动物运动的距离和在转棒上停留的时间。
1.5 免疫印迹(Western blot)
过量麻醉处死小鼠分离腰段脊髓,使用含有蛋白酶抑制剂的RIPA裂解液裂解、匀浆、4℃条件下12 000 r/min离心15 min后取上清,BCA蛋白测定试剂盒检测其蛋白浓度;SDS-PAGE电泳分离蛋白,转膜,5%脱脂奶粉室温封闭,孵育一抗4℃过夜,二抗室温孵育1 h,用LAS500凝胶成像系统扫描观察,凝胶成像Image J软件分析条带灰度值。
1.6 统计学方法
采用GraphPad Prism 8.0.2进行统计学分析,计量资料用均数±标准差()表示,两两比较采用t检验,多组间比较采用单因素方差分析(one-way ANOVA),P< 0.05为差异有统计学意义。
2 结果
2.1 大黄素对RA痛小鼠行为学的影响
模型组小鼠的缩足阈值、转棒停留时间和运动距离均低于对照组,自发缩足次数高于对照组,差异有统计学意义(P< 0.05),表明RA小鼠痛觉过敏并伴有运动功能的降低;大黄素给药组小鼠的缩足阈值、停留时间和运动距离均高于模型组,自发缩足次数低于模型组,差异有统计学意义(P< 0.05),表明大黄素腹腔给药可显著改善RA小鼠的运动能力。见表1。
表1 大黄素对RA痛小鼠行为学的影响(±s)
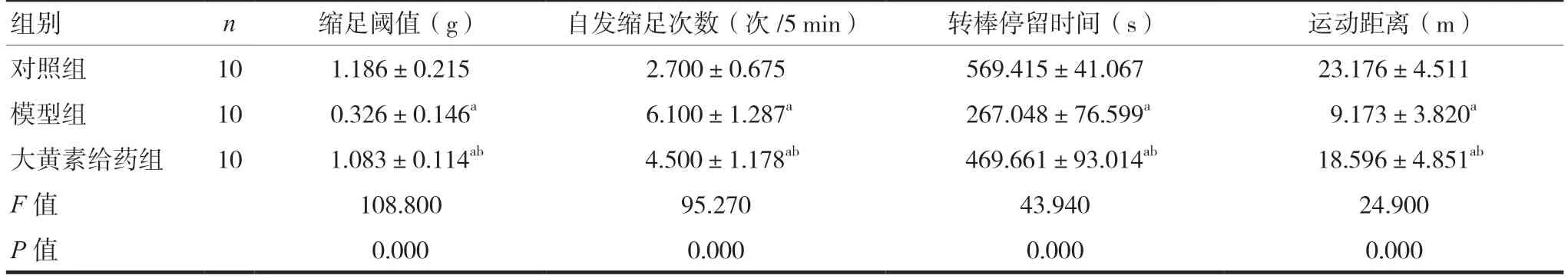
表1 大黄素对RA痛小鼠行为学的影响(±s)
注 与对照组比较,aP< 0.05;与模型组比较,bP< 0.05
组别 n 缩足阈值(g) 自发缩足次数(次/5 min) 转棒停留时间(s) 运动距离(m)对照组 10 1.186±0.215 2.700±0.675 569.415±41.067 23.176±4.511模型组 10 0.326±0.146a 6.100±1.287a 267.048±76.599a 9.173±3.820a大黄素给药组 10 1.083±0.114ab 4.500±1.178ab 469.661±93.014ab 18.596±4.851ab F值 108.800 95.270 43.940 24.900 P值 0.000 0.000 0.000 0.000
2.2 小鼠脊髓组织中Iba1、Nrf2和COX-2蛋白表达情况
Western blot结果显示,模型组小鼠的脊髓组织Iba1和COX-2蛋白表达高于对照组,Nrf2蛋白表达低于对照组,差异有统计学意义(P< 0.05);大黄素给药组小鼠的脊髓组织Iba1和COX-2蛋白表达低于模型组,Nrf2蛋白表达高于模型组,差异有统计学意义(P< 0.05)。见图1、表2。

图1 小鼠脊髓组织Iba1、Nrf2和COX-2蛋白表达结果
表2 小鼠脊髓组织中Iba1、Nrf2和COX-2蛋白相对表达水平(±s)

表2 小鼠脊髓组织中Iba1、Nrf2和COX-2蛋白相对表达水平(±s)
注 与对照组比较,aP< 0.05;与模型组比较,bP< 0.05;Iba1:小胶质细胞标记蛋白游离钙结合适配器蛋白1;Nrf2:核因子E2相关因子2;COX-2:环氧化酶2;β-actin:β肌动蛋白
组别 n Iba1/β-actin Nrf2/β-actin COX-2/β-actin对照组 10 1.000±0.031 1.000±0.023 1.001±0.013模型组 10 1.132±0.037a 0.959±0.031a 2.436±0.113a大黄素给药组10 0.771±0.017ab 1.918±0.071ab 1.250±0.113ab F值 75.690 310.100 358.800 P值 0.001 0.002 0.003
2.3 小鼠脊髓组织中NF-κB、NLRP3和IL-1β蛋白表达情况
western blot结果显示,模型组小鼠的脊髓组织NF-κB、NLRP3和IL-1β表达均高于对照组,差异有统计学意义(P< 0.05);大黄素给药组小鼠的脊髓组织NF-κB、NLRP3和IL-1β蛋白表达水平均低于模型组,差异有统计学意义(P< 0.05)。见图2、表3。
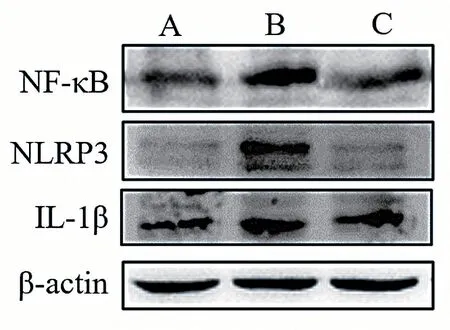
图2 小鼠脊髓组织NF-κB、NLRP3和IL-1β蛋白表达结果
表3 小鼠脊髓组织中NF-κB、NLRP3和IL-1β蛋白相对表达水平(±s)
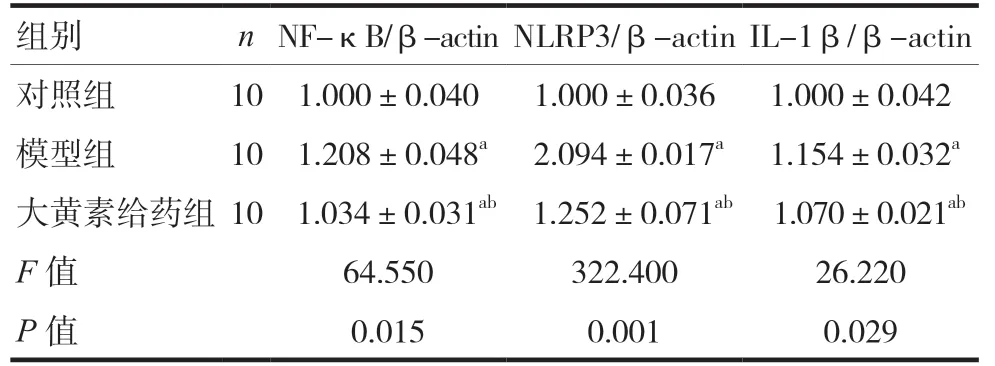
表3 小鼠脊髓组织中NF-κB、NLRP3和IL-1β蛋白相对表达水平(±s)
注 与对照组比较,aP< 0.05;与模型组比较,bP< 0.05;NF-κB:核因子κB;NLRP3:NOD样受体热蛋白结构域相关蛋白3;IL-1β:白介素1β;β-actin:β肌动蛋白
组别 nNF-κB/β-actinNLRP3/β-actinIL-1β/β-actin对照组 10 1.000±0.040 1.000±0.036 1.000±0.042模型组 10 1.208±0.048a 2.094±0.017a 1.154±0.032a大黄素给药组10 1.034±0.031ab 1.252±0.071ab 1.070±0.021ab F值 64.550 322.400 26.220 P值 0.015 0.001 0.029
3 讨论
研究表明大黄素在多种病理性疼痛进程中发挥作用,在慢性炎症痛大鼠模型中,腹腔注射大黄素降低血清中肿瘤坏死因子α(tumor necrosis factor α,TNF-α)/IL-1β和IL-6的水平并缓解大鼠机械痛和热痛[6]。在慢性缩窄性损伤神经痛模型中,大黄素降低背跟神经节中初级感觉神经元嘌呤P2X受体的表达并减轻大鼠痛觉过敏[7]。本研究发现大黄素在RA疼痛模型中可有效缓解小鼠自发痛和机械痛。因此,大黄素可作为治疗病理性疼痛的药物,具有较好的医用前景。
NLRP3炎症小体激活介导的脊髓炎症多种病理性疼痛中发挥重要作用。NLRP3被刺激后与接头蛋白ASC组装成复合物,催化caspase-1激活,将无活性的pro-IL-1β裂解为具有促炎活性的IL-1β并释放[8]。在患有纤维肌痛和Schnitzler综合征(一种罕见的以关节疼痛和关节炎为特征的自身免疫性疾病)的患者血液中发现了NLRP3和IL-1β表达增加。同时在疼痛动物模型包括炎症痛、神经痛、癌痛以及RA痛中均报道了NLRP3表达和激活增加以及IL-1β的产生增加[9]。进而NF-κB激活可促进无活性NLRP3和pro-IL-1β转录,上调NLRP3和pro-IL-1β表达水平[10]。在胰腺癌[11]和肥胖哮喘[12]模型中发现大黄素可抑制NF-κB信号活性及IL-1β水平从而发挥保护作用。本研究发现大黄素可降低脊髓中NF-κB、NLRP3和IL-1β的表达,具有抑制脊髓炎症的效果。
Nrf2及其下游靶点与炎症和病理性疼痛相关。过量的活性氧导致慢性疼痛的发展,Nrf2激活可增加抗氧化激酶的基因转录包括血红素加氧酶-1、超氧化物歧化酶和谷胱甘肽还原酶等,降低活性氧的水平进而缓解疼痛[13]。同时Nrf2激活还可抑制NF-κB核蛋白和炎症因子的表达[14]。研究发现在阿尔茨海默病模型中,大黄素增加Nrf2、超氧化物歧化酶和谷胱甘肽还原酶活性从而改善小鼠空间记忆和学习能力[15]。本研究发现大黄素给药可升高脊髓Nrf2表达并降低COX-2表达,从而减轻脊髓氧化应激水平。
本研究的创新点在于将脊髓炎症及氧化应激与大黄素的镇痛效果联系在一起,并为大黄素的镇痛作用机制作出解释。同时,局限性在于给药方式为腹腔给药,大黄素起效剂量和代谢率不能准确定量,在进一步研究中可改用静脉给药或鞘内给药,从而明确大黄素药物剂量与镇痛功效的关系。
综上所述,本研究发现大黄素可激活抗氧化Nrf2途径降低NF-κB介导的炎症信号并发挥镇痛效应,有助于大黄素作为RA痛的镇痛药物开发研究。

