梓醇对氧糖剥夺/复氧复糖损伤成熟人神经母细胞瘤细胞的修复作用及其机制
刘燕,高春辰,,厉励,冯清华,吴明华,李文磊
1 南京中医药大学附属医院 南京中医药大学第一临床医学院,南京210023;2 东部战区空军医院;3 南京中医药大学附属医院/江苏省中医院
最新的流行病学数据显示,每年约有1 500 万人遭受脑血管病的折磨,其中约80%为缺血性脑卒中患者[1]。由于条件限制,很大一部分缺血性脑卒中患者因错过最佳溶栓或取栓时间窗而导致严重后遗症[2],这些患者肢体运动功能障碍发病率高达90%[3],即使经过康复治疗,60%的患者依旧存在持续性的肢体功能障碍[4],严重影响其生活自理能力,还可能导致卒中后焦虑、抑郁、社会疏离等多种并发症[5],给患者及其家庭和社会都带来沉重负担。已有研究[6]表明,通过促进疾病条件下受损的神经元芽生或再生成为新的轴突,重塑神经网络,或通过诱导未分化的神经元细胞向病灶周围迁移,代替坏死神经元建立新的神经环路,可显著改善缺血性脑卒中的预后。诱导由神经元迁移、轴突发芽再生、侧支形成、新突触形成介导的神经组织再生重塑是缺血性脑卒中长期有效的治疗方法,但是临床尚无疗效确切的药物,因此探索促进轴突生长的药物及其机制是现代神经医学面临的紧要问题。
据文献报道,梓醇在保护神经、促进轴突生长进而改善缺血性脑卒中症状方面具有一定的积极作用。梓醇能够保护大脑神经系统,抑制大鼠缺血再灌注后神经元凋亡,从而减少大脑损伤[7],促进大鼠皮质脊髓束重塑和轴突芽生,同时可促进皮质神经元轴突增长,进而促进偏瘫患侧肢体感觉及其活动能力的恢复。以上研究提示梓醇对神经细胞具有保护作用,同时对神经再生修复和肢体运动功能的恢复具有促进作用,但具体的作用机制尚不明确。课题组前期研究发现PTEN、mTOR 是控制轴突内在生长能力的关键信号通路,而OPN、IGFR 与PTEN 的相互作用能够调控mTOR 信号通路,进而激活轴突内在生长能力,以促进轴突的发芽和生长[8]。SH-SY5Y 细胞在形态结构和生理功能方面与神经细胞有共同之处,在ATRA 诱导下SH-SY5Y可成功分化为成熟神经元,适合观察细胞及轴突的生长变化,故常用于神经元保护、轴突生长和突触连接等方面的研究[9-10]。氧糖剥夺是在细胞水平上模拟缺血/低氧的刺激模型。通过对细胞培养条件的改变,包括将细胞放入低氧箱加之更换无糖的培养基,模拟细胞在缺血/低氧情况下的损伤,细胞会产生坏死、凋亡、自噬等现象。缺血性卒中是供应大脑的大动脉栓塞,而大脑主要动脉的闭塞会引发下游微血管的继发血栓形成[11-12],这些血栓会导致相应血管血流不畅、灌注不足,氧糖量减少。氧糖剥夺模拟体内脑缺血过程,而其治疗的关键是时间窗内溶栓、取栓恢复血液的再灌注,但是再灌注会致使原缺血脑组织发生继发性损伤。如神经细胞凋亡增加、活性氧产生增加,产生丧失机能、加速老化、免疫机能衰退的严重后果,以上称为脑缺血再灌注损伤,复氧复糖则模拟再灌注的过程。所以氧糖剥夺/复氧复糖模型常用于脑卒中缺血再灌注的离体实验。2021年8月—2022年6月,本研究通过建立氧糖剥夺/复氧复糖损伤SH-SY5Y 细胞模型,观察梓醇对模型细胞是否有修复作用,并探讨了其作用机制。
1 材料与方法
1.1 细胞、药物、试剂及仪器 SH-SY5Y 细胞由中国科学院干细胞库提供。梓醇(纯度≥97%,货号:A0215,成都曼思特生物科技有限公司)。实验试剂:CCK-8 试剂盒(货号:KGP902,凯基生物);0.25%Trypsin-EDTA(货号:25200056,美国Gibco 公司);MEM/F12 完全培养基(货号:ZQ-1205,上海中乔新舟生物科技有限公司);ATRA(美国Sigma 公司);兔源抗IGF1(货号:182408,英国Abcam 公司)、兔源抗GAP43(货号:DF7766,中国 Affinity 公司)、兔源抗p-S6、β-Ⅲ-tubulin、IGFR、P-IGFR(货号分别为4857、5568、9750、3024,美国CST 公司)、小鼠源抗NeuN、mTOR、GAPDH、兔源抗OPN、PTEN、羊抗小鼠二抗、CoraLite594 抗小鼠二抗、CoraLite488 抗兔二抗(货号分别为66836、66888、60004、22952、22034、SA00013-7、SA00013-2,中国 Proteintech 公司)、羊抗兔二抗(BOSTER)。实验仪器:三气培养箱(美国Nuaire 公司)、倒置相差显微镜(日本Olympus 公司)、荧光倒置显微镜(日本Nikon 公司)、激光共聚焦显微镜(德国Zeiss 公司)、金属水浴锅(德国GFL 公司)、低温离心机(美国Thermo 公司)、化学发光仪(美国BIO-RAD 公司)、酶标仪(美国BIOTEK 仪器有限公司)。
1.2 SH-SY5Y 细胞的分组、氧糖剥夺/复氧复糖细胞损伤模型的建立、梓醇的加入 将SH-SY5Y 细胞分为梓醇组、模型组、诱导组、对照组。对照组:SHSY5Y细胞不做任何处理;诱导组:用ATRA诱导SHSY5Y 细胞72 h,将其诱导为成熟神经元;模型组:ATRA 诱导72 h 后,将完全培养基换成无糖的EBSS溶液置于三气培养箱(氧气1%,二氧化碳5%,氮气94%)4 h,氧糖剥夺结束后换回完全培养基,复氧12 h;梓醇组:细胞经模型组同样处理后,加入含不同浓度梓醇(50、100、200 μmol/L)的完全培养基常规培养72 h。经ATRA 诱导SH-SY5Y 分化3 d后,出现显著的形态学改变,表现为神经元的特点,突起充分伸展,维持较长的长度。SH-SY5Y 经NeuN(神经元的特异核蛋白)、β-Ⅲ-tubulin(神经元的结构蛋白)抗体染色,阳性率达95%以上。提示在ATRA 诱导下,SH-SY5Y 可成功分化为成熟神经元细胞(图1)。
SH-SY5Y 经ATRA 诱导后经氧糖剥夺/复氧复糖0、0.5、1、1.5、2、4、6、8 h后,细胞的存活率分别为100%、87.25% ± 7.27%、67.50% ± 3.11%、70.25% ± 4.50%、64.50% ± 3.42%、58.00% ±6.48%、45.50% ± 1.29%、41.50% ± 3.00%,细胞的存活率呈时间依赖性递减,细胞在4 h 达到58%(P<0.0001),此时既对细胞造成一定的损伤,又保证大部分的细胞存活,符合后期给药观察的条件,所以确定4 h为后期实验的最佳造模时间。
1.3 细胞活力的检测 采用CCK-8 法。取上述各组对数生长期的神经细胞SH-SY5Y 以1×104/mL 接种于96 孔板,100 μL/孔,待细胞贴壁后,培养结束后,在每孔加入10 μL CCK-8 溶液与100 μL 完全培养基的混合液,置于37 ℃恒温箱继续培养3 h,反应结束后,使用酶标仪于490 nm 波长处测量吸光度值。
1.4 细胞迁移、穿越能力的观察 采用细胞划痕实验。取模型组及梓醇组细胞,待细胞汇合度达到80%~90%后,用无菌的100 μm 枪头沿直尺在皿底进行划痕,PBS 清洗1 遍后,分别于处理后0 、48 h 在显微镜下拍照。以划痕两个边缘为界,使用Image J 软件测量两个边缘之间的面积,取均值。
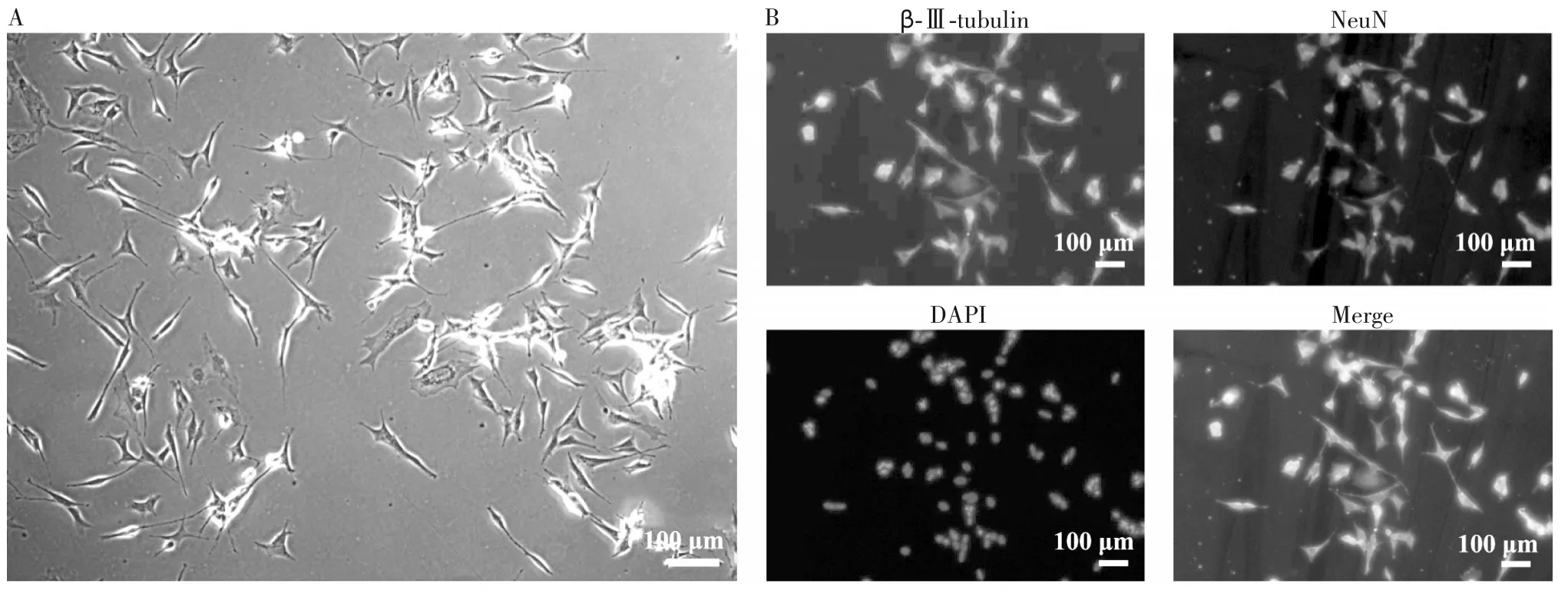
注:图A 为ATRA 诱导3 d 后SH-SY5Y 细胞的形态;图B 为ATRA 诱导3 d 后采用β-III-tubulin、NeuN 进行免疫荧光染色的SH-SY5Y 细胞(荧光倒置显微镜,×200)。
1.5 细胞轴突长度的测算 采用免疫荧光染色法。将对照组、ATRA 诱导组、模型组、梓醇组细胞接种于共聚焦小皿,培养结束后,免疫荧光固定液固定细胞20 min,PBST 浸洗,加入山羊血清封闭60 min,去除血清封闭液,利用β-Ⅲ-tubulin、NeuN抗体进行免疫荧光染色,于4 ℃孵育过夜。用PBST洗净一抗后,同时加入CoraLite594 抗小鼠、CoraLite488抗兔二抗稀释液常温避光孵育1 h,用PBST洗净二抗后,加入含DAPI 的抗免疫荧光淬灭液,等待5 min,在激光共聚焦显微镜下观察并收集图像,并使用Image J测量轴突长度,取均值。
1.6 细胞中GAP43、OPN、p-IGFR、PTEN、mTOR、p-S6蛋白的检测 采用Western blotting 法。收集诱导组、模型组、梓醇组细胞,用含苯甲基磺酰氟(PMSF)和蛋白酶抑制的RIPA 裂解液提取蛋白,采用BCA法测定蛋白浓度。SDS-PAGE 凝胶电泳条件:80 V、30 min,120 V、60 min。转膜条件:250 mA 恒流电转90 min,在冰上完成,使用脱脂奶粉常温封闭1 h。封闭结束后,加入稀释后的GAP43、OPN、p-IGFR、PTEN、mTOR、p-S6、GAPDH、β-actin 一抗4 ℃孵育过夜。洗净一抗,加入二抗,常温孵育2 h。洗净二抗,最后用超敏ECL 发光液显影,使用Image J 软件进行图像分析。结果以各目的蛋白与内参蛋白相对表达量的比值来表示。
1.7 统计学方法 采用 SPSS26.0、Graphpad Prism 9 软件。正态分布分析采用Kolmogorovsmirnov 检验,符合正态分布的计量资料以±s表示,多组之间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。P<0.05 为差异有统计学意义。
2 结果
2.1 各组SH-SY5Y 细胞存活率比较 梓醇50 μmol/L 组、梓醇100 μmol/L 组、梓醇200 μmol/L组、模型组、诱导组、对照组SH-SY5Y 细胞存活率分别为74.10% ± 6.40%、68.50% ± 6.39%、69.9% ±1.37%、51.47% ± 6.98%、107.66% ± 6.15%、100%。与对照组相比,诱导组存活率升高(t=12.36,P<0.0001);与诱导组相比,模型组存活率降低(t=10.45,P<0.0001);不同浓度梓醇组存活率均有升高(t值分别为4.136、3.113、4.496,P均<0.05),各浓度组之间的差异不具有统计学意义。
2.2 各组SH-SY5Y 细胞形态及轴突长度比较 经β-Ⅲ-tubulin 免疫荧光染色后,对照组细胞体圆润,轴突较短,胞体与胞体之间几乎没有轴突连接。诱导组细胞轴突较长并且相互交织,形成神经网络;与诱导组细胞相比,模型组细胞数量减少,胞体扁平,轴突回缩;与模型组比较,梓醇组神经元数量增多,轴突长度获得一定的恢复。梓醇50 μmol/L 组、梓醇100 μmol/L 组、梓醇200 μmol/L 组、模型组、诱导组、对照组轴突长度分别为(93.78 ± 8.66)、(91.22 ± 10.97)、(88.77 ± 8.68)、(42.99 ± 5.72)、(110.97 ± 9.8)、(39.71 ± 5.73)μm,与对照组相比,诱导组轴突长度延长;与诱导组相比,模型组轴突长度缩短(t=21.59,P<0.001);不同浓度梓醇组神经元轴突长度均延长(t分别为16.97、13.68、13.18,P均<0.01),而不同浓度梓醇组之间比较,P>0.05。
2.3 梓醇组、模型组SH-SY5Y 细胞迁移、轴突穿越能力观察 48 h 后,梓醇50 μmol/L 组、梓醇100 μmol/L 组、梓醇200 μmol/L 组、模型组细胞划痕面积分别为(275.56 ± 16.98)、(311.16 ± 3.87)、(237.12 ± 10.85)、(343.74 ± 11.18)μm2。与模型组相比,不同浓度梓醇组48 h 后的划痕面积均小(t分别为4.742、3.892、9.674,P均<0.05),不同浓度梓醇组之间比较,P>0.05。
2.4 各组SH-SY5Y 细胞中GAP43、OPN、p-IGFR、PTEN、mTOR、p-S6蛋白相对表达量比较 与诱导组比较,模型组PTEN 相对表达量升高(P<0.05),OPN降低(P<0.05);与模型组比较,不同浓度梓醇组GAP43、OPN、p-IGFR、mTOR 及其下游效应分子p-S6 蛋白相对表达量均升高,PTEN 蛋白相对表达量降低(P均<0.05),详见表1。
表1 各组GAP43、OPN、p-IGFR、PTEN、mTOR、p-S6蛋白相对表达量比较(±s)

表1 各组GAP43、OPN、p-IGFR、PTEN、mTOR、p-S6蛋白相对表达量比较(±s)
注:与诱导组比较,#P<0.05,##P<0.01;与模型组比较,*P<0.05,**P<0.01。
组别梓醇50 μmol/L 组梓醇100 μmol/L组梓醇200 μmol/L组模型组诱导组p-S6 2.26 ± 0.30**3.25 ± 0.26**3.70 ± 0.31**0.61 ± 0.14 1 GAP43 1.36 ± 0.01**1.18 ± 0.08*1.05 ± 0.03 0.94 ± 0.10 1 OPN 0.80 ± 0.01*1.03 ± 0.04**1.23 ± 0.06**0.64 ± 0.01##1 p-IGFR 1.81 ± 0.05 2.04 ± 0.08*2.07 ± 0.03*1.75 ± 0.02 1 PTEN 0.70 ± 0.03*0.73 ± 0.12*0.49 ± 0.08*1.24 ± 0.10#1 mTOR 1.65 ± 0.23**1.26 ± 0.13*1.21 ± 0.19*0.82 ± 0.03 1
3 讨论
缺血性脑卒中发病原因主要在于动脉粥样硬化闭塞或血栓形成造成大脑区域供血不足,导致不可逆性的神经元损伤和死亡,致使患者出现多种神经功能缺损症状,严重影响患者的生活质量[13]。在神经功能恢复过程中,代偿性轴突再生发芽、侧支形成、新突触形成及神经网络再连接发挥着至关重要的作用。因此,通过增强神经再生重塑能力改善神经功能缺损症状,是缺血性脑卒中的重要治疗策略[14-15]。
中药地黄因较好的临床疗效被广泛应用于神经系统疾病中,在缺血性脑卒中治疗的常用中药方中,如地黄饮子、羚羊角汤、左归丸等都有地黄[16],尤其既病之后“髓海不足”导致偏瘫等后遗症缠绵难愈,地黄填精益髓的功效发挥着尤为重要的作用[17]。梓醇是从地黄中提取的一种环烯醚萜类化合物,为地黄的主要化学成分[18]。越来越多的研究表明梓醇是治疗脑缺血[19-20]、糖尿病脑病[21]和痴呆等老年神经退行性疾病的潜在药物,但梓醇作用的靶点和机制尚不明确,仍需进一步研究和探索。
mTOR 是调控神经细胞内在生长能力的关键信号通路,其下游蛋白p-S6 磷酸化表达水平可间接表征mTOR 活性,mTOR/p-S6 活性的增强与缺血性脑损伤后轴突再生能力密切相关。研究表明,梓醇能通过调控mTOR 信号通路来促进大鼠轴突生长和皮质脊髓束芽生重塑,促进坐骨神经损伤修复,缩小梗死中心范围,并促进梗死周边血管新生。PTEN 是抑制细胞内在生长能力的重要分子靶点,成年后高水平的PTEN 能够抑制mTOR 通路,使成熟神经元轴突芽生和再生能力显著下降。研究[22-23]表明,抑制PTEN 表达,重新激活mTOR 通路,能够促进视神经轴突和脊髓损伤后皮质脊髓束轴突的显著芽生、再生以及功能恢复。新近的研究[24]也提示,mTOR 通路相关蛋白OPN 在神经再生修复过程中发挥重要作用,通过OPN 和IGF1联合应用,可实现视神经轴突的显著芽生和长距离再生,促进视觉功能恢复。本课题组前期研究也发现,OPN 可激活mTOR 通路激发神经细胞内在生长能力,促使皮质脊髓束轴突发芽和侧支形成,促进运动功能恢复[25]。进一步的机制研究表明,OPN 能够聚集、调动细胞表面IGFR 受体,并诱导其磷酸化成为p-IGFR,进而激活mTOR 通路,同时降低PTEN 表达,以减轻其对mTOR 通路的抑制作用,使细胞内在生长能力被充分调动,细胞活力、迁移能力显著增强,从而达到促进轴突发芽和生长作用的。
本研究使用ATRA将未分化的SH-SY5Y细胞诱导分化为成熟的神经元细胞,此时轴突相对较长,便于后续实验观察,并使用神经元特异性标志蛋白NeuN 进行鉴定,氧糖剥夺/复氧复糖模拟体内脑缺血再灌注的过程,氧糖剥夺4 h、复氧复糖24 h,细胞死亡率达40%左右。研究证实梓醇可显著增强经氧糖剥夺/复氧复糖损伤后的SH-SY5Y 细胞活力,促进轴突生长,并提高其迁移、穿越能力。进一步的机制研究显示,梓醇可显著促进OPN、p-IGFR、mTOR 及其下游效应分子p-S6 蛋白的表达,并抑制负性调控因子PTEN 蛋白的表达水平,提示梓醇可能通过调控OPN/p-IGFR/mTOR 信号轴参与对神经细胞内在生长能力的调控,细胞活力、迁移能力显著增强,提高健侧神经元向病灶侧迁移,健侧轴突生长至患侧,形成新的神经网络连接,缩小半暗带的面积进而发挥其对缺血缺氧条件下病灶神经元再生修复的促进作用,本研究结果还显示,加入50 μmol/L、100 μmol/L、200 μmol/L 梓醇对SHSY5Y 细胞的活力,迁移、穿越能力及促进轴突的生长能力相当,三者之间的比较无统计学差异,从效价方面考虑,将采用50 μmol/L 梓醇进行后续相关细胞实验。
综上所述,梓醇可能通过OPN/p-IGFR/mTOR 信号轴,增强氧糖剥夺/复氧复糖损伤后SH-SY5Y 细胞的活力,提高其迁移、穿越能力,并促进轴突的生长,进而发挥其对缺血缺氧条件下神经元的保护,神经细胞的迁移及轴突再生修复作用。

