抗坏血酸浸渍后草莓中天然叶酸稳定性的变化
谭美,张靖旋,潘靖茹,孟梓怡,胡清心,林芷伊,王超,段翰英
(暨南大学理工学院,广东广州 510632)
草莓属蔷薇科植物,色泽鲜艳、口感鲜美,含有丰富的营养物质,其中叶酸作为人体所必需的微量元素在草莓中含量尤其丰富[1]。叶酸是B族维生素中的一种,由于人体不能自我合成叶酸,因此食物是叶酸的唯一来源[2]。
叶酸稳定性较差,在室温中很容易氧化降解[3,4,5]。即使在4 ℃的贮藏环境中,草莓中的总叶酸含量也会出现持续降低的情况[6]。叶酸在食物中主要以 5-甲基四氢叶酸形态存在,在食品体系中较为稳定,并可以直接参与一碳代谢。除此之外还有5,10-亚甲基四氢叶酸、四氢叶酸以及降解产物或合成产物对氨基苯甲酸[2]。其中四氢叶酸作为多谷氨酰化的最适底物,是叶酸种类中最活泼的形式,在储藏过程中极易发生降解,但研究发现四氢叶酸在人体中作用重大,可以减轻和改善慢性酒精病引起的肝损伤[7]。对氨基苯甲酸被称为叶酸的合成前体和降解产物,分支酸在氨基脱氧分支酸合成酶的转化下和氨基酸脱氧核苷酸的裂解酶的介导下生成对氨基苯甲酸,对氨基苯甲酸经转运到线粒体中进行叶酸的生物合成。另外,叶酸降解,四氢叶酸和二氢叶酸可转化成四氢蝶呤-6-醛、二氢蝶呤-6-醛以及对氨基苯甲酰谷氨酸片段[8]。
考虑到叶酸的损失大多数是因为天然叶酸本身发生了氧化反应,相关研究已在食品系统中验证了抗坏血酸(Ascorbic acid,AsA)对5-甲基四氢叶酸的保护效果[9]。AsA是植物、动物在正常生长活动中不可缺少的一种抗氧化剂。AsA不仅对机体内的组织修补、脂肪与蛋白质的合成等方面有所作用,还影响叶酸的吸收与代谢[10]。研究结果表明,在胡萝卜汁中添加0.5 mg/g的AsA可以显著降低叶酸在高温和高压条件下的降解[9]。草莓虽然富含AsA,可达0.447 mg/g[1],但前期研究发现,草莓中的叶酸在储存过程中也会逐渐降解,推测可能是草莓中的AsA含量不足以保护草莓中的叶酸,因此提高草莓中AsA的含量可能有助于叶酸稳定性。
浸渍技术是扩散和渗透相结合的过程,在食品中应用可以增加食品的风味、保护成色、增加食品的营养成分等[11,12]。研究发现0.1%的AsA浸渍可以有效保护花椰菜的新鲜度,延长其货架期[13]。经过AsA浸渍处理的桃能够在贮藏期间有效抑制病害的发生率[14]。Hironaka等[15]也报道称真空浸渍可以提高马铃薯的 AsA含量。因此,采用浸渍是可以提高草莓中AsA含量的并对草莓的保鲜是有益的。
因此。本文采用真空浸渍和常压浸渍的方法提高草莓中AsA的含量,探讨两种方法浸渍AsA的效果,以及真空浸渍 AsA对草莓中不同天然叶酸的稳定性和质构影响,为草莓保鲜及果蔬中叶酸稳定性研究提供理论依据及参考。
1 材料与方法
1.1 材料与仪器
丹东红颜草莓购自暨南大学兴安超市;AsA、草酸、碘酸钾、盐酸、四氯化碳、醋酸铵、甲苯,天津市大茂化学试剂厂;大鼠血清,天津康源生物技术有限公司。
JJ5500型电子天平,常熟市双杰测试仪器厂;UV-9600紫外可见分光光度计,北京瑞丽分析仪器有限公司;封口机,得力集团有限公司;SHZ-DⅢ型循环水真空泵,巩义市予华仪器有限责任公司;Eppendorf58048心机,德国Eppendorf艾本德公司;KDC-1044低速离心机,科大创新股份有限公司中佳分公司;匀浆机,广州仪科实验室技术有限公司;生化培养箱,上海一恒科学仪器有限公司;电磁炉,美的集团股份有限公司;质构仪,美国博勒飞公司;超高效液相色谱仪-质谱仪(Ultra-High Performance Liquid Chromatography-Mass Spectrometry,UHPLC-MS/MS)、1290 Infinity Ⅱ-G6460C/SG,安捷伦。
1.2 实验方法
1.2.1 草莓浸渍处理
(1)常压浸渍将草莓两两一组放入真空袋中,各加入150 mL的质量分数为1%的AsA溶液,用封口机将袋子封口。室温、常压下分别放置10、20、30、40、50、60 min,共6组草莓。浸渍后将草莓取出,蒸馏水清洗,待草莓表面水渍自然风干后测定草莓的AsA含量。
(2)真空浸渍室温下,在500 mL抽滤瓶中放入草莓,加入1%(m/m)的AsA溶液。使用循环水真空泵将瓶中空气抽出,真空度达至0.09 MPa,草莓在此环境中浸泡10、20、30、40、50、60 min,共6组。浸渍后将草莓取出,蒸馏水清洗,待草莓表面水渍自然风干后。测定AsA含量及质构。
(3)浸渍草莓冷藏将批量草莓分两份,其中一份在真空度为0.09 MPa的环境中浸渍1%(m/m)的AsA溶液30 min,另一份不做任何处理作为对照组。将两组草莓按照冷藏天数分装在保鲜盒里,然后存放在4 ℃的冷库中,存放时间为0、2、4、6、8 d,每隔两天取出两组草莓,测定质构并提取叶酸。
1.2.2 AsA含量的测定
参照李向荣等[16]的碘酸钾萃取分光光度测定方法。称取5 g草莓,加入等质量2%的草酸,匀浆。使用 1%的草酸将匀浆液稀释至 25 mL,离心 10 min(5 500 r/min)。取1 mL上清液于10 mL离心管中。在每支离心管中再加入 0.1 mol/L的碘酸钾溶液和0.01 mol/L的盐酸溶液各1 mL,最后加入5 mL的四氯化碳,震荡 2 min,随后静置,分层。取上清液,以四氯化碳为空白对照,于520 nm处测定下层吸光度(可用纱布过滤絮状沉淀)并记录。
1.2.3 叶酸含量的测定
叶酸提取真空浸渍组和对照组称取3份样品,每份样品20 g,切碎放入玻璃锥形瓶,加入50 mL醋酸铵缓冲溶液(0.05 mol/L),匀浆,沸水浴10 min,冰浴至室温,加入3~4滴甲苯溶液,离心。取上清液5 mL加入200 μL的大鼠血清,37 ℃下酶解12 h。酶解后的溶液沸水浴 5 min,冷却至室温后离心 15 min(10 000 r/min,4 ℃)[17]。过0.22 μm水相滤膜加入进样小瓶。
叶酸测定方法参照Zou等[18]的方法,色谱条件:UHPLC分离使用配备二元泵、自动进样器、柱温箱和带有Thermo Accucore AQ色谱柱(100×2.1 mm)的脱气机在40 ℃下进行。流动相是0.1%甲酸(A)和乙腈(B)。其流速为0.3 mL/min。梯度如下:0~2 min,5%~20% B;2~4 min,20%~95% B;4~5 min,95% B;5~5.5 min,95%~5% B;5.5~7.5 min,5% B。自动进样器保持在4 ℃。
将UHPLC洗脱液引入Agilent 6460三重四极杆质谱仪。MS/MS仪器在ESI正离子模式中操作。设置如下:毛细管电压+3.5 kV,喷嘴电压+1 kV。电池加速器电压:+4 V。使用氮气作为雾化气体,压力为0.31 MPa,干燥气体流速为10 L/min,温度为320 ℃,鞘气流量为11 L/min,温度为380 ℃,雾化器压力为45 psi,停留时间为25 ms。Agilent Mass Hunter工作站用于控制设备以及数据采集和分析。四极杆分析仪以单位质量分辨率(0.7 u)以及宽(1.2 u)和最宽质量分辨率(2.5 u)运行。采集是通过选定的反应监测进行的,其中每个叶酸种类的相应假分子阳离子通过碰撞诱导解离而破碎。
1.2.4 草莓质构的测定
将如上1.2.1中(1)、(2)所示处理的样品,采用质构仪进行草莓的TPA测试,平行10次,将草莓沿着中心线切开,切面向下测定。测定条件为,置于TA39探头下做硬度的检测,每组样品测试10次,并取平均值。质构仪参数如下:测前速率1.0 mm/s;测试速率1.0 mm/s;测后速率5.0 mm/s;触发值5.0 g;压缩距离30%;数据采集速率400 pps。检测指标为第一循环硬度、硬度形变量、硬度形变百分比与压缩功循环[19]。
1.3 数据处理
采用SPSS 26.0软件对相关数据进行单因素方差分析(One-Way ANOVA);采用Excel 2020整理数据及绘制图表。每组数据三个平行样,结果以平均值±标准偏差表示。
2 结果与分析
2.1 浸渍方式对草莓中AsA含量的影响
浸渍过程中草莓的AsA含量的变化情况见图1。未处理的草莓AsA含量为0.40 mg/g,1 h后经常压浸渍和真空浸渍的草莓AsA含量分别达到1.17 mg/g和1.24 mg/g(p=0.03<0.05),且真空浸渍的速度更快。原因可能是真空浸渍可以压缩果蔬内的气体与液体[20],形成了空隙与通道,更有利于浸渍液体的渗入扩散过程。相比起常压浸渍,真空浸渍具有润湿机理、毛细现象和吸附作用三方面综合作用,因此传质速度更快,效率更高,也能够更好地保护产品品质。由表1可知,真空浸渍30 min过后草莓硬度开始出现降低的趋势,且 1 h后草莓质地有明显软化(p=0.04<0.05),所以综合选择真空浸渍30 min草莓进行叶酸稳定性和质构的研究。
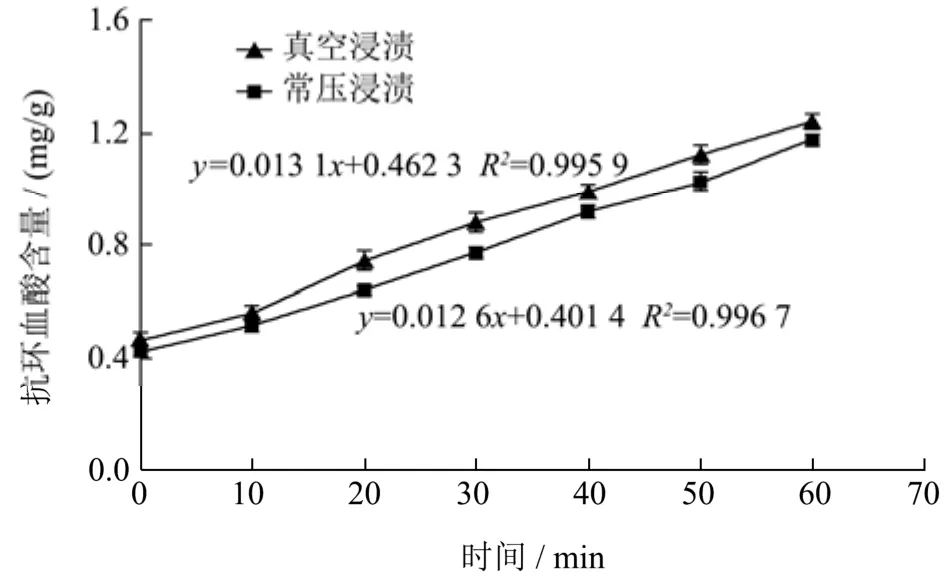
图1 常压浸渍和真空浸渍下草莓中AsA含量的变化Fig.1 Content of AsA in strawberry impregnated at atmospheric pressure and vacuum environment
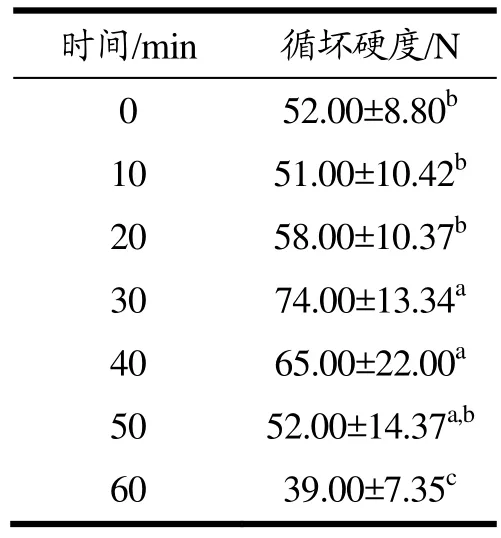
表1 草莓在真空浸渍过程中的质构变化情况Table 1 Texture changes of strawberries during vacuum maceration
2.2 真空浸渍对叶酸稳定性的影响
2.2.1 草莓中的叶酸含量及种类
据研究,草莓中的总叶酸含量在10~350 μg/100 g不等[18,20,21,23],草莓中叶酸浓度受各种因素影响,如种植条件(季节和气候)、农艺条件、地点、品种和收获年份[23-26]。提取方法和分析方法也可能影响获得的叶酸总含量。经前期测定本实验所用草莓的叶酸总含量在100~128 μg/100 g,其主要叶酸种类为5-甲基四氢叶酸,四氢叶酸、5,10-亚甲基四氢叶酸,同时还含有叶酸的降解产物对氨基苯甲酸(图2)。Vahteristo等[27]报道草莓中叶酸种类主要为5-甲基四氢叶酸和四氢叶酸,其中5-甲基四氢叶酸占总叶酸的65.00%。Octavia等[7]也证实草莓中还含有少量的10-甲酰基四氢叶酸、5-甲酰基四氢叶酸以及5,10-亚甲基四氢叶酸。因此,本文结果与前期研究发现基本一致。
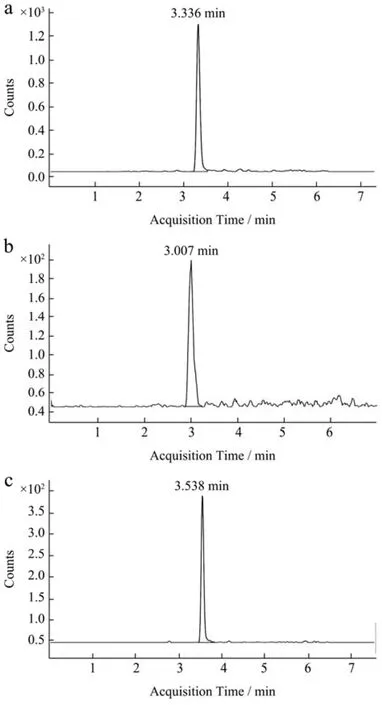
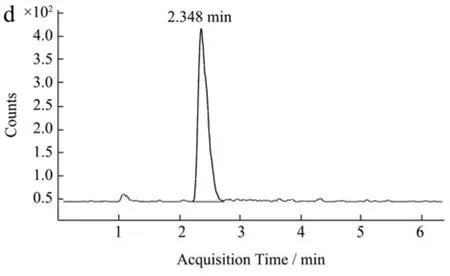
图2 不同天然叶酸质谱图Fig.2 Mass spectra of different folic acid forms
2.2.2 真空浸渍对冷藏期间草莓叶酸稳定性及对氨基苯甲酸的影响
真空浸渍组和对照组草莓经4 ℃储藏8 d对三种叶酸及对氨基苯甲酸含量的变化见图3。对照组与浸渍组的四氢叶酸含量在储藏过程中都是处于一个下降的趋势(图3a),但对照组在第 2 d就下降了27.25%,第8 d下降了42.51%,而浸渍组在第8 d只损失了7.70%。可见,真空浸渍可以提高四氢叶酸的稳定性。
5-甲基四氢叶酸在储藏前期的时候含量上升且都在存放的第4 d出现峰值(图3b),对照组和浸渍组分别上升了24.47%和12.67%。四氢叶酸可以在丝氨酸羟甲基转移酶的作用下先生成5,10-亚甲基四氢叶酸,再在亚甲基四氢叶酸还原酶的作用下生成5-甲基四氢叶酸[8]。推测这可能就是 5-甲基四氢叶酸前期出现上升的原因。对照组的5-甲基四氢叶酸生成更快,原因可能是对照组的四氢叶酸降解速度更快(图3a)且对照组的合成前体对氨基苯甲酸含量更高(图3d)。4 d后5-甲基四氢叶酸开始下降,推测是因为后期草莓组织结构变化较大,5-甲基四氢叶酸作为水溶性物质随着汁液一起开始流失。
5,10-亚甲基四氢叶酸在两组样品的冷藏过程中变化不显著(p>0.05)(图3c),浸渍组和对照组在7 d后分别下降至 21.61 ng/g(p=0.46>0.05)和18.95 ng/g(p=0.07>0.05),无明显差异。Veerle等[28]报道,5,10亚甲基四氢叶酸主要在pH值为3~9的热处理不稳定,可转化为 5-甲酰基四氢叶酸。因此在4 ℃的冷藏环境下,5,10-亚甲基四氢叶酸表现出较好的稳定性。
对氨基苯甲酸在储存过程中出现缓慢上升的趋势(图3d),在第8 d的时候对照组和真空浸渍组分别上升了77.89%和57.13%。这种小幅度的上升趋势推测可能是因为四氢叶酸发生降解,C9-N10键经自发氧化或光氧化断裂,致使对氨基苯甲酸在储存过程中出现小幅度的上升。因此,真空浸渍AsA能提高四氢叶酸稳定性,从而减少对氨基苯甲酸降解产物的产生。
总叶酸的变化趋势(图3e)与5-甲基四氢叶酸的变化趋势基本一致。其原因应是5-甲基四氢叶酸所占总叶酸比例较大。且可以明显的观察到的是与初始含量相比冷藏8 d后的草莓总叶酸的含量是处于一个比较稳定状态。
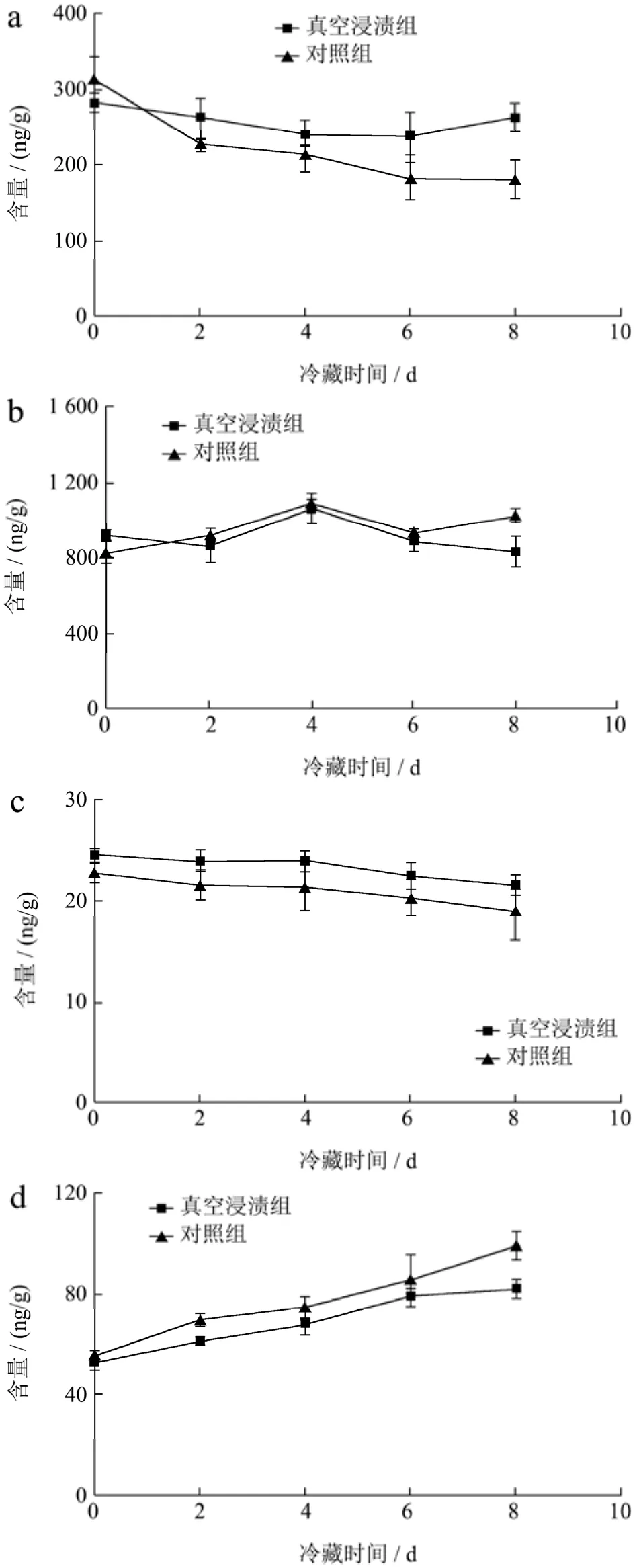
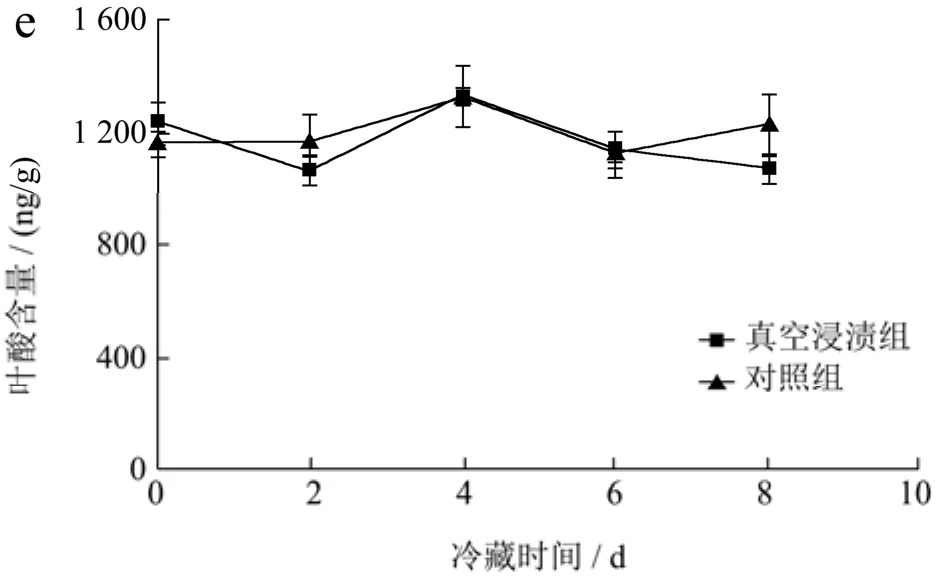
图3 叶酸在冷藏过程中含量的变化Fig.3 Changes in folic acid content during cold storage
2.3 真空浸渍对草莓在冷藏期间质构的影响
草莓在0~6 d的冷藏中(表2),真空浸渍组的硬度都要略大于对照组,但无明显差异。在第8 d时,真空浸渍的草莓硬度(92.60 N)明显(p=0.02<0.05)大于对照组的硬度(57.20 N)。冷藏中草莓仍保持一定果胶酶纤维素酶活性[29],导致了对照组草莓质地软化,而浸渍AsA则有一定降低软化速率的作用,其机理可能是AsA可以抑制相关酶的活性,从而降低了果胶水解速度[29]。

表2 草莓在冷藏过程中的质构变化情况Table 2 Changes in texture of strawberries during cold storage
3 结论
经常压浸渍、真空浸渍(真空度0.09 MPa)两种不同的浸渍方法处理草莓,在1 h后AsA含量分别达到1.17和1.24 mg/g(p=0.03<0.05),因此真空浸渍AsA的效果更好。经测定,草莓中的总叶酸含量为100至128 μg/100 g,主要叶酸种类为5-甲基四氢叶酸,四氢叶酸以及5,10-亚甲基四氢叶酸,同时还检测到了叶酸降解产物对氨基苯甲酸。将真空浸渍组与对照组草莓冷藏8 d,结果表明,真空浸渍组的四氢叶酸下降了7.70%,对照组下降了42.51%。两组对氨基苯甲酸都出现一定程度的增加。5,10-亚甲基四氢叶酸在草莓的储藏过程中表现出较好的稳定性。5-甲基四氢叶酸存放的第4 d均出现峰值,对照组上升了24.47%,浸渍组上升了12.67%,冷藏后期5-甲基四氢叶酸开始下降。因此,草莓的四氢叶酸在冷藏过程中极不稳定,但真空浸渍AsA可以有一定抑制降解作用。质构结果显示在第8 d时真空浸渍组的草莓硬度明显高于对照组。因此,经真空浸渍AsA对草莓有一定的硬化作用。目前未有研究清楚表明 AsA浸渍可以提高四氢叶酸的稳定性,因此本研究为草莓等生鲜水果的保鲜以及为提高果蔬中不同种类叶酸的稳定性提供了理论依据和参考。

