兜唇石斛发酵多肽Asp-Asp-Asp-Tyr和Asp-Tyr-Asp-Asp对LPS诱导RAW264.7细胞的抗炎作用
梁楚容,王琴,肖更生,马路凯,2,吴晖,肖建波,刘袆帆*
(1.仲恺农业工程学院轻工食品学院,广东省岭南特色食品科学与技术重点实验室,广东广州 510225)(2.西藏农牧业科学院农产品开发与食品研究所,西藏拉萨 850000)(3.华南理工大学食品科学与工程学院,广东广州 510640)(4.西班牙维戈大学食品科学与技术学院,西班牙加利西亚自治区 36310)
炎症是各种致炎因子入侵时机体和受损细胞的自我保护反应,炎症在机体内具有双重作用,适度的炎症反应有利于机体自我调控,但过度的炎症反应会引起机体的不良反应并且会引发其他疾病的产生[1]。研究表明多肽具有抗氧化、抗炎症及免疫调节等多种生理活性[2]。多肽主要由2~20个氨基酸以不同的排列顺序组成,因氨基酸的种类、数量和排列顺序等存在差异,从而使得不同多肽的生理活性存在很大的差异[3]。梁秋芳[4]发现玉米蛋白酶解制备生物活性肽具有抗氧化活性并对结肠炎具有良好的抗炎效果,而且在血管内皮细胞模型具有良好的抗炎活性。武文佳[5]利用小麦胚芽蛋白中提取得到具有良好免疫调节功能的活性肽,经凝胶层析后得到的多肽组分可显著降低LPS诱导的RAW264.7细胞促炎因子(NO、IL-6和TNF-α)的分泌量,具有抗炎的效果。Ssa等[6]首次报道了体外胃肠道消化释放的发芽苋菜活性肽,发现其中抗氧化活性最高的分解组分对LPS诱导RAW264.7巨噬细胞具有较高的抗炎作用,也可称为抗炎肽。可见,从植物中提取得到的活性肽段具有一定的研究价值。目前对兜唇石斛这类药食同源植物的研究较少,对兜唇石斛中发酵多肽的报道就更少了。
兜唇石斛(Dendrobium aphyllum),为兰科石斛属附生植物,是药用范围较广的中药[7]。刘袆帆[8]选用一种乳酸杆菌对兜唇石斛进行固态发酵,选取其中活性最强小于1 ku的多糖组分,经DEAE纯化后得到一个肽段组分,后经 LC-TOF/MS-MS分析发现组成的肽分子序列含有:Asp-Asp-Asp-Tyr (DDDY)、Asp-Asp-Tyr-Asp (DYDD)、Met-Ala-Lys (MAK)等。发酵多肽DDDY和DYDD等具有天然可靠、无毒无害等优点,本课题组前期对这些多肽分子做了大量的研究,Liu等[9]通过量子化学理论计算,发现 DYDD上的O58-H59和DDDY上的N10-H12为抗氧化活性位点,对AAPH诱导的HepG2细胞在细胞内和细胞外起到保护作用,通过对自由基进行直接清除,而不是激活Nrf2/Keap1信号通路,从另一个角度来解释细胞抗氧化机制。刘映君等[10]对其中一条肽MAK的抗菌机理进行了研究,发现MAK可以抑制铜绿假单胞菌的生长,起到抑菌的作用。另外 Zhuang等[11]利用代谢组和转录组结合分子动力学模拟进行分析,发现DDDY对铜绿假单胞菌的抑菌作用与膜转运、氨基酸代谢通路和DDDY的n端c端氨基酸残基有关。
基于本课题组前期对兜唇石斛发酵多肽在抗氧化和抑菌方面开展了深入的研究,为继续探明发酵多肽在其他生理活性的作用,特别是抗炎症方面的探究。考虑到DDDY和DYDD具有相似的氨基酸组成,本研究以合成的DDDY和DYDD为研究对象,采用脂多糖(Lipopolysaccharides,LPS)刺激RAW264.7巨噬细胞构建体外炎症模型,以一氧化氮(Nitric Oxide,NO)和细胞因子白介素(Interleukin,IL)-1β、IL-6、IL-10 和肿瘤坏死因子-α(Tumor Necrosis Factor-α,TNF-α)为炎症指标,探究DDDY和DYDD的体外抗炎活性,明确发酵多肽对LPS诱导的RAW264.7细胞炎症是否有缓解作用,为下一步深入研究两条发酵多肽的抗炎机制提供研究基础。
1 材料与方法
1.1 原料
1.1.1 材料与试剂
发酵多肽 Asp-Asp-Asp-Tyr(DDDY)和Asp-Tyr-Asp-Asp(DYDD)是本课题组刘袆帆通过乳酸杆菌固态发酵兜唇石斛得到多糖组分,后经DEAE纯化后得到肽段DPP,最后经LC-TOF/MS-MS分析发现的多肽分子序列。本研究使用的发酵多肽DDDY、DYDD由上海科多肽生物技术有限公司(中国上海)按照发现的分子序列合成;脂多糖(Lipopolysaccharides,LPS)、噻唑蓝(Methyl Thiazolyl Tetrazolium,MTT)、二甲基亚砜(Dimethyl Sulfoxide,DMSO)购自Sigma-Aldrich公司(St.Louis, MO, USA);胎牛血清(FBS)、青霉素和 DMEM(Dulbecco's Modified Eagle Medium)培养基购自 Gibco公司(Carlsbad, CA, USA)。中性红细胞染色液,购自上海源叶生物技术有限公司;一氧化氮(Nitric Oxide,NO)试剂盒、白介素(Interleukin,IL)-1β试剂盒、IL-6、IL-10试剂盒、肿瘤坏死因子-α(Tumor Necrosis Factor-α,TNF-α)试剂盒,购自Mibio酶联生物科技有限公司。
1.1.2 主要仪器设备
海尔超净工作台,上海海尔仪器设备有限公司;TECAN连续多功能酶标仪,美国Thermo公司;倒置显微镜,德国Leica公司;台式多功能离心机,德国Eppendorf公司;二氧化碳培养箱,美国Thermo公司。
1.2 方法
1.2.1 细胞培养
小鼠单核巨噬细胞系RAW264.7于DMEM高糖培养基(含体积分数10%胎牛血清和1%双抗)中培养,37 ℃、φ=5% CO2培养箱中孵育,待细胞贴壁生长密度至80%左右进行传代,选取对数生长期细胞进行实验,分为空白对照组、试验组和LPS组。
1.2.2 MTT细胞增殖实验
参考胡梦君[12]的方法,稍作修改。以每毫升5×104个细胞的密度将细胞置于96孔板中,37 ℃、φ=5% CO2培养箱培养24 h至细胞贴壁后弃去培养液。空白对照组加入100 μL完全培养液,试验组加入100 μL不同质量浓度(12.5、25、50、100、200、400 μg/mL)的发酵多肽溶液,LPS组加入1 μg/mL的LPS 100 μL作为阳性对照,每组设置3个平行孔。37 ℃、φ=5% CO2培养箱培养24 h后弃去96孔板中的培养液,每孔加入0.5%的MTT试剂200 μL,放入37 ℃、φ=5% CO2培养箱培养 4 h,弃去孔内液体,每孔加入 DMSO 150 μL,酶标仪中低速震荡15 min使蓝紫色晶体充分溶解,于490 nm波长处检测各孔OD值。根据OD值和公式(1)计算每孔细胞的存活率,以此判断 LPS和发酵多肽对细胞存活率(A,%)的影响。
式中:
A——细胞存活率,%;
OD0——空白孔OD值;
OD1——对照组OD值;
OD2——实验组OD值。
1.2.3 中性红吞噬作用评价
参照Yu等[13]的方法,稍作修改。细胞培养方法和处理方法同1.2.2,结束后弃去培养液,空白对照组仅加入150 μL红细胞裂解液,其余各组加入质量分数0.075%中性红溶液100 μL,继续培养1 h后弃去中性红溶液,用PBS清洗2次,加入150 μL红细胞裂解液,在540 nm波长处检测各孔吸光度值(OD),根据公式(2)计算细胞的相对吞噬率。

式中:
B——相对吞噬率,%;
OD3——空白组OD值;
OD4——实验组OD值。
1.2.4 光学显微镜对RAW264.7细胞的形态观察
(1)细胞培养方法:同1.2.2。
(2)细胞处理分组:PBS清洗过后96孔板细胞中,空白对照组加入100 μL的完全培养液,试验组先加入1 μg/mL的LPS,后加入50 μg/mL的DDDY或50 μg/mL 的DYDD 共100 μL,LPS组加入 100 μL 1 μg/mL 的 LPS。37 ℃、5% CO2培养箱培养 24 h。
(3)细胞观察:光学显微镜下对空白对照组、试验组和LPS组的细胞进行观察,调整视野,放大 10倍比较细胞形态差异。
1.2.5 对细胞信号物质NO分泌的影响
参照胡梦君[12]的方法,稍作修改。以每毫升1×106个细胞的密度将细胞置于24孔板中,37 ℃、5% CO2培养箱培养24 h至细胞贴壁后弃去培养液。按照1.2.4的分组方法设计空白对照组、试验组和LPS组,每孔0.5 mL,每组设置3个平行孔。37 ℃、5% CO2培养箱培养24 h。培养结束后,将孔板中的细胞培养液转入离心管,2 500 r/min离心10 min后收集细胞上清液。采用ELISA试剂盒测定细胞上清液的NO水平。
1.2.6 RAW264.7 细胞TNF-α、IL-1β、IL-6 和IL-10分泌量的影响
细胞培养与处理方法同1.2.5中,培养结束后吸取培养液,采用ELISA试剂盒测定TNF-α、IL-1β、IL-6和IL-10分泌量的水平。
1.3 数据分析
每个处理做3次重复试验,数据采用SPSS 25.0对实验数据进行单因素方差分析,结果以平均值±标准差(mean±SD)表示,以 Duncan多边检验对实验均值进行差异显著分析(p<0.05),用Origin 2018对分析数据作图。
2 结果与讨论
2.1 DDDY和DYDD对RAW264.7细胞活力的影响
单核-巨噬细胞在机体免疫体系中扮演着非常重要的角色,RAW264.7巨噬细胞受到脂多糖刺激后构建的体外炎症模型,通过检测其各个炎症指标的变化,从而探究阐明该药物的抗炎效果及作用机制[14]。但是药物的毒性会抑制细胞增殖,进而影响细胞炎性因子分泌量,会降低对药物抗炎效果判断的准确性,MTT法是检测细胞活性常用的方法,结果可以反映药物对细胞的毒性大小[15]。
因此,本研究首先采用 MTT法考察不同质量浓度发酵多肽(DDDY和DYDD)对RAW264.7巨噬细胞活性的影响。图1反映的是不同质量浓度的DDDY和DYDD作用于RAW264.7小鼠巨噬细胞24 h后细胞的活性情况。从图可以看出,一定质量浓度范围的DDDY和DYDD能显著(p<0.05)促进RAW264.7细胞的增殖,并且1 μg/mL的 LPS处理可以明显地(p<0.05)促进细胞的活性。不同质量浓度 DDDY溶液对RAW264.7细胞的增殖影响如图1a所示,当DDDY质量浓度在12.5~100 μg/mL范围内,随着质量浓度的增加,细胞的存活率也明显增加,证明此质量浓度范围增强了细胞的增殖率。但是当质量浓度超过100 μg/mL,细胞的活性下降,最低下降到87.23%。不同质量浓度DYDD溶液对细胞的增殖作用如图1b所示,与空白对照组(细胞存活率为100.00%)相比,DYDD质量浓度在12.5~100 μg/mL范围内细胞活性维持在 100.40%~126.08%之间;质量浓度在 200~400 μg/mL 范围内,细胞的存活率显著降低(p<0.05)。结果表明,12.5~100 μg/mL的 DDDY和 DYDD对RAW264.7小鼠巨噬细胞无显著毒性,故选取12.5、25、50和100 μg/mL四种质量浓度的两种发酵多肽分别作为后续试验的试验组。选取对细胞无毒性的1 μg/mL作为构建炎症模型的 LPS刺激质量浓度,这个 LPS质量浓度也是炎症模型常用的质量浓度[16,17]。

图1 不同质量浓度DDDY(a)和DYDD(b)对RAW264.7细胞的增殖影响Fig.1 Effects of different concentrations of DDDY (a) and DYDD (b) on proliferation of RAW264.7 cells
2.2 DDDY和DYDD对RAW264.7细胞吞噬能力的影响
吞噬能力是巨噬细胞的一个重要功能,吞噬能力的增强是巨噬细胞活化的一种表现[18],吞噬能力的大小可以反映出细胞的活性的高低[19],而中性红吞噬实验就是用来研究细胞的吞噬能力的。所以,接下来本研究采用中性红吞噬实验来研究DDDY和DYDD对细胞吞噬率的影响。图2反映的是不同质量浓度的DDDY和DYDD对RAW264.7细胞吞噬能力的影响,不同质量浓度的DDDY对细胞的相对吞噬率如图2a所示,质量浓度在 12.5 μg/mL~100 μg/mL范围内,DDDY能显著增强细胞的吞噬作用(p<0.05),而且随着质量浓度的增加,细胞的吞噬能力越强,其中100 μg/mL DDDY处理组的细胞吞噬能力比空白对照组的上升1.05倍;同时如图2b所示不同质量浓度DYDD对细胞的吞噬能力,与空白对照组相比,DYDD能显著提高细胞的吞噬能力(p<0.05),四个质量浓度DYDD处理组的细胞吞噬能力在 1.75%~1.97%之间,无明显差异。从图中也可以看出,1 μg/mL的LPS处理也能提高RAW264.7细胞的吞噬能力,此研究结果与王洁[18]不同质量浓度的林蛙骨肉小肽促进RAW264.7细胞吞噬能力的研究相似。结果表明,12.5、25、50和100 μg/mL四个质量浓度的DDDY和DYDD和1 μg/mL LPS处理可以激活RAW264.7细胞,显著增强细胞的吞噬能力。猜测可能此质量浓度的发酵多肽和LPS可以很好的与RAW264.7细胞表面的特异性受体结合,对细胞进行活化,活力高的巨噬细胞吞噬能力增强,进而细胞的杀菌功能抗炎功能显著上调。

图2 不同质量浓度的DDDY(a)和DYDD(b)对RAW264.7细胞吞噬能力的影响Fig.2 Effects of different concentrations of DDDY (a) and DYDD (b) on phagocytosis of RAW264.7 cells
2.3 RAW264.7细胞形态的光学显微镜观察
RAW264.7作为一种在微生物学免疫学等中常用的试验性细胞,具有很强的粘附能力和抗原吞噬能力,作为类单核细胞,它的理想形态应该是小圆而透亮,较少伪足和类似“触角”样的东西[14]。倒置显微镜 10倍镜下观察不同处理组中RAW264.7细胞的形态,如图3所示分别为空白对照组、LPS处理组、DDDY作用组、DYDD作用组。空白对照组中RAW264.7细胞形态正常,呈正常圆形或者椭圆形,细胞之间紧密接触生长(图3a);LPS刺激后RAW264.7细胞出现分支情况,细胞触角分明,细胞间距明显增大,多数细胞没有紧密连接在一起(图3b);DDDY和DYDD分别与LPS共作用于RAW264.7细胞后,分支状细胞明显减少,大部分细胞形态为圆形或椭圆形,细胞恢复正常形态(图3c和图3d)。
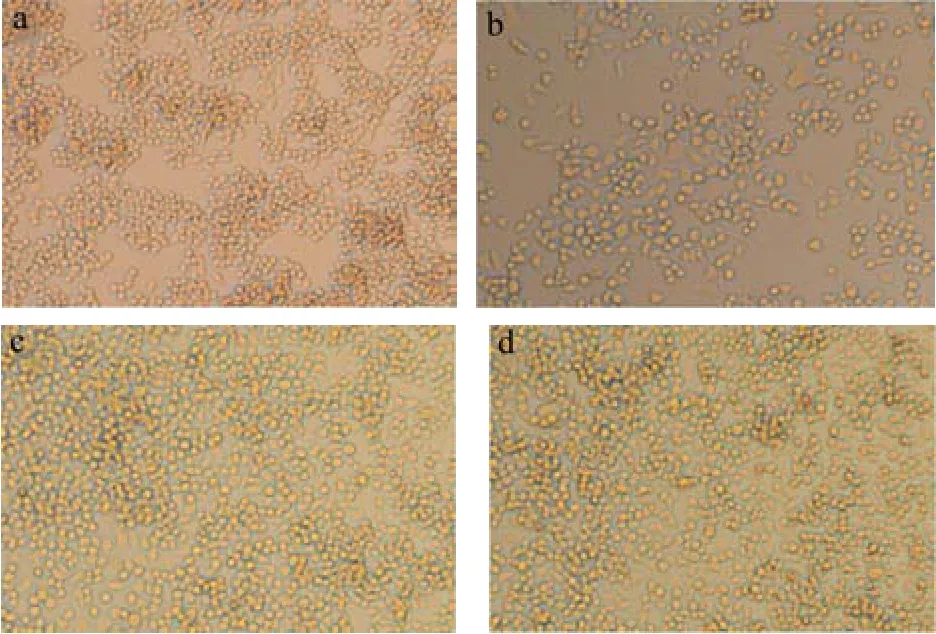
图3 不同处理下的RAW264.7细胞光学显微镜形态(10×):空白对照组(a)、LPS处理组(b)、DDDY+LPS处理组(c)、DYDD+LPS处理组(d)Fig.3 Optical microscope morphology of RAW264.7 cells under different treatments (10×): Blank control group (a), LPS treatment group (b), DDDY+LPS treatment group (c),DYDD+LPS treatment group (d)
根据显微镜对细胞形态的观察,可知,1 μg/mL的LPS可成功诱导RAW264.7细胞产生炎症,使巨噬细胞形态有明显分化,形成了许多伪足,出现不规则的圆形,这样与蛋白样品接触面积增加,这也可能是LPS增强了巨噬细胞的吞噬能力的原因;而50 μg/mL的DDDY和50 μg/mL的DYDD发酵多肽处理后可有效抑制细胞分化,改善LPS诱导的巨噬细胞形态,缓解细胞的炎症反应,促进细胞增殖。猜测可能是发酵多肽的加入,占据巨噬细胞表面上的某种特定识别受体,使LPS与细胞的接触减少或者功能减弱,从而缓解了LPS对巨噬细胞的过度刺激,改善RAW264.7细胞的形态。这些研究结果与陈磊研究的山梨酸对LPS诱导的RAW264.7细胞形态的变化具有较好的保护作用[1]和王洁研究的林蛙骨肉小肽对RAW264.7细胞形态恢复正常并且有增殖的结果相似[18]。
2.4 DDDY和DYDD对RAW264.7细胞NO分泌量的影响
LPS可诱导巨噬细胞释放NO、IL-1s等多种炎症因子,其中NO可经一氧化氮诱导合酶iNOS催化可短时大量生成,可以通过测定其含量反映炎症发生的程度[20]。由图4可知,不同处理组的NO分泌量有显著的差异(p<0.05),LPS处理组的NO分泌量高于其他处理组,这是因为巨噬细胞受LPS刺激,影响了机体中iNOS的表达,进而影响了NO的生成量[21]。如图4a所示,与LPS处理组对比,DDDY处理降低了 NO 的分泌量,而且质量浓度在 12.5 μg/mL~100 μg/mL范围内呈剂量依懒性,LPS处理组NO分泌量为100 μg/mL DDDY处理质量浓度的2.46倍;由图4b可以看出,不同质量浓度 DYDD处理组的NO生成量显著高于空白组(p<0.05),低于LPS组(p<0.05),其中 12.5 μg/mL DYDD 处理组为空白对照组的 16.28倍,两种发酵多肽对 RAW264.7细胞NO分泌量的刺激呈剂量相关性。
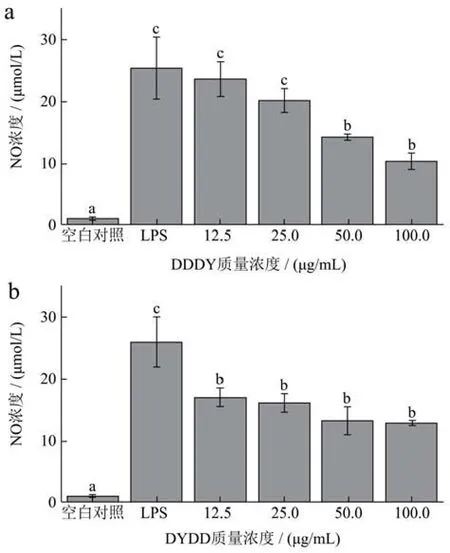
图4 不同质量浓度的DDDY(a)和DYDD(b)对RAW264.7细胞NO分泌量的影响Fig.4 Effects of different concentrations of DDDY (a) and DYDD (b) on NO secretion in RAW264.7 cells
NO分泌量是炎症反应中重要的促炎分子,细胞NO的分泌量可间接反映炎症发生的程度[22],因此,药物对炎症反应的作用可通过测定NO的含量高低来进行判断。结果表明,LPS处理能增加细胞NO的分泌,添加四种质量浓度的DDDY和DYDD处理后,能对细胞NO的分泌产生抑制作用,使NO的分泌量明显下降,起到抗炎作用。我们猜测发酵多肽的加入影响了细胞中与iNOS表达的相关蛋白的产生,从而影响了NO的分泌,改善了LPS对巨噬细胞的过度刺激,降低了细胞的炎症程度,同时证明活性发酵多肽能对细胞起到抗炎的效果,He等[23]表明小米糠生物活性肽在LPS诱导的RAW264.7巨噬细胞以剂量依赖的方式显著降低NO的产生。这与与本试验结果相似。
2.5 DDDY和DYDD对细胞因子分泌量的影响
研究发现,当巨噬细胞受到外界抗原刺激时(如LPS)会释放TNF-α、IL-1β、IL-6、IL-10等重要的细胞因子[24,25]。其中促炎细胞因子如 TNF-α、IL-1β、IL-6等可与抑炎细胞因子IL-10等相互影响,共同发挥对炎症的调节作用[12]。为更全面地对 DDDY和DYDD的体外抗炎效果进行研究,以 LPS诱导RAW264.7巨噬细胞作为体外抗炎模型,分别探究四个质量浓度的DDDY和DYDD对细胞分泌因子分泌量的影响。
2.5.1 TNF-α分泌量
TNF-α能够诱导其它免疫因子的分泌,TNF-α具有上调iNOS的表达,促进NO的生成,所以通常被选为药物对巨噬细胞免疫调节作用的指标[24]。如图5实验结果所示,LPS诱导RAW264.7巨噬细胞24 h后,与空白对照组相比,LPS处理组的TNF-α分泌量显著升高(p<0.05),当用不同质量浓度的DDDY和DYDD作用后,TNF-α分泌量明显下降。DDDY处理后如图5a所示,与LPS处理组相比,随着DDDY质量浓度升高,TNF-α分泌量越低,当经100 μg/mL DDDY处理后,TNF-α分泌量下降到 86.73 pg/mL。12.5~100 μg/mL质量浓度范围的DYDD处理后如图5b所示,TNF-α的分泌量降低到LPS处理组的0.68~0.86倍,随着DYDD质量浓度的升高而抑制更多,表现出质量浓度依赖性。Yang等[26]表明车前花乙醇提取物对LPS刺激的RAW264.7巨噬细胞中TNF-α分泌有较强的抑制作用。He等[23]发现谷糠发酵多肽能显著降低LPS诱导的RAW264.7细胞中TNF-α等炎症因子的水平。我们的研究结果与前人的研究结果相似,结果表明,DDDY和 DYDD能显著降低 LPS诱导的RAW264.7细胞中TNF-α的分泌量,并且发酵多肽的质量浓度越高TNF-α分泌量越低,均具有质量浓度依赖性。我们猜测,由于发酵多肽的介入,影响了LPS诱导的炎症模型细胞中促炎症因子 TNF-α合成蛋白或基因的表达,导致TNF-α分泌量下降,下调了iNOS的表达,进而影响NO的生成。这也解释了DDDY和DYDD处理后RAW264.7细胞中TNF-α分泌量的变化趋势与NO分泌量相似。

图5 不同质量浓度的DDDY(a)和DYDD(b)对RAW264.7细胞TNF-α分泌量的影响Fig.5 Effects of different concentrations of DDDY (a) and DYDD (b) on TNF-α secretion in RAW264.7 cells
2.5.2 IL-1β分泌量
IL-1β作为一种关键的促炎细胞因子,参与多种自身免疫性炎症反应和多种细胞活动[27]。不同质量浓度的DDDY和DYDD对RAW264.7细胞IL-1β分泌量的影响如图6所示,空白对照组的IL-1β分泌量均比较低,经过LPS刺激后,LPS处理组的 IL-1β释放量明显升高(p<0.01),当采用 12.5、25、50、100 μg/mL质量浓度的DDDY和DYDD分别处理后,IL-1β分泌量逐步降低(p<0.05)。不同质量浓度的 DDDY 对RAW264.7细胞 IL-1β分泌量影响如图6a所示,100 μg/mL质量浓度的DDDY处理后,IL-1β分泌量下降至原来的 0.51倍;不同质量浓度的 DYDD对RAW264.7细胞IL-1β分泌量影响如图6b所示,随着DYDD处理质量浓度越高,IL-1β分泌量越低,显现出明显的剂量效应关系。结果表明,DDDY和DYDD能显著降低LPS诱导的RAW264.7细胞中IL-1β的分泌量,其中两种发酵多肽的质量浓度在100 μg/mL时,IL-1β分泌量显著降低。He等[23]发现小米糠活性肽能显著降低LPS诱导的RAW264.7细胞中IL-1β等炎症因子的水平。Kim等[28]发现蓼乙醇提取物可下调 LPS刺激的RAW264.7巨噬细胞中促炎介质如NO和细胞因子IL-1β的表达。这些结果与我们的试验结果相似。

图6 不同质量浓度的DDDY(a)和DYDD(b)对RAW264.7细胞IL-1β分泌量的影响Fig.6 Effects of different concentrations of DDDY (a) and DYDD (b) on IL-1 βsecretion in RAW264.7 cells
2.5.3 IL-6分泌量
IL-6是一种重要的促炎细胞因子,在炎症的发病机制中起重要的作用[29]。不同质量浓度的 DDDY和DYDD对RAW264.7细胞IL-6分泌量的影响如图7所示,LPS诱导RAW264.7巨噬细胞24 h后,与空白对照组相比,LPS处理组中 IL-6分泌显著增加(p<0.01),当逐渐增加DDDY和DYDD两种发酵多肽的作用质量浓度后,IL-6分泌量降低,并且呈依赖性。由图7a可知,经过100 μg/mL DDDY处理后,与 LPS处理组对比,IL-6分泌量下降 1.67倍;由图7b可知,经过四种质量浓度的DYDD处理后,与LPS处理组对比,IL-6分泌量下降1.28~1.76倍。结果表明,DDDY和 DYDD能显著降低 LPS诱导的RAW264.7细胞中IL-6的分泌量,对巨噬细胞的过度刺激有作用进而对炎症反应有作用。这与Hong等[30]发现的脐带菌显著抑制LPS刺激的RAW264.7细胞中NO、PGE2和IL-6的产生,显著抑制LPS刺激的炎症反应结果相似。IL-6作为一种促炎细胞因子,发酵多肽处理后的 RAW264.7细胞的分泌量变化趋势与TNF-α和IL-1β相似,我们猜测发酵多肽对LPS诱导的细胞影响与促炎因子相关基因表达受到干扰有关。

图7 不同质量浓度的DDDY(a)和DYDD(b)对RAW264.7细胞IL-6分泌量的影响Fig.7 Effects of different concentrations of DDDY (a) and DYDD (b) on IL-6 secretion of RAW264.7 cells
2.5.4 IL-10分泌量
IL-10是一种多细胞源、多功能的细胞因子,调节细胞的生长与分化,参与炎症反应和免疫反应,是公认的炎症中的抑炎与免疫抑制因子[31]。不同质量浓度的DDDY和DYDD对RAW264.7细胞IL-10分泌量的影响如图8所示,LPS诱导细胞24 h后,IL-10分泌量明显降低,与空白对照组相比有显著性差异(p<0.01)。12.5、25、50、100 μg/mL质量浓度DDDY和DYDD作用于LPS诱导后的细胞,IL-10 质量浓度逐渐升高,与LPS处理组相比均有显著性(p<0.01)。由图8a可知,经过100 μg/mL DDDY处理后,与LPS处理组对比,IL-10含量上升到原来的 2.52倍;由图8b可知,经过四个质量浓度的DYDD处理后,IL-10分泌量为LPS处理组的1.52~2.73倍。结果表明,DDDY和DYDD能显著升高LPS诱导的RAW264.7细胞中IL-10的分泌量,对炎症反应有作用。结果与Kim等[32]对绿头仙鹤根提取物在LPS诱导炎症反应中的抗炎作用IL-10分泌量变化相似。
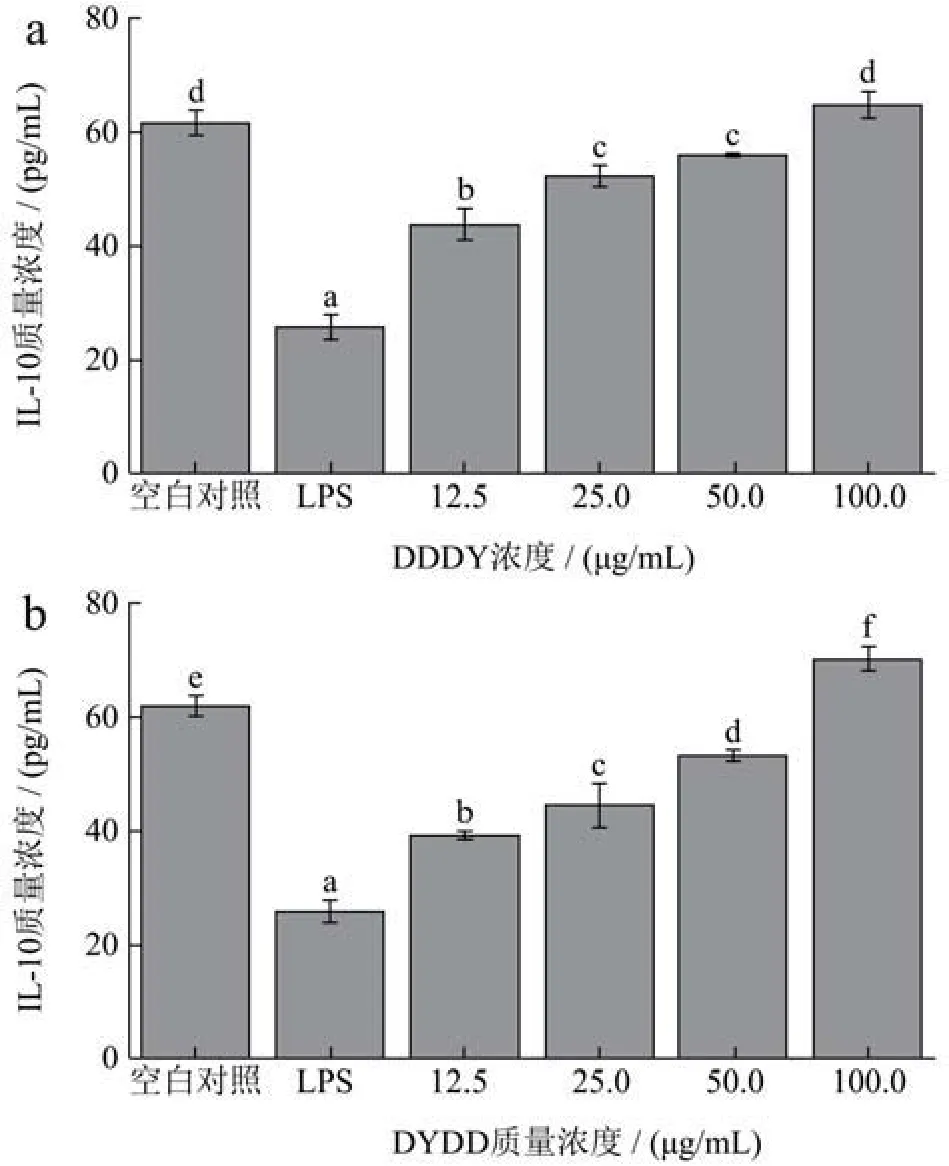
图8 不同质量浓度的DDDY(a)和DYDD(b)对RAW264.7细胞IL-10分泌量的影响Fig.8 Effects of different concentrations of DDDY (a) and DYDD (b) on IL-10 secretion in RAW264.7 cells
LPS为革兰氏阴性菌产生的病原体,具有激活巨噬细胞的作用[33]。LPS诱导RAW264.7小鼠巨噬细胞是体外抗炎研究中常用的炎症模型,活化后的RAW264.7细胞的吞噬能力明显增强,且能分泌大量生物活性物质如NO和多种细胞因子如TNF-α、IL-1β、IL-6等[34];因此,巨噬细胞NO及相关细胞因子的分泌量可作为评价DDDY和DYDD是否具有激活巨噬细胞从而起到抗炎功效的试验依据。
有研究报道细胞因子如TNF-α和IL-6可通过激活 NF-κB和 MAPK等信号通路的关键蛋白引发炎症[35]。本实验结果表明,与空白对照组的RAW264.7细胞相比,LPS刺激后细胞因子TNF-α、IL-1β和IL-6的分泌量均有明显提高,与LPS处理组比较,不同质量浓度的DDDY和DYDD处理能不同程度地抑制促炎细胞因子TNF-α、IL-1β和IL-6的分泌。但与空白对照组相比,LPS刺激后细胞中的抑炎因子IL-10质量浓度显著降低,与 LPS组相比,不同质量浓度的DDDY和DYDD作用后细胞中IL-10的质量浓度均有显著升高。根据TNF-α、IL-1β、IL-6和IL-10等细胞因子含量的测定,一定质量浓度的DDDY和DYDD处理可有效抑制RAW264.7细胞中促炎细胞因子的分泌,同时促进抑炎因子的分泌,由此缓解LPS诱导产生的细胞炎症反应的发生。这与胡梦君[12]的研究结果相符。
3 结论
综上所述,适度浓度的兜唇石斛发酵多肽Asp-Asp-Asp-Tyr(DDDY)和Asp-Tyr-Asp-Asp(DYDD)具有激活RAW264.7巨噬细胞、促进细胞的增殖和提高吞噬能力的功效;通过构建LPS诱导的RAW264.7巨噬细胞炎症模型,发现DDDY和DYDD可以有效抑制LPS诱导的RAW264.7细胞的分化,使细胞恢复正常形态;并且能抑制 LPS诱导的 RAW264.7细胞NO分泌能力,进一步对细胞炎症因子的分泌量分析,一定质量浓度的DDDY和DYDD处理能抑制LPS诱导的RAW264.7细胞中促炎因子的产生,对抗炎因子的分泌有促进作用,表明DDDY和DYDD对LPS诱导的RAW264.7巨噬细胞炎症模型有一定的抗炎作用。本研究为进一步探究发酵多肽DDDY和DYDD的抗炎机制提供了基础,后续将从基因水平和细胞信号通路关键蛋白方面予以研究。

