溶菌酶LyAa在黑曲霉中的高效表达与酶学性质分析
顾力行,王斌,潘力
(华南理工大学生物科学与工程学院,广东省发酵与酶工程重点实验室,广东广州 510006)
溶菌酶(Lysozyme,EC 3.2.1.17)也被称作胞壁质因细胞壁裂解而死亡[1,2],最早由弗莱明在普通感冒酶(Muramidase),能够将黏多糖水解为糖肽,使细菌病人的鼻涕粘液中发现,并命名为溶菌酶[3]。溶菌酶是一种天然的、性能安全良好的杀菌剂,具有消炎、杀菌、抗病毒等功效,在食品安全、生物医药、饲料制造等领域得到了广泛应用[4-6]。溶菌酶可以被分类为多个糖苷水解酶家族(GH),例如鸡蛋清溶菌酶属于GH22家族,鹅蛋清溶菌酶属于GH23家族,噬菌体T4溶菌酶属于GH24家族等(详情可参看CAZy数据库:http://www.cazy.org/)[7,8]。GH25家族溶菌酶主要存在于微生物中,具有多种功能,例如在细胞分裂期间重塑细菌细胞壁,在噬菌体生命周期结束时溶解细菌细胞壁,以及在古细菌和真核生物中存在抗菌作用[9-11]。这一系列许多溶菌酶的编码基因包括了分泌信号肽,所以大多数溶菌酶可分泌到胞外。目前数据库中共有超过10 000个GH25家族溶菌酶序列,绝大多数是细菌来源的,只有极少数来自真核生物[12-15]。
嗜碱顶孢霉(Acremonium alcalophilum,又称Sodiomyces alcalophilus)是一种最早由日本研究人员从自然环境中分离出[16]的生长在碱性环境中的真菌。其基因组序列存在大量编码生物质降解酶的基因,例如脂肪酶、木质纤维素酶、溶菌酶等。嗜碱顶孢霉编码表达的GH25溶菌酶可以有效地降解微生物细胞壁中的肽聚糖,在动物实验上被证明没有毒性,动物无不良反应,没有皮肤和眼睛刺激性,可被天然降解[17-20]。根据测试,该溶菌酶有很好的胃蛋白酶稳定性,而目前市面上主要出售的鸡蛋清溶菌酶则容易被胃蛋白酶降解。该酶能够分解肠道中堵塞绒毛的肽聚糖,增加肠道对营养物质的吸收,被广泛应用于饲料领域。由于其抗菌谱相比鸡蛋清溶菌酶较窄,无生物毒性,所以在提升饲料利用率的同时不会破坏正常的肠道菌群[17]。
黑曲霉(A.niger)作为典型的丝状真菌,胞外蛋白分泌能力十分优秀,且拥有发酵成本低、菌株能自我修饰翻译后的蛋白等优点,能被用作外源蛋白表达宿主[21-23]。黑曲霉相比大肠杆菌拥有更完备的蛋白分泌和修饰能力,相比甲醇诱导酵母则更具有安全性[24]。黑曲霉是一种安全生产菌株,在实际生产活动中也被用来生产酶制剂[25]。黑曲霉的传统基因编辑技术效率较低,是限制黑曲霉表达技术发展的一个重要因素。
近年来,新出现的CRISPR/Cas9基因组编辑技术得到了进一步发展[26],并应用于各种丝状真菌,包括黑曲霉的基因敲除和定向改造[27]。在该系统中,在单导向RNA(sgRNA)的指导下,Cas9被特异性地引导到基因组目标位点,包括sgRNA原间隔区的20 bp序列互补碱基对和下游3 bp原间隔区相邻基序序列,切割基因组 DNA以引入双链断裂。如果同时提供DNA修复模板,断裂处可由菌株自行修复[28-32]。
本研究使用无孢黑曲霉(A.niger)HL-1作为表达宿主,利用黑曲霉的杂合启动子(PnaII)和经过密码子优化的溶菌酶LyAa基因进行载体构建,使用双拷贝表达载体和CRISPR/Cas9工具提高溶菌酶基因表达和整合效率,筛选得到高表达菌株。通过在溶菌酶的C端添加6×His标签来进行纯化,研究了纯化后溶菌酶的酶学性质,旨在为真菌来源GH25溶菌酶的规模化制备和应用提供理论支持。
1 材料与方法
1.1 材料
1.1.1 菌株与质粒
大肠杆菌(Escherichia coli)Match1 T1购自美国Invitrogen公司;黑曲霉表达宿主A.nigerHL-1(ΔpyrG)为本实验室构建并保存;抑菌试验所使用的细菌:溶壁微球菌(Micrococcus lysodeikticus,ATCC 4698)购自广州市微生物研究所;曲霉 UEV表达载体(杂合启动子PnaⅡ、终止子Ttef、营养缺陷型筛选标记pyrG和淀粉酶amyA下游同源臂)为本实验室构建并保存。
1.1.2 试剂
快速核酸内切酶(如XbaⅠ)购于美国 Thermo Fisher Scientific公司;UDP(尿苷二磷酸)及UDPG(尿苷二磷酸葡萄糖)均购于上海颖心实验室设备有限公司;氨苄青霉素(Amp)和胃蛋白酶购于北京普博欣生物科技有限公司;Prime STAR Max DNA Polymerase、Protein Marker 26630和DNA Marker(1 kb DNA Ladder和DL 10000TM)购于日本TaKaRa公司。
1.1.3 培养基
LB培养基(m/m):1%氯化钠,1%胰蛋白胨,0.5%酵母提取物(固体加2%琼脂粉)。
察氏(CD)培养基(m/m):2%葡萄糖,0.3% NaNO3,0.2% KCl,0.05% MgSO4·7H2O,0.1% KH2PO4,0.001%FeSO4·7H2O,琼脂粉(液体 0.05%,固体 2%),pH值5.5。
DPY培养基(m/m):2%葡萄糖、1%蛋白胨、0.5%酵母提取物、0.1% KH2PO4、0.05% MgSO4·7H2O。
蔗糖高渗培养基(上层培养基0.5%琼脂,下层培养基2%琼脂,m/m):40%蔗糖,0.3% NaNO3,0.2%KCl,0.05% MgSO4·7H2O,0.1% KH2PO4,0.001%FeSO4·7H2O,pH 值 5.5。
发酵培养基:5%玉米粉,3%玉米浆,2%黄豆粕粉。
1.1.4 引物
引物(表1)用于PCR扩增片段和曲霉基因组验证。
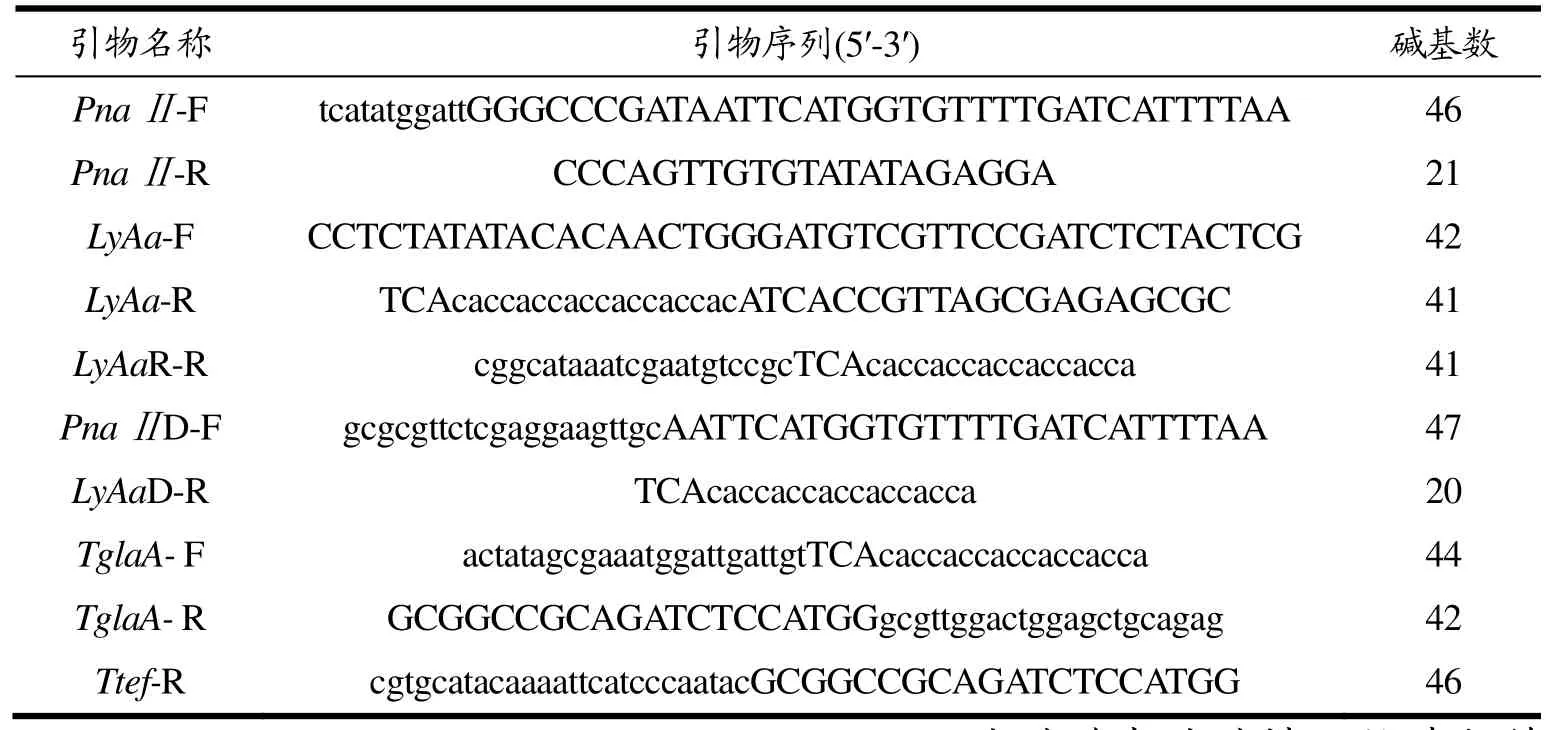
表1 引物Table 1 Primer
1.2 仪器与设备
梯度聚合酶链式反应仪 Veriti 96-Well Thermal Cycler购于美国Applied Biosystems公司;M200多功能微孔板检测器购自美国Thermo Fisher Scientific公司;浸入式水平电泳槽系统购于美国Bio-Rad公司;离心机、移液枪购于德国Eppendorf公司。
1.3 方法
1.3.1 目的基因序列的优化与克隆
1.3.3 溶菌酶表达菌株的构建与筛选
在GenBank可搜索到嗜碱顶孢霉GH25溶菌酶氨基酸序列(GenBank Accession id:MN603156),将基因序列根据黑曲霉密码子偏好进行优化,将序列发送至生物公司合成并连接至通用载体。以合成的目的质粒为模板,使用引物LyAa-F和LyAa-R扩增溶菌酶基因LyAa(在目的基因的C端加入6×His标签)。PCR过程中使用不易引起突变的高保真酶,将获得的产物进行电泳验证无误后回收,保存于-20 ℃冰箱备用。
将溶菌酶表达载体经过质粒大量提取,用核酸内切酶Apa I反应6 h后,纯化并浓缩。使用PEG介导法转化宿主(黑曲霉A.nigerHL-1)原生质体,将含有原生质体的蔗糖软琼脂分散涂布于三个培养基平板上,30 ℃放置7 d后长出菌落。挑选转化子于固体CD平板上继续培养,并挑取部分转化子在 DPY培养基提取基因组。以转化子基因组模板,PCR验证目的基因表达框是否已整合到转化子的基因组上,筛选出正确的溶菌酶表达菌株,将正确的转化子经过低速研磨后接种液体CD培养基。
1.3.2 溶菌酶表达载体构建
1.3.2.1 溶菌酶传统单拷贝表达载体构建
将溶菌酶基因LyAa、杂合启动子PnaⅡ和经过酶切线性化的通用载体 UEV(包含Ttef终止子、pyrG筛选标记和amyA下游同源臂)使用HiFi DNA连接酶将各个片段连接成质粒载体,与大肠杆菌感受态细胞在42 ℃热激90 s,加入适量液体LB进行培养后,涂布氨苄抗性平板37 ℃放置12 h。将长出的单菌落挑至孔板培养,经过菌液电泳、提质粒快速酶切验证、测序验证后,根据结果筛选出与图谱相符的表达载体。将构建成功的表达载体命名为pUEV- LyAa。
1.3.2.2 溶菌酶双拷贝表达载体构建
在黑曲霉中,同向相连的重复片段由于同源重组的原因,会导致其中一个片段的丢失。构建双拷贝载体时,在溶菌酶单拷贝表达载体的基础上,在Ttef终止子与pyrG筛选标记之间插入一段包含杂合启动子PnaⅡ、溶菌酶基因LyAa和糖化酶终止子TglaA的反向片段,两终止子末端相连处含有20 bp的酶切位点。以1.3.2.1节中描述的构建方法,筛选出正确的表达载体命名为pUEV-LyAaD。
1.3.4 使用双拷贝表达载体和CRISPR/Cas9工具提高溶菌酶的表达量
双拷贝表达载体同样经过核酸内切酶Apa I处理后与质粒Cas9-H进行共转化。质粒Cas9-H能够使黑曲霉合成出Cas9蛋白和sgRNA,切割位点位于淀粉酶amyA基因内,带有hyg潮霉素筛选标记。使用1.3.3节方法筛选,但需要在蔗糖高渗培养基中加入潮霉素(2 μL/mL),可得到相应的阳性转化子。转化时仅使用双拷贝表达载体可得另一组阳性转化子。
1.3.5 溶菌酶重组表达菌株的摇瓶发酵及酶活测定
1.3.5.1 比浊法
溶壁微球菌(Micrococcus lysodeikticus,ATCC4698)的细胞壁富含肽聚糖,可以被用作实验菌,溶菌酶可使细菌裂解而让菌悬液的 450 nm吸光度降低。在550 mL容量瓶中加入20.125 mL的1.0 mol/L磷酸氢钾溶液、7.375 mL的1.0 mol/L磷酸氢二钾溶液,加入超纯水定容,使用1 mol/L KOH或1 mol/L HCl在25 ℃下将pH值调节至6.24,缓冲液在常温下保存。将20 mg菌粉与100 mL缓冲液混合均匀,于30 ℃培养30 min,菌悬液的A450nm保持在0.70±0.1内。将鉴定正确的溶菌酶菌株在液体淀粉发酵培养基中发酵6 d(30 ℃,250 r/min),10 000×g离心10 min,收集上清液。吸取100 μL上清液液与2.5 mL菌悬液混合均匀,观察和记录A450 nm的下降值,根据下列公式计算酶活。

式中:
B——酶活,U/mL;
ΔA1测试样品在450 nm处每分钟吸光度下降值;
ΔA0空白样品在450 nm处每分钟吸光度下降值;
df——稀释因子;
0.001 ——单位定义中的吸光度(ΔA)变化;
0.1——酶溶液的体积(以毫升计)[33]。
1.3.5.2 平板涂布法
将溶壁微球菌接种LB培养基,于30 ℃培养至450 nm吸光度为0.5左右,用LB培养基稀释100倍,取1 μL与100 μL发酵上清液充分混合后在30 ℃培养2 h,取30 μL涂布LB固体平板,30 ℃放置12 h后计算菌落数量。将宿主发酵上清液与细菌混合后进行相同处理,作为阴性对照[34]。
1.3.5.3 牛津杯法
将10 mL LB培养基倒入培养皿,凝固后充当下层板,再加入5 mL与一定浓度菌悬液混合的LB培养基,凝固后充当上层版。用镊子把牛津杯放到培养基表面,杯口朝上,并且牛津杯与培养基之间无空隙,在杯中加入200 μL发酵上清液,37 ℃培养12 h。发酵上清液以牛津杯为中心进行扩散,离杯越近溶菌酶浓度越高,在高浓度溶菌酶下细菌会裂解死亡。经过一段时间后可明显看到抑菌圈,用尺量出透明圈的大小,范围越大说明活性越强[35]。
1.3.6 溶菌酶蛋白纯化和SDS-PAGE分析
构建载体时溶菌酶LyAa带有6×His标签,可使用镍柱通过亲和层析的方式纯化溶菌酶蛋白。在发酵培养基中将目的菌株培养6 d,将发酵培养基高速离心取上清,重复两次后,用0.45 µm的滤膜过滤。使用HisTrapTMHP层析柱进行亲和层析,进样量为30 mL,流速设置1 mL/min。使用不同浓度的咪唑buffer进行洗脱,将各个不同浓度的洗脱峰收集至15 mL离心管。离心管中取40 μL 与 10 μL 5×loading buffer混合后,煮沸10 min,取10 μL反应液进行SDS-PAGE检测。根据每个洗脱峰的检测结果,得到单一的溶菌酶溶液。
1.3.7 溶菌酶的酶学性质研究
1.3.7.1 温度对溶菌酶的影响
最适温度的测定:在pH值4.0的条件下,配置不同温度梯度 20、25、30、35、40、45、50、60、70、80 ℃的菌悬液与酶液混合反应,根据450 nm吸光度的降低值来确定溶菌酶的最适温度,以450 nm吸光度最大降低值为100%。温度稳定性测定:配置65、70、75、80 ℃的菌悬液进行相同操作,以各组加热0 min时所得的450 nm吸光度降低值为100%。
1.3.7.2 pH值对溶菌酶的影响
最适pH值的测定:在pH值为3.0、3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0、8.0、9.0、10.0的菌悬液中,根据反应时450 nm吸光度的降低值来确定溶菌酶的最适pH值,以450 nm吸光度最大降低值为100%。pH值稳定性测定:酶液在相应pH值下孵育3 h,进行相同操作,以各组孵育0 min时所得的450 nm吸光度降低值为100%。
1.3.7.3 溶菌酶的胃蛋白酶稳定性
将溶菌酶LyAa与母鸡蛋白溶菌酶在胃蛋白酶缓冲液(100 mmol/L甘氨酸-HCl,pH值4.0)中处理0、15、30、60 min后,在37 ℃下根据450 nm吸光度的下降来确定溶菌酶的残留活性。在胃蛋白酶缓冲液中孵育结束后添加终止液使胃蛋白酶失活。以在处理0 min时的活性为100%。
1.3.8 数据处理与分析
所有数据均重复三次,取平均值后进行数据分析与处理,图表制作使用误差线,并使用Origin软件绘制。
2 结果与讨论
2.1 溶菌酶LyAa的三维结构预测与分析
溶菌酶LyAa的基因(Genbank:MN603156)编码包含208个氨基酸的GH25溶菌酶成熟肽(不包含信号肽)。SWISS MODEL蛋白质三维建模服务器预测后(模板 PDB:6zm8),结果(图1)显示,溶菌酶LyAa含有α-螺旋和β-折叠(使用不同颜色标注),拥有包括Asp95和Glu97两个残基形成活性中心(由单独的球棍模型标注)。在结构模型中,最后三股β链以无螺旋的环状相连接,而最后的β链以平行相反的方向连接,在活性位点残基所在的位置形成一个经典的桶状褶皱,活性位点残基位于桶状褶皱的前半部分。这种结构是一种特异性βα折叠,也是GH25溶菌酶的特色结构,最早被发现于天蓝色链霉菌的溶菌酶[36]。虽然溶菌酶LyAa拥有N -糖基化位点,但溶菌酶LyAa没有在这些结构位点发生糖基化[20]。经预测,该多肽的理论分子量为24.9 ku、等电点为8.4。
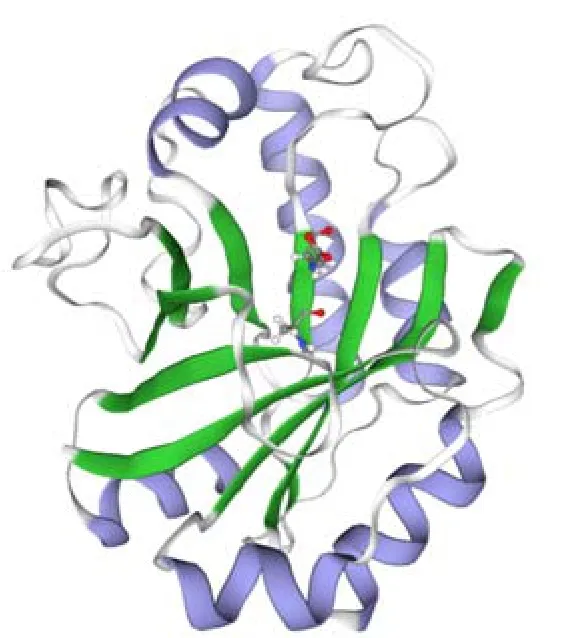
图1 LyAa溶菌酶的三维结构预测Fig.1 Three-dimensional structure prediction of LyAa protein
2.2 溶菌酶LyAa的系统进化分析
将LyAa与其它真菌来源的GH25溶菌酶进行多序列比对,并采用邻接法构建系统发育进化树。结果显示(图2),嗜碱顶孢霉(Acremonium alcalophilum)与毛霉菌亚门(Mucoromycotinasp.)和拟青霉(Paecilomycessp.)等聚为一支,绿僵菌属(Metarhiziumsp.)等聚为另一小支,罗斯曼枝穗菌(Clonostachys rossmaniae)等聚为第三小支。
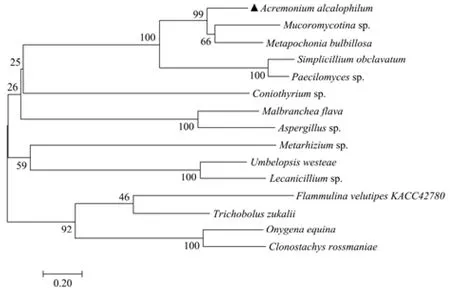
图2 不同真菌来源GH25溶菌酶的系统进化分析Fig.2 Phylogenetic analysis of GH25 lysozyme from different fungal sources
2.3 溶菌酶LyAa的载体构建与表达菌株的筛选
将溶菌酶基因在SignalP 5.0服务器上预测信号肽,发现其N端含有分泌信号肽,用黑曲霉中高表达的glaA糖化酶信号肽进行替换。按照1.3.2节的方法构建溶菌酶 LyAa单拷贝和双拷贝表达载体(图3a、3b)。质粒载体经过内切酶Apa I处理后,进行电泳验证,pUEV-LyAa应有4 200 bp与2 800 bp条带,pUEV-LyAa应有6 200 bp与2 800 bp条带,结果显示符合预期(图3c、3d)。测序结果显示,两个表达载体未发现突变,已成功构建。按照1.3.3节的方法筛选得到重组菌株,经提取基因组PCR验证正确后获得阳性转化子。
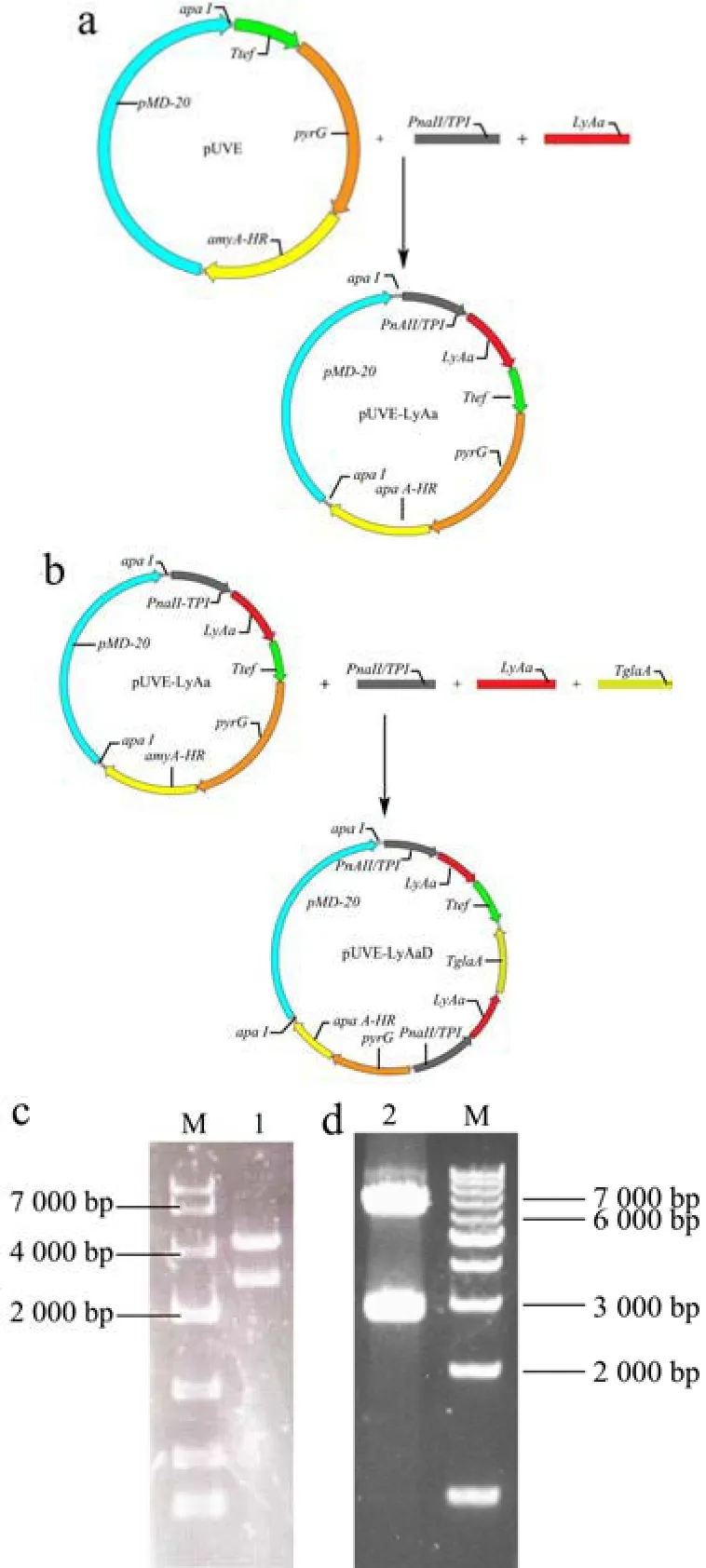
图3 溶菌酶LyAa的载体构建与表达菌株的筛选Fig.3 Vector construction of lysozyme LyAa and screening of expression strain
2.4 溶菌酶LyAa表达量的提升
为了进一步提高LyAa的表达水平,使用双拷贝质粒pUEV-LyAaD与CRISPR/Cas9工具进行共转化作为表达策略。将双拷贝片段整合到表达菌株淀粉酶的多个位点,得到不同拷贝数的表达菌株。结果表明(图4A、4B),使用双拷贝表达载体pUEV-LyAaD与CRISPR/Cas9工具进行共转化的转化子(LyAa-C)的蛋白条带最浓,仅使用双拷贝表达载体 pUEV-LyAaD的转化子(LyAa-F)的蛋白条带浓度次之,仅使用传统单拷贝表达载体pUEV-LyAa的转化子(LyAa-T)蛋白条带浓度最淡。各表达菌株酶活力均在6 d达到最高,LyAa-T的酶活力最高为358.41 U/mL,LyAa-F的酶活力最高为869.74 U/mL,约为LyAa-T的2.43倍。LyAa-C的酶活力最高为2 291.37 U/mL,约为LyAa-F的2.63倍,约为LyAa-T的6.39倍。宿主对照几乎检测不到酶活力。平板涂布法检测酶活力,结果显示(图4C),LyAa-C发酵上清液形成的菌落数最少,约为20个;LyAa-F发酵上清液形成的菌落数约为50个;LyAa-T发酵上清液形成的菌落数约为90个;宿主对照菌落数约为160个。牛津杯法检测酶活力,结果显示(图4D),LyAa-C发酵上清液形成的溶菌圈直径约为7.9 mm,LyAa-F发酵上清液形成的溶菌圈直径约为6.8 mm。
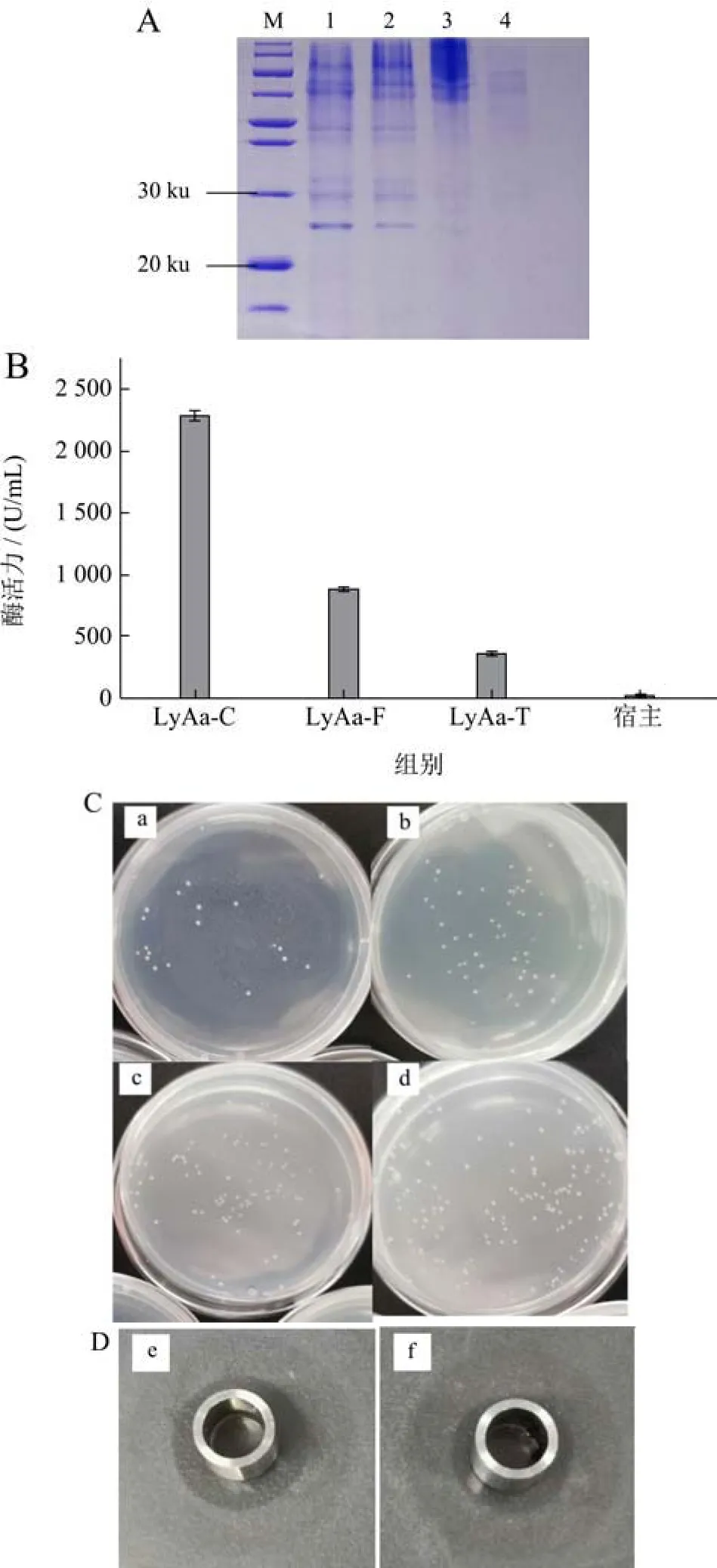
图4 溶菌酶LyAa表达量的提升Fig.4 Increasing the expression of lysozyme LyAa
2.5 溶菌酶LyAa的纯化
使用镍柱进行纯化,通过不同洗脱峰,得到单一溶菌酶蛋白样品,并进行SDS-PAGE检测(图5),泳道1为纯化后的LyAa溶菌酶,蛋白分子量大小约为25.0 ku,与预测结果大小相同。
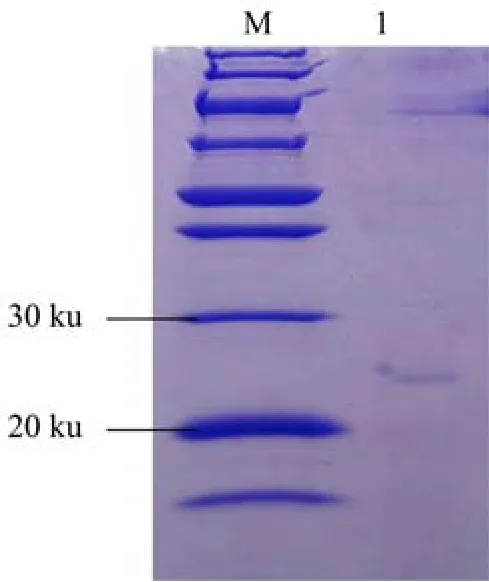
图5 溶菌酶LyAa的纯化Fig.5 SDS-PAGE profile of purified LyAa
2.6 溶菌酶LyAa的酶学性质
2.6.1 温度对LyAa酶活力的影响
溶菌酶LyAa在30 ℃达到最适温度,温度逐渐升高的过程中酶活不断降低(图6a)。溶菌酶在温度25~70 ℃有较好的热稳定性,在此范围内处理60 min后仍能保持80%以上的相对酶活力,超过75 ℃后相对酶活力下降速度较快(图6b)。
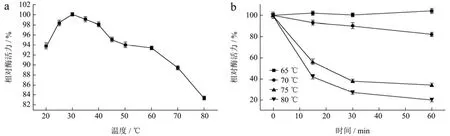
图6 温度对LyAa酶活力的影响Fig.6 Effect of temperature on LyAa enzyme activity
2.6.2 pH值对LyAa酶活力的影响
溶菌酶LyAa在pH值为4.0时酶活力达到最高,在pH值为3.5~5.0时保持着80%以上的相对酶活力(图7a)。同样在pH值为3.5~5.0时,孵育3 h后仍保持80%以上相对酶活力(图7b)。
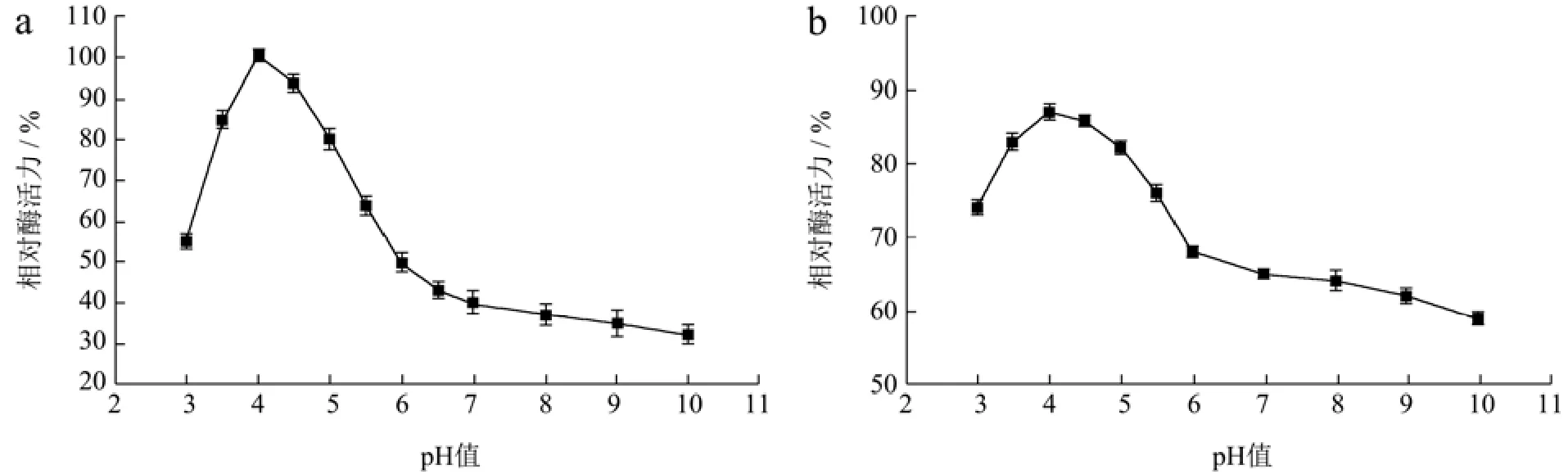
图7 pH值对LyAa酶活力的影响Fig.7 Effect of pH value on LyAa enzyme activity
2.6.3 胃蛋白酶对LyAa与母鸡蛋白溶菌酶酶活力的影响
将 LyAa与母鸡蛋白溶菌酶在胃蛋白酶缓冲液中处理后测定剩余活性。结果显示(图8),在15 min后,母鸡蛋白溶菌酶的酶活力就大大降低,60 min后相对酶活力已经不足10%。而LyAa在处理60 min后的相对酶活力变化很小,显示出良好的胃蛋白酶稳定性。
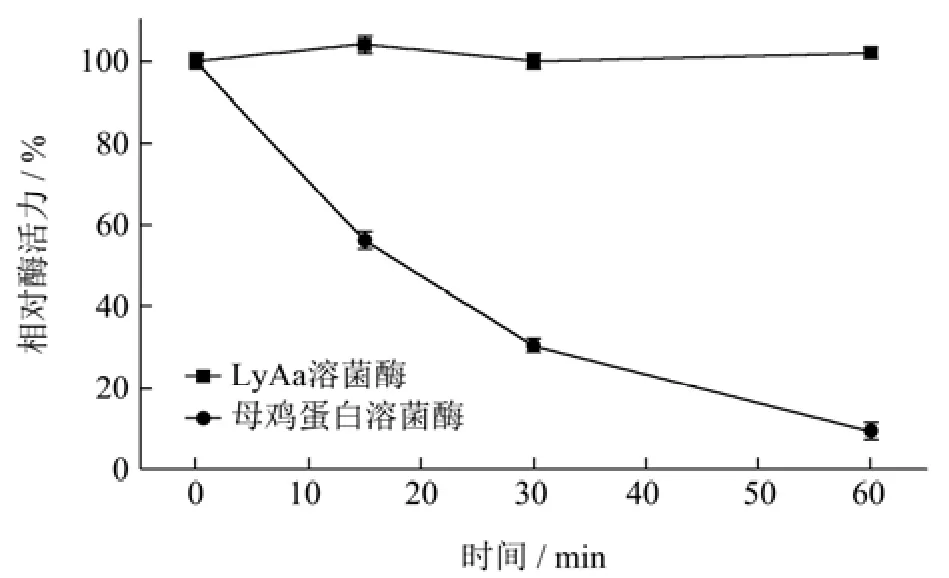
图8 胃蛋白酶对LyAa与母鸡蛋白溶菌酶酶活力的影响Fig.8 Effects of pepsin on the enzyme activity of LyAa and hen protein lysozyme
3 结论
黑曲霉的胞外蛋白分泌量大,在菌株内部能够对蛋白进行修饰,且无生物毒性,是表达外源分泌蛋白的优良宿主。本研究将来自嗜碱顶孢霉的GH25基因根据黑曲霉的偏好进行密码子优化后,将基因原有的信号肽替换成黑曲霉的糖化酶信号肽并将其置于杂合启动子PnaII控制下表达构建单拷贝表达载体和双拷贝表达载体。仅使用单拷贝载体得到的菌株 LyAa-T摇瓶发酵酶活力为358.41 U/mL,仅使用双拷贝载体得到的菌株LyAa-F摇瓶发酵酶活力为869.74 U/mL,是LyAa-T的2.43倍。使用双拷贝载体并借助CRISPR工具整合获得多拷贝的菌株LyAa-C摇瓶发酵酶活力为2 291.37 U/mL,是LyAa-F的2.63倍,是LyAa-T的 6.39倍。使用镍柱纯化得到单一的溶菌酶蛋白,SDS-PAGE结果表明其分子量大小约为25.0 ku,与预测结果24.9 ku相同。测试其酶学性质,酶活力在30 ℃时最高,短时间的高温处理对酶活力影响不大;最适pH值为4.0,在pH值为3.5~5.0时有较高的酶活力和稳定性;溶菌酶LyAa在胃蛋白酶缓冲液中处理后活性变化很小,而母鸡蛋白溶菌酶的酶活力大大降低。综上,溶菌酶LyAa能够不被胃蛋白酶水解且性质稳定,且在黑曲霉中成功提升其产量,为后续的规模化制备和应用提供理论支持。

