经导管三尖瓣置换装置LuX-Valve 治疗重度三尖瓣反流的超声心动图评价
赵星,孟红,王建德,逄坤静,刘倩倩,胡文文,田月,施浩,王首正,胡晓鹏,潘湘斌,王建美,孔凡芬,吴金涛,王浩
三尖瓣反流(TR)较为常见,严重时会增加心力衰竭与死亡风险,5 年生存率低于70%[1]。外科手术是标准的治疗方法[2-3],但因既往心脏手术史、高龄等因素,仅不足5%的严重TR 患者接受了手术治疗[4],孤立性三尖瓣手术的住院死亡率高达8.8%[5]。TR 外科手术的高风险和大量有治疗指征的患者未得到有效治疗的现状,促进了经导管三尖瓣治疗的发展[6],进而也扩大了高危患者的治疗选择。
LuX-Valve 系统(宁波健世生物科技有限公司)是一种新型经导管人工三尖瓣瓣膜系统,其自膨式支架瓣膜,以锚定在室间隔上的右心室锚定件和三尖瓣前叶夹持件固定瓣膜,不使用径向支撑力支撑瓣环,早期临床结果已经报道[7]。TRAVEL 研究(ClinicalTrials.gov 注册编号:NCT04436653)是使用LuX-Valve 行经导管三尖瓣置换术的一项前瞻性多中心单臂试验,本文主要报告该研究中的单中心1年临床与超声心动图结果。
1 资料与方法
1.1 研究设计与研究对象
本研究为TRAVEL 研究的单中心分析。2020年6 月至2021 年8 月,中国医学科学院阜外医院收治的有症状的重度TR 患者,NYHA 心功能Ⅲ级及以上、左心室射血分数≥50%、年龄≥50 岁、手术风险评分为外科高危、接受指南指导下药物治疗无明显改善、三尖瓣修复术后反流复发风险高的患者,共36 例患者被纳入本研究。如果肺动脉收缩压≥55 mmHg(1 mmHg=0.133 kPa)、左心室功能减低、有需要手术干预的其他瓣膜病变或人工瓣功能障碍、右心室流出道梗阻、感染性心内膜炎、合并其他严重的器官功能衰竭等的患者被排除出研究。多中心试验TRAVEL 研究的总样本量使用单组目标值法计算,经各研究分中心分配,得到本中心的入组数量。本研究获得中国医学科学院阜外医院伦理委员会批准(项目编号:2019-1146)并接受其审查。所有患者均签署知情同意书。
1.2 术前与术后超声心动图数据采集
所有超声心动图的采集、分析遵循美国超声心动图学会指南[8]及中国专家共识[9]。选用EPIQ CVx 超声诊断仪(飞利浦,美国),经胸超声心动图(TTE)使用X5-1 探头,经食道超声心动图(TEE)使用X8-2t 探头。使用Philips Qlab 13.0 软件进行影像数据分析。采集患者手术前后及术后随访期的超声心动图资料。综合应用多种超声技术,观察瓣膜解剖学及血流动力学、心腔大小、心功能等方面的指标,定位诊断三尖瓣病变,推断TR 机制及病因[10],依据TR 的5 级扩展分级方案[11]量化评估反流严重程度,分为少量、中量、大量、极大量、巨大量(图1A~1C)。测量右心房内径及容积,右心室内径、面积及容积。测量三尖瓣环收缩期位移(TAPSE)、右心室面积变化分数、射血分数和纵向应变(图1D、1E)以及组织多普勒三尖瓣环收缩期速度。估测肺动脉收缩压,测量二尖瓣及三尖瓣跨瓣压差等。为防止检查者主观因素造成偏倚,历次超声心动图检查的30%采取双人复核制,观察者间的明显差异提交核心实验室复审。为避免患者容量负荷状态和血管活性药物的影响,超声心动图检查安排在恰当时间进行。
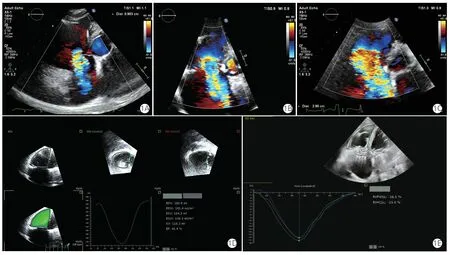
图1 术前三尖瓣反流严重程度量化评估及右心室功能分析
1.3 手术方法与术中超声心动图的应用
所有患者经右胸小切口行介入三尖瓣置换术,在TEE 及X 线透视联合引导下,由右心房入路将LuX-Valve 人工三尖瓣输送系统送至右心室,释放人工瓣膜及固定。经确认后将输送系统撤出右心房[12]。术中超声引导和监测,使用TEE、TTE 对心脏解剖及器械可视化[13],协助术者选择手术入路,引导输送器通过三尖瓣口,引导人工瓣瓣架至正确位置,确认锚定件与室间隔贴合,即刻评价手术效果,了解有无手术并发症[14](图2)。

图2 超声心动图在经导管三尖瓣置换术的术中应用
1.4 随访时间与研究终点
除住院观察外,于术后1 个月、6 个月、1 年回院门诊随访,进行临床评估及影像学和实验室检查。对于不能回院随访患者,电话回访并安排当地复查。
研究的主要安全终点定义为术后1 年的全因死亡。主要不良事件包括术后1 年内发生死亡及心力衰竭、肾功能衰竭、肝功能衰竭、因心力衰竭再次住院等。疗效终点定义为TR 严重程度降低至少2 级。
1.5 统计学方法
使用STATA 16.0 软件进行数据的统计分析。符合正态分布的连续变量采用均数±标准差进行描述;非正态分布的连续变量采用中位数(P25,P75)表示;分类变量以例(%)进行描述。连续变量的比较采用t检验,其他变量采用Wilcoxon 秩和检验,构成比的比较使用卡方检验,同一患者重复测量的前后比较使用协方差分析,生存分析采用Kaplan-Meier 模型和Cox 比例风险回归模型分析1 年累积无心力衰竭住院生存率及1 年生存率。缺失值的处理采用末次观察值结转法填补。采用双侧检验,P<0.05 为差异有统计学意义。
2 结果
2.1 所纳36 例患者的基本资料(表1)
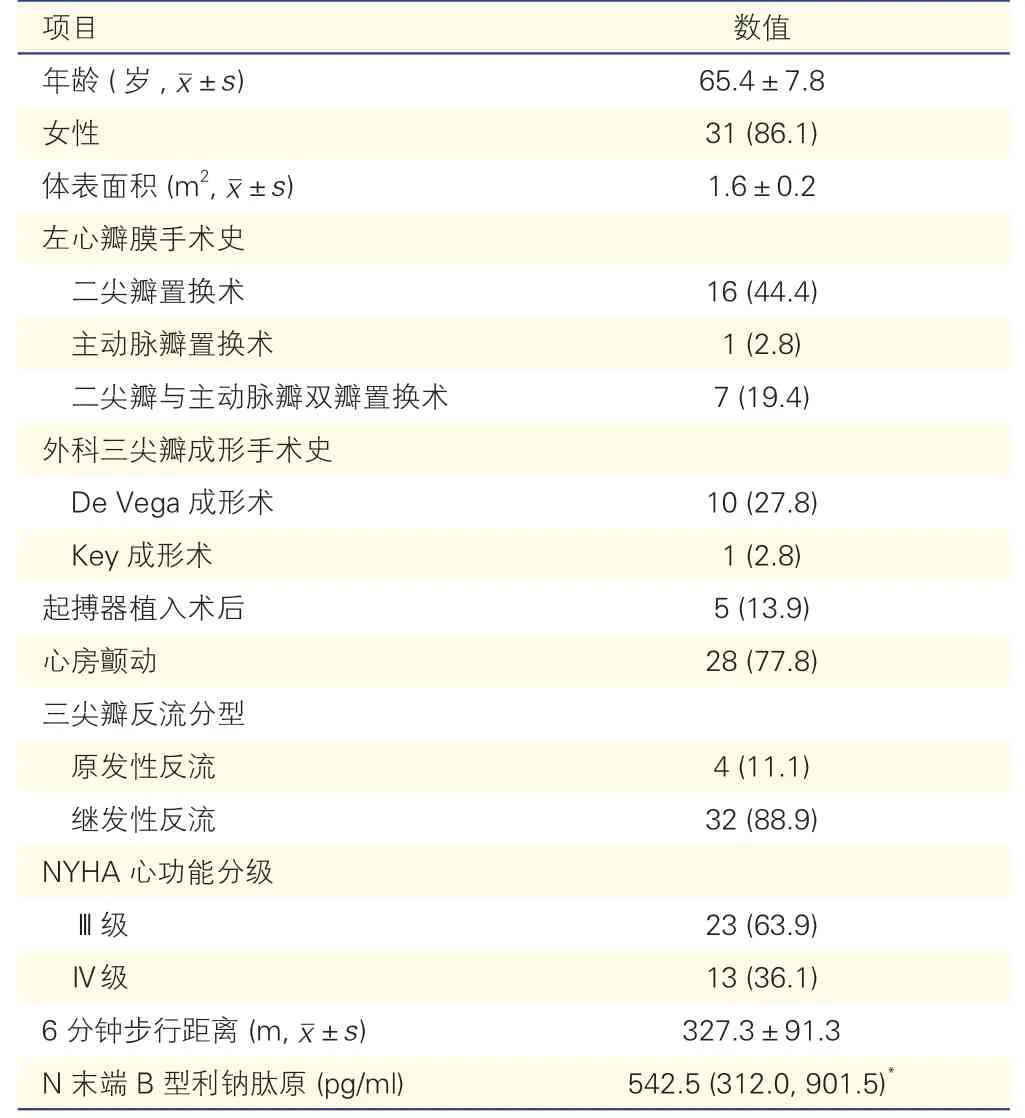
表1 36 例患者的基本资料[例(%)]
研究最终纳入36 例患者,平均年龄(65.4±7.8)岁,31 例(86.1%)为女性。所有患者均有右心功能不全症状,NYHA 心功能分级为Ⅲ~Ⅳ级。24 例(66.7%)患者有左心瓣膜手术史。
术前TTE 显示,88.9%(32/36)的患者为继发性TR,11.1%(4/36)为原发性TR。所有患者均为重度反流,按TR 五级分级系统,27.8%(10/36)为大量反流,44.4%(16/36)为极大量,27.8%(10/36)为巨大量,缩流颈宽度(16.92±5.96)mm。所有患者均有右心房、室扩大,右心室收缩功能指标测值均在正常参考值范围内。估测肺动脉收缩压(36.65±10.63)mmHg,二尖瓣平均跨瓣压差(3.69±2.25)mmHg(表 2)。
2.2 治疗结果
36 例(100%)患者均成功植入三尖瓣人工支架瓣膜,无术中或术后72 h 内死亡,未出现术中转外科换瓣或成形术。32 例(88.9%)实现手术成功,余4 例(11.1%)因发生器械位置异常行体外循环下开胸探查术。术后呼吸机使用时间34.5(18.5,50.0)h,重症监护病房停留时间5(4,7)d,住院时间15(11,25)d。20 例(55.5%)患者住院期间未使用红细胞,另16 例(44.4%)患者的输血量为5(3,9)单位红细胞。无院内死亡,2 例患者病重出院。术后随访350(196,386)d 期间,3 例(8.3%)患者死亡,分别于术后22 d、40 d、46 d 死于多器官功能衰竭。Kaplan-Meier 曲线估计的1 年累积生存率为91.3%(95%CI:75.5%~97.1%)(图3)。术后早期3 例患者出现心功能不全及肝肾功能不全,2 例使用体外膜肺氧合辅助,术后因心力衰竭再次入院4 例,1 年累积无心力衰竭住院生存率为75.0%(27/36)。存活患者至末次随访时,66.7%(22/33)NYHA 心功能恢复至Ⅰ~Ⅱ级,余33.3%(11/33)心功能Ⅲ级(P<0.001)。
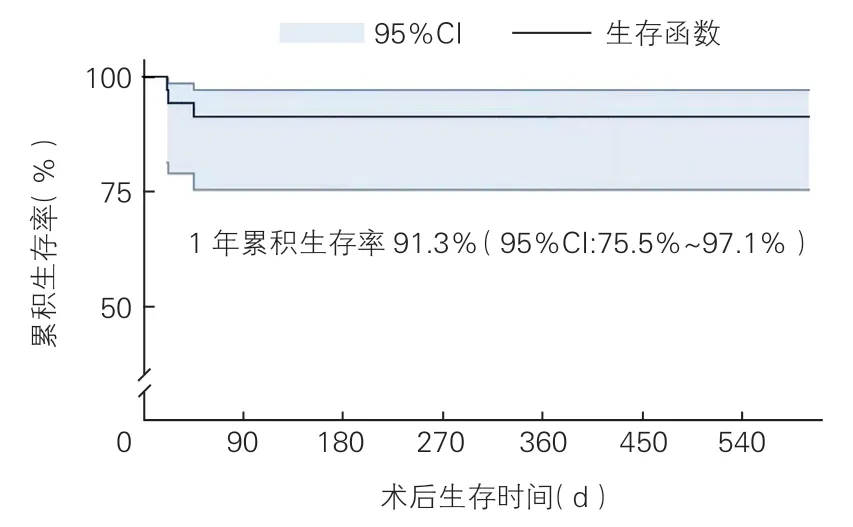
图3 Kaplan-Meier 曲线估计的累积生存率
术后1 个月及末次随访超声心动图结果显示,三尖瓣反流明显减少。末次随访时,72.7%(24/33)三尖瓣反流量为少量及以下,27.3%(9/33)中量(P<0.001)。三尖瓣人工瓣前向血流正常,平均跨瓣压差(2.64±1.56)mmHg。与术前比较,末次随访的右心房容积[(161.08±95.50)ml vs.(115.58±67.74)ml,P<0.001]、右心室基底段左右径[(51.36±7.68)mm vs.(45.88±7.63)mm,P=0.005]、右心室舒张末期面积[(24.55±7.88)cm2vs.(21.04±6.94)cm2,P=0.003]及右心室舒张末期容积[(136.65±55.44)ml vs.(118.76±50.45)ml,P=0.037]均明显减小;右心室面积变化分数[(44.58±6.49)% vs.(40.96±5.66)%,P=0.029]、TAPSE[(17.86±3.18)mm vs.(15.00±2.42)mm,P<0.001]、右心室整体纵向应变绝对值[(-19.27±4.99)% vs.(-12.64±7.21)%,P<0.001]均较术前减低,右心室射血分数[(47.22±3.44)%vs.(46.17±2.65)%,P=0.161]及组织多普勒三尖瓣环收缩期速度[(10.15±2.84)cm/s vs.(9.08±2.45)cm/s,P=0.089]差异无统计学意义(表2)。
表2 患者术前、术后经胸超声心动图结果比较()
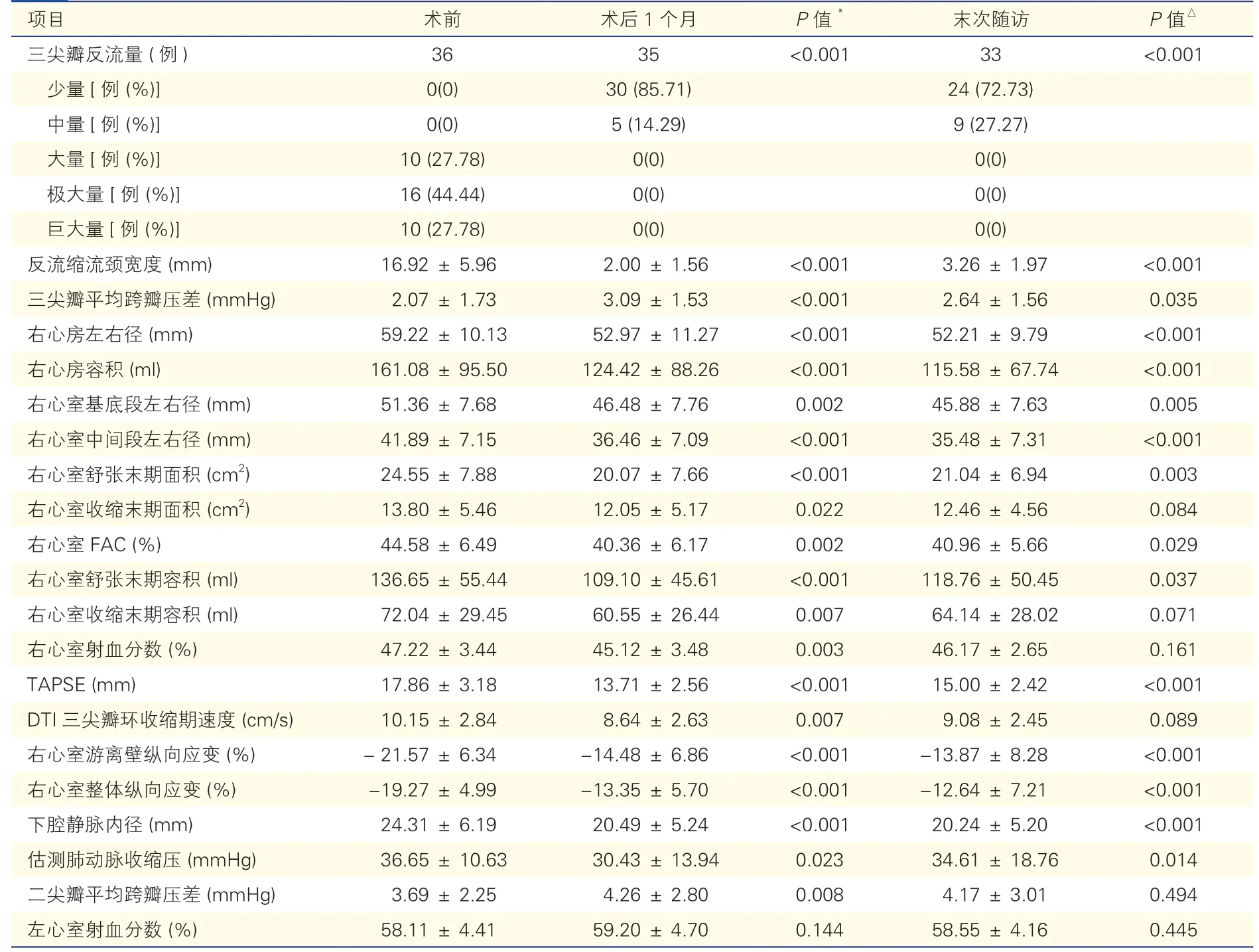
表2 患者术前、术后经胸超声心动图结果比较()
注:FAC:面积变化分数;TAPSE:三尖瓣环收缩期位移;DTI:组织多普勒。*:术后1 个月与术前相比;△:末次随访与术前相比。1 mmHg=0.133 kPa
2.3 Cox 比例风险回归模型分析(表3)
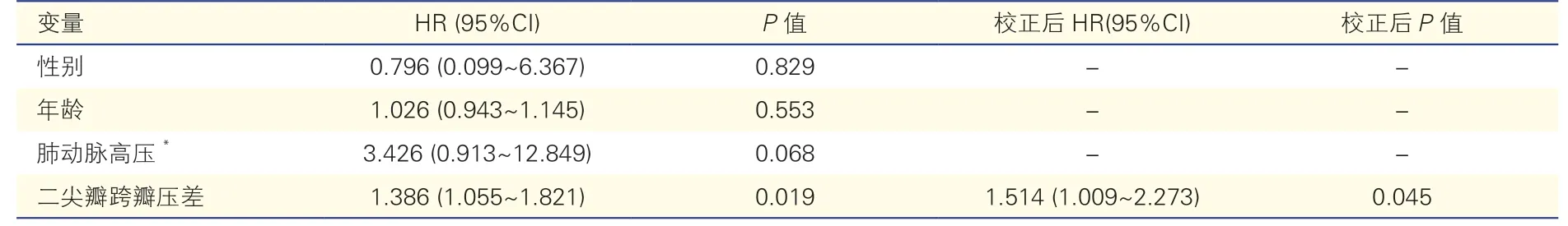
表3 术前特征与主要不良事件的Cox 回归分析
单因素Cox 回归分析显示,右心房容积、右心室基底段及中间段左右内径、右心室舒张末期及收缩末期面积、右心室舒张末期容积以及二尖瓣平均跨瓣压差与术后死亡及心力衰竭等不良事件发生风险增高相关,而反映右心室收缩功能的指标、超声心动图估测的肺动脉收缩压及既往心脏手术史、术前NYHA 心功能分级不影响结局。多因素Cox 回归分析显示,校正年龄、性别、肺动脉高压等因素后,二尖瓣平均跨瓣压差是发生主要不良事件的独立危险因素(校正后HR=1.514,95%CI:1.009~2.273,P=0.045)。
3 讨论
在这项前瞻性、单臂研究中,我中心结果显示经导管三尖瓣置换装置LuX-Valve 治疗重度三尖瓣反流可行且中期安全性较好,可有效减少三尖瓣反流,改善临床症状与右心腔扩大。
目前已有数种三尖瓣介入治疗装置处于研究中。就介入三尖瓣成形术而言,使用瓣叶缘对缘装置MitraClip 的6 个月结果显示,三尖瓣反流明显减少,全因死亡率4.8%(4/84)[15];FORMA 装置术后32 个月的死亡率为23.5%(4/17)[16];瓣环成形装置Cardioband 术后2 年的死亡率为26.7%(8/30)[17]。在介入三尖瓣置换术方面,非原位三尖瓣置换装置CAVI 的住院死亡率为16.0%(4/25)[18];原位三尖瓣置换装置NaviGate 术后平均随访127 d 的全因死亡率为13.3%(4/30)[19]。一项包含多种三尖瓣介入方法的登记研究TriValve 研究纳入多中心共312 例患者,1.5 年的生存率为(77.2±5.9)%[20]。本研究亦为原位三尖瓣置换术,在本组患者中,LuX-Valve成功应用于重度TR 的治疗,术后中位随访350 d 的全因死亡率为8.3%,NYHA 心功能分级明显改善。
三尖瓣修复术与置换术两种方法的选择比较尚无定论。本研究中,患者均为传统外科手术高危患者,三尖瓣可修复性不足,经导管三尖瓣置换术为恰当的选择。术后右心扩大减轻,下腔静脉内径减小,提示TR 的减少带来了右心房压的降低,这可解释患者术后临床症状的缓解。
与其他同类研究的结果有所不同[20],在本研究中,右心室收缩功能各指标术后未显示出明显改变。可能的原因之一是,术后患者常见的TAPSE 和组织多普勒s’的减低,与M 型取样线和组织多普勒取样容积都放置于右心室游离壁三尖瓣环位置而受到手术影响有关。其次,在有限的观察期内,尚未见到本研究人群右心室功能的提高,需要更长期的随访,以判断术前严重的TR 是否已造成了右心室功能的不可逆改变,为TR 治疗时机的选择提供依据。
本研究的Cox 多因素回归分析显示,二尖瓣跨瓣压差是与术后主要不良事件相关的术前超声心动图指标。二尖瓣置换术后跨瓣压差的异常增加,与自然瓣二尖瓣狭窄的病理生理机制相似。本研究中,半数以上患者有二尖瓣置换手术史,二尖瓣人工瓣跨瓣平均压差为1~9 mmHg,在人工瓣压差正常范围内,但研究结果仍显示出二尖瓣平均压差与手术结果相关。这一发现为介入三尖瓣置换术的患者选择提供了一定的依据。
基于本组患者的数据,术前超声心动图结果中反映右心室收缩功能的指标右心室面积变化分数、射血分数和应变等,与术后主要不良事件无关。可能的原因是,在TR 患者中观察到的上述右心功能指标高估了重度房室瓣反流时的心室收缩力,这一点与二尖瓣反流患者中观察到的情况相似。右心室应变在一些研究中被证明具有预后价值,但本研究未得到相似的结论,有待更进一步研究是否与手术方式有关。
本研究的局限性:样本量有限,尚待将多研究中心的数据汇总进一步分析;在有限的观察期内,尚不能确定手术的长期疗效和安全性。本研究是单组设计的研究,下一步将收集不同三尖瓣手术方法的患者数据进行对比分析。
综上所述,本研究证明了经导管三尖瓣置换装置LuX-Valve 对严重三尖瓣反流治疗的有效性和中期安全性,患者临床症状改善,右心腔减小。二尖瓣平均跨瓣压差是与术后主要不良事件相关的重要术前超声指标。这些为三尖瓣介入手术的患者选择及干预时机提供了有用依据。
利益冲突:所有作者均声明不存在利益冲突

