SPECT 和PET 评估冬眠心肌联合心脏磁共振成像测定左心室室壁厚度对缺血性心肌病患者预后的预测价值
曹慧晓,孟晶晶,王辉,田晶,张颖,常智,唐立钧,李天女,徐磊,李翔,张晓丽
长期心肌缺血导致心肌局限性或弥漫性纤维化、心脏收缩和(或)舒张功能受损,是缺血性心肌病患者发生心力衰竭的重要原因。目前针对缺血性心肌病患者的常见治疗方式包括药物治疗、血运重建和心脏移植。心脏移植供体少,而积极的血运重建可有效改善患者的症状和提高生存率,其中评估冬眠心肌和梗死组织对于治疗方案的制定极其重要[1-2]。
18F-脱氧葡萄糖(FDG)正电子发射断层成像(PET)心肌代谢显像被认为是评价存活心肌的“金标准”[3],对缺血性心肌病患者的预后有较高的预测价值[4]。心脏磁共振成像(CMR)具有较高的软组织分辨率,可精确测量左心室室壁厚度及判断心肌是否存活。既往认为,CMR 测定的局部室壁厚度变薄(<5~6 mm)提示为疤痕组织[5]。然而,最近研究表明,室壁严重变薄的区域不一定完全由瘢痕组织组成,可能同时有冬眠心肌[6]。既往也有研究报道[7],PET 联合CMR 检测存活心肌的准确度高于单用PET或CMR,而且CMR 延迟强化可准确评估心肌疤痕组织[8]。但是,CMR 延迟强化需要使用对比剂,且成像时长、成像质量等受诸多因素影响,该技术的普及和推广在一定程度上受到限制。此外,冠心病心力衰竭患者常合并慢性肾脏病,静脉注射钆对比剂有导致肾原性系统性硬化的风险[9]。在临床实践中,CMR 测定左心室室壁厚度简单、易行,推测PET 评估的冬眠心肌联合CMR 测定的左心室室壁厚度可以改善对缺血性心肌病患者的危险分层,但迄今为止鲜有相关研究报道。因此,本研究旨在探讨门控99Tcm-甲氧基异丁基异腈(MIBI)单光子发射计算机断层成像(SPECT)静息心肌灌注显像和18F-FDG PET 心肌代谢显像评估冬眠心肌联合CMR 测定左心室室壁厚度对缺血性心肌病患者的预后预测价值。
1 资料与方法
研究对象:回顾性纳入2017 年1 月至2020 年8 月于首都医科大学附属北京安贞医院行门控99Tcm-MIBI SPECT/CT 静息心肌灌注显像和18F-FDG PET/CT 心肌代谢显像并在两周内行CMR 的缺血性心肌病患者75 例。排除标准:(1)合并其他心肌病;(2)严重心脏瓣膜疾病;(3)心肌代谢图像质量不理想。本研究符合国家制定的涉及人的生物医学研究伦理标准和世界医学协会最新修订的《赫尔辛基宣言》的要求。全部患者及其家属均对本次研究知情,并已签署知情同意书。
图像采集方法:(1)静息心肌灌注显像:显像剂为99Tcm-MIBI,放化纯度>95%;显像设备为德国西门子SYBMIA INTEVO 16 SPECT/CT 仪,配SMARTZOOM 准直器。(2)心肌代谢显像:显像剂为18F-FDG(北京原子高科股份有限公司);显像设备为德国西门子PET/CT(Biograph mCT 型)仪。患者在2 d 内均行门控99Tcm-MIBI SPECT/CT 静息心肌灌注显像和门控18F-FDG PET/CT 心肌代谢显像,具体方法参照本团队既往研究[10-11]。(3)采用德国西门子3.0T 磁共振仪器(MAGNETOM Verio,A Tim System)、32 通道表面相控阵线圈和心电门控技术进行CMR检查;心脏电影序列包括左心室短轴及两腔心、三腔心及四腔心长轴电影图像;扫描参数:重复时间(TR)3.50 ms,回波时间(TE)1.51 ms,视野(FOV)340 mm×289 mm,像素1.3 mm×0.3 mm×8.0 mm,左心室短轴层厚8 mm,采集8~10 层。
心肌图像处理与分析:(1)图像分析由2 位有经验的核医学科医师共同阅片,其中1 位为核医学高级职称医师。门控SPECT 和门控PET 数据均采用迭代法进行图像重建,得到左心室短轴、垂直长轴和水平长轴断层图像。采用QGS 软件分析门控SPECT 和门控PET 断层图像,获得左心室整体功能参数,包括左心室射血分数(LVEF)、左心室收缩末期容积(LVESV)和左心室舒张末期容积(LVEDV)。采用QPS 软件,按照美国心脏协会17 节段法和5 分法[12]评估心肌对99Tcm-MIBI 和18F-FDG 的摄取情况,分值越高代表心肌对99Tcm-MIBI 和18F-FDG 的摄取程度越低(0 分为正常,1 分为轻度减低,2 分为中度减低,3 分为重度减低,4 分为缺损),分别获得心肌灌注和心肌代谢异常的总积分,并计算二者差值,灌注异常分-代谢异常分≥1 分,即心肌灌注-代谢“不匹配”,定义为冬眠心肌。每个心肌节段占左心室面积的6%,计算冬眠心肌节段占左心室面积的百分比,即冬眠心肌范围[13]。QPS 软件将左心室短轴断层影像自心尖段展开所形成的二维同心圆图像,并以不同颜色显示左心室各室壁显像剂分布的相对百分计数值,即18F-FDG 放射性摄取值(%)。(2)选取左心室舒张末期、收缩末期短轴位电影图像,导入CMR 后处理软件中,软件自动勾画出心内、外膜边界并自动计算心功能参数(LVEF、LVEDV 和LVESV)。由门控SPECT、门控PET 和CMR 得到的LVEDV 和LVESV 根据体表面积来矫正,获得左心室收缩末期容积指数(LVESVI)和左心室舒张末期容积指数(LVEDVI)。左心室舒张末期室壁厚度(EDWT)的测定由高年资医师完成,测量2 次后取平均值作为最终心肌厚度。根据既往研究,将左心室EDWT ≥6 mm 定义为左心室室壁厚度正常,而左心室EDWT<6 mm 定义为左心室室壁厚度减小[5,14]。既往研究表明,在左心室EDWT <4 mm的心肌节段中,血运重建后仅有20%的心肌节段局部室壁运动有所改善[15]。为此,本研究将左心室EDWT<4 mm 的心肌节段定义为极薄心肌。根据冬眠心肌范围和极薄心肌节段数,将患者分为四组:A组(冬眠心肌范围≤10%、极薄心肌节段数<2 个);B 组(冬眠心肌范围≤10%、极薄心肌节段数≥2个);C 组(冬眠心肌范围>10%、极薄心肌节段数<2 个);D 组(冬眠心肌范围>10%、极薄心肌节段数≥2 个)。
随访方法:以全因死亡作为随访终点,采用查阅患者病案系统、与患者或其亲属电话联系的方法进行随访。
统计学方法:采用SPSS 26.0 软件进行统计学分析。符合正态分布的定量资料以均数±标准差表示,非正态分布的定量资料以中位数(P25,P75)表示。对CMR 测定左心室室壁厚度减小的心肌节段进行分析,多组间定量资料比较采用独立样本t检验或Mann-Whitney U 检验;采用Spearman 相关分析评估左心室不同类型心肌中EDWT 和18F-FDG 放射性摄取值的相关性。采用χ2检验或Fisher 确切概率法分析四组间全因死亡率的差异;采用Cox 单因素和多因素分析评估全因死亡的独立危险因素;通过Kaplan-Meier 方法获得生存曲线,采用log-rank 检验法比较各组间生存率的差异。P<0.05 为差异有统计学意义。
2 结果
2.1 75 例患者的一般临床资料
在本研究纳入的75 例患者中,男性69 例(92.0%),平均年龄(57±10)岁,平均身高(170.1±7.3)cm,平均体重(74.1±10.8)kg;陈旧性心肌梗死35 例(46.7%),高血压36 例(48.0%),糖尿病26 例(34.7%),高脂血症17 例(22.7%),吸烟41 例(54.7%),饮酒22 例(29.3%);47 例(62.7%)接受血运重建治疗,28 例(37.3%)接受药物治疗。
2.2 SPECT、PET 和CMR 检查结果及不同类型心肌中EDWT 和18F-FDG 放射性摄取值的相关性
CMR 检查结果显示,共有546 个心肌节段EDWT<6 mm,结合SPECT 静息心肌灌注和18F-FDG PET 心肌代谢显像,将这些心肌节段共分为三类:心肌灌注正常,共185 个节段(33.9%);冬眠心肌(心肌灌注与心肌代谢“不匹配”),共161个节段(29.5%);梗死心肌(心肌灌注与心肌代谢“匹配”),共200 个节段(36.6%)。这三类心肌节段间的EDWT 和18F-FDG 放射性摄取值差异均有统计学意义(P均<0.01),其中心肌灌注正常节段的EDWT 最厚[5.0(4.1,5.5)mm],而冬眠心肌节段的18F-FDG 放射性摄取值最大[69.0%(61.5%,75.0%)],见图1。
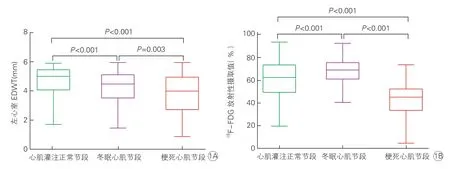
图1 左心室三类心肌节段的EDWT 和18F-FDG 放射性摄取值比较
Spearman 分析结果显示,心肌灌注正常节段和冬眠心肌节段的EDWT 和18F-FDG 放射性摄取值均无明显相关性(P均>0.05),仅梗死心肌节段的EDWT 与18F-FDG 放射性摄取值呈弱相关(r=0.247,P<0.001)。在梗死心肌节段中,67.5%(135/200)的心肌节段18F-FDG 放射性摄取值<50%[39.0%(29.0%,45.0%)]。在18F-FDG 放射性摄取值<50%的心肌节段中,EDWT [3.8(2.8,4.8)mm]与18F-FDG 放射性摄取值呈弱相关(r=0.200,P=0.02)。但在18F-FDG 放射性摄取值≥50%的心肌节段中,EDWT [4.2(3.5,5.1)mm]与18F-FDG 放射性摄取值无明显相关性(P=0.073)。
2.3 根据冬眠心肌范围和极薄心肌节段数区分的四组患者及其左心室功能比较(表1)
根据冬眠心肌范围联合极薄心肌节段数,在75 例患者中,A 组(冬眠心肌范围≤10%、极薄心肌节段<2 个)13 例(17.3%),B 组(冬眠心肌范围≤10%、极薄心肌节段≥2 个)14 例(18.7%),C组(冬眠心肌范围>10%、极薄心肌节段<2 个)21例(28.0%),D 组(冬眠心肌范围>10%、极薄心肌节段≥2 个)27 例(36.0%)。四组间左心室功能各参数的差异均无统计学意义(P均>0.05)。
2.4 四组患者的生存情况分析
中位随访31.0(22.9,37.1)个月,11 例(14.7%)患者死亡。A 组、B 组、C 组、D 组的全因死亡率分别为0%、0%、14.3%(3/21)和29.6%(8/27),组间差异有统计学意义(P=0.022)。Kaplan-Meier 生存曲线示,四组间的累积生存率差异也有统计学意义(log-rank χ2=9.788,P=0.02,图2)。
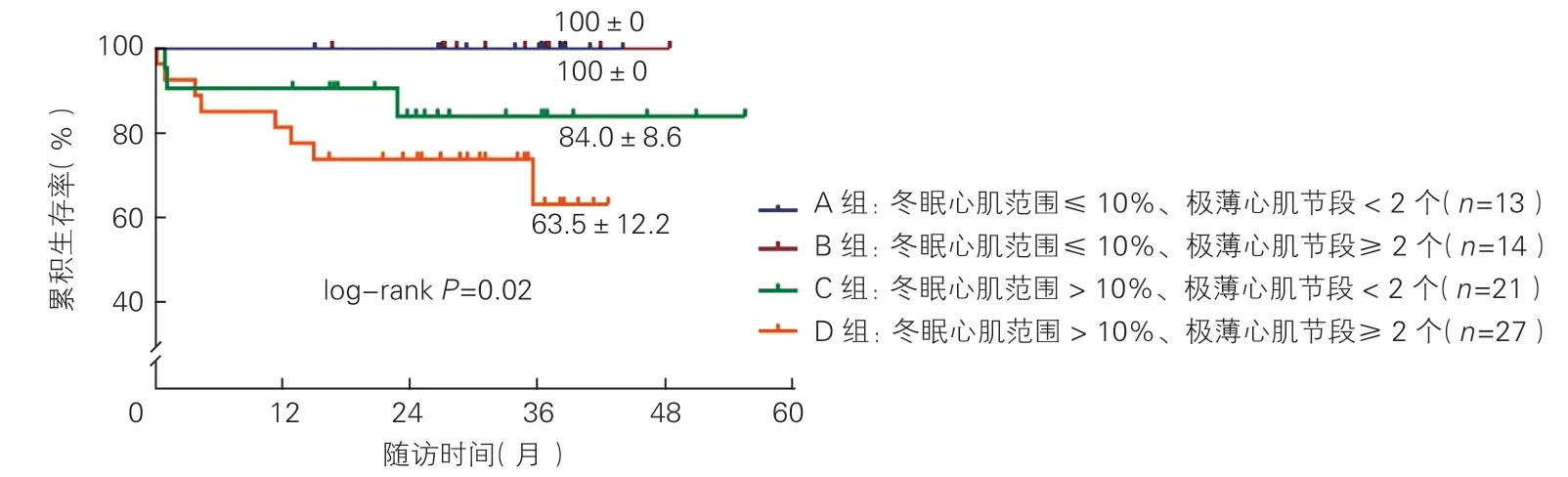
图2 四组的累积生存率比较
2.5 缺血性心肌病患者全因死亡危险因素的Cox 单因素及多因素回归分析(表2)
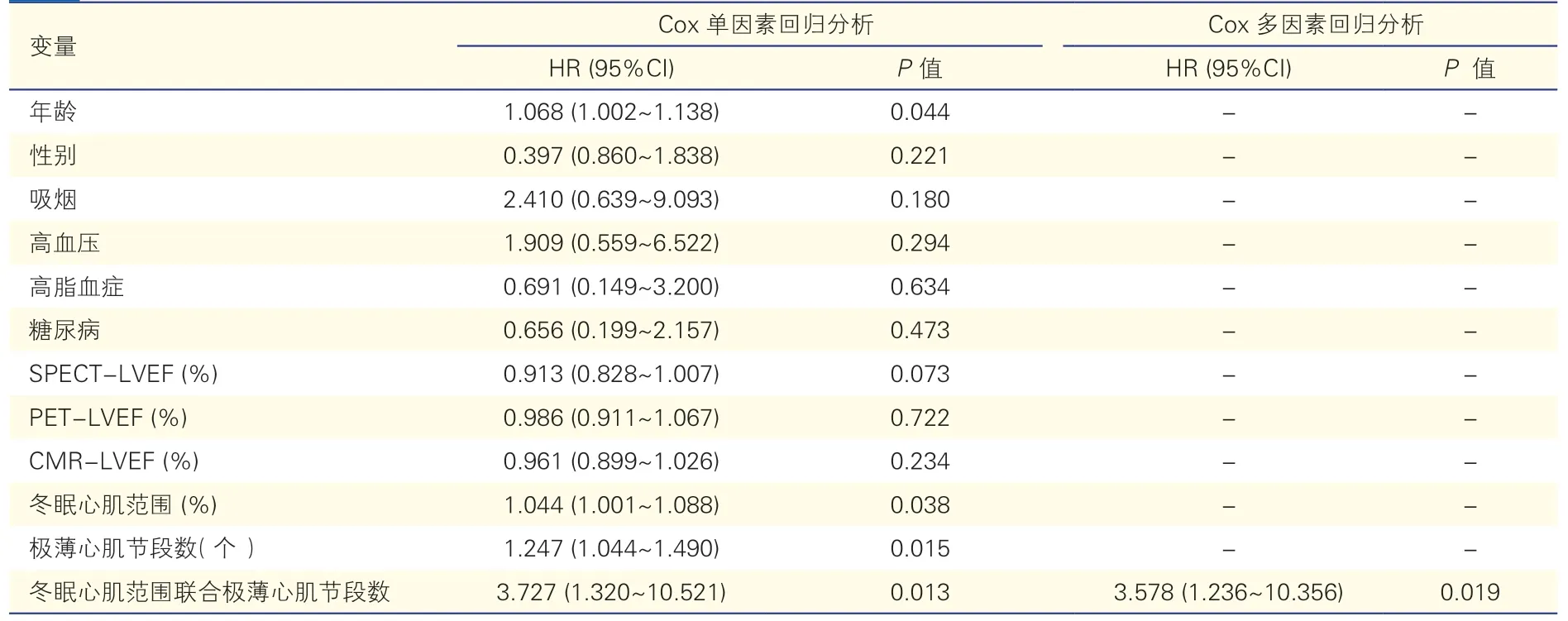
表2 缺血性心肌病患者全因死亡危险因素的Cox 单因素及多因素回归分析
Cox 单因素回归分析示,年龄(HR=1.068,95%CI:1.002~1.138,P=0.044)、冬眠心肌范围(HR=1.044,95%CI:1.001~1.088,P=0.038)、极薄心肌节段数(HR=1.247,95%CI:1.044~1.490,P=0.015)、冬眠心肌范围联合极薄心肌节段数(HR=3.727,95%CI:1.320~10.521,P=0.013)均为缺血性心肌病患者全因死亡的独立危险因素。校正年龄和性别后,Cox 多因素回归分析示,PET 评估的冬眠心肌范围联合CMR 测定的极薄心肌节段数是缺血性心肌病患者全因死亡的唯一独立危险因素(HR=3.578,95%CI:1.236~10.356,P=0.019)。
3 讨论
本团队既往研究发现,有冬眠心肌的缺血性心肌病患者如果未接受血运重建治疗而仅采用药物治疗,预后较差,心原性死亡率较高[11,16]。STICH 亚组研究显示,冬眠心肌与冠状动脉旁路移植术后是否获益无明显相关性[17]。但该研究的局限性在于采用SPECT 和多巴酚丁胺负荷超声心动图评估冬眠心肌,并未采用评估冬眠心肌的“金标准”——PET心肌代谢显像。既往研究报道,缺血性心肌病合并心力衰竭患者的5 年死亡率高达50%~84%[18]。因此,在临床实践中,对这类患者如何制定个体化治疗策略,一直是国内外心血管研究领域的难题。
本研究回顾性纳入75 例缺血性心肌病患者,其心功能极差[CMR 检查示,LVEDV 为183.0(141.2,244.3)ml,LVESV 为135.9(106.9,182.8)ml,LVEF 为25.1%(20.6%,33.0%)],合并严重的心力衰竭,中位随访31 个月,总死亡率达14.7%。临床治疗方案的选择对于改善这些高危患者的预后极其重要,而如何精准评估冬眠心肌和梗死心肌极其关键。因此,本研究采用SPECT 心肌灌注显像和PET 心肌代谢显像来评估冬眠心肌,结合CMR 评估极薄心肌,利用这些不同影像学手段各自的优势,改善对该类患者的危险分层。
既往研究采用CMR 延迟强化评估心肌疤痕组织,发现这种方法具有重要的临床价值[6]。但是,由于该检查方法需要使用对比剂,肾功能受损患者禁忌使用,且成像时长和成像质量受诸多因素影响,一定程度上限制了其应用。CMR 电影序列可精确测量各心肌节段的室壁厚度,在形态学上可判断心肌是否存活。早期研究认为,CMR 测定的左心室EDWT <5~6 mm,提示心肌为不可逆的梗死心肌,无需采用PET 评估冬眠心肌。但后续研究发现,CMR 测定的左心室室壁厚度(EDWT <5 mm)对于预测梗死心肌有很高的灵敏度但特异度低,这些区域可能仍然有冬眠心肌[5,19]。
本研究发现,在缺血性心肌病患者中,42.8%(546/1 275)的心肌节段变薄(EDWT <6 mm),但根据SPECT 心肌灌注显像和PET 心肌代谢显像结果,其中仅36.8%的心肌节段为梗死心肌,提示在CMR 发现变薄的心肌节段中依然有大部分心肌是存活的。此外,既往研究以18F-FDG 放射性摄取值大于50%作为诊断冬眠心肌的标准[20],而本研究发现,在18F-FDG 放射性摄取值<50%的心肌节段中,心肌对18F-FDG 的放射性摄取值和EDWT 之间存在弱相关性,即室壁越薄,心肌葡萄糖代谢活性越低,提示存活的心肌比例越少。这可以解释为:在缺血性心肌病的进展过程中,如果患者未及时接受血运重建治疗来改善心肌血供,那么存活的心肌细胞会逐步转化为梗死的纤维组织,随着纤维组织比例增加而冬眠心肌不断减少,室壁逐步变薄,心肌组织对葡萄糖的代谢也逐步降低[21]。
既往有研究报道,在诊断冬眠心肌时,联合PET 和CMR 两种方法比单独采用其中任何一种方法的准确度更高[7]。在本研究中,多因素Cox 回归分析结果表明,SPECT 和PET 评估的冬眠心肌范围联合CMR 测定的极薄心肌节段数是缺血性心肌病患者全因死亡的独立危险因素(HR=3.578,95%CI:1.236~10.356,P=0.019),提示SPECT 和PET 评估的冬眠心肌范围联合CMR 测定的极薄心肌节段数对缺血性心肌病患者的危险分层有重要价值。冬眠心肌范围大(>10%)且极薄心肌节段多(≥2 个节段)的患者预后最差;而冬眠心肌范围小(≤10%)的患者,无论是否合并极薄心肌,即便合并重度心力衰竭,均预后良好,这类患者可选择药物治疗,可避免血运重建的手术风险并减少医疗费用。
然而,本研究存在明显的局限性:本研究为单中心回顾性研究,入选对象为同时行SPECT 心肌灌注显像、PET 心肌代谢显像和CMR 的缺血性心肌病患者,在临床实践中通常是病情重、难以制定治疗决策的患者,因此入选的时间跨度较大,不仅病例数量有限,随访时间差异也较大,存在研究对象选择性偏倚。因此,需要进一步增加样本量,启动多中心合作研究,来进一步验证本研究结果。
总之,本研究发现,CMR 测定的变薄心肌(EDWT <6 mm)节段中仍然有较高比例的冬眠心肌。更重要的是,SPECT 和PET 评估冬眠心肌联合CMR 测定左心室室壁厚度,可改善对缺血性心肌病患者的危险分层,期望可指导个体化治疗方案的制定,最终改善患者预后。
利益冲突:所有作者均声明不存在利益冲突

