度洛西汀联合盐酸羟考酮对晚期癌性疼痛患者的疗效及焦虑抑郁情绪的影响*
耿连华,曹汉忠
(南通大学附属南通肿瘤医院 麻醉科,江苏 南通 226006)
癌性疼痛是晚期肿瘤患者常见症状之一,严重的爆发痛或持续性疼痛对患者的身心造成巨大伤害,有30%~50%癌症患者会经历中度、重度疼痛,80%左右晚期癌症患者会出现疼痛,55%左右晚期癌症患者存在重度疼痛[1-2]。肿瘤患者合并慢性疼痛则严重影响患者生活质量,易出现心理障碍,多表现为焦虑、抑郁等不良情绪,重度癌性疼痛患者抑郁发生率可达90%以上[3]。虽然世界卫生组织已推荐治疗癌性疼痛流程,但仍有至少20%的癌性疼痛无法有效缓解[4]。如何安全、高效地控制癌症患者的疼痛、改善其不良情绪成为临床关注的焦点。
目前临床多采用阿片类镇痛药物治疗癌性疼痛,但阿片类镇痛用药仍存在较大争议,阿片类药物长期应用易导致痛觉过敏。因此越来越多的国内外学者提出联合用药策略[5-6]。近期研究指出去甲肾上腺素(Norepinephrine,NE)与5-羟色胺(5-hydroxytryptamine,5-HT)再摄取抑制剂对改善癌症患者的神经病理性疼痛具有一定优势[7]。度洛西汀是5-HT 再摄取抑制剂类抗抑郁药物,最新研究显示用羟考酮缓释片联合度洛西汀可明显改善晚期癌性疼痛伴抑郁患者疼痛、抑郁、焦虑情绪,且安全性良好[8]。但该研究涉及的结果多为主观指标,缺乏不同时间段的客观指标进一步明确。国内尚缺乏度洛西丁联合阿片类镇痛药用药疗效的随机对照研究报道,鉴于此,本研究特针对上述问题开展前瞻性研究,以便为度洛西丁联合用药策略提供理论依据,现报道如下。
1 资料与方法
1.1 一般资料
选取2018 年3 月—2021 年10 月南通大学附属南通肿瘤医院收治的晚期癌性疼痛患者82 例作为研究对象。将患者分为对照组和研究组,各41 例。其中,男性46 例,女性36 例;年龄45~78 岁;原发消化道肿瘤44 例,呼吸系统肿瘤23 例,生殖系统肿瘤15 例。纳入标准:①晚期恶性肿瘤且简明疼痛量表(brief pain inventory,BPI)[9]评分中24 h 内平均疼痛程度≥ 4 分;②能口服药物;③医院焦虑抑郁量表(hospital anxiety and depression scale,HADS)[10]评分<20 分;④预计生存期≥ 3 个月;⑤签署知情同意书。排除标准:①存在认知或沟通障碍;②伴有严重外周神经疾病、精神疾病或精神疾病家族遗传史;③近2 周内服用抗抑郁药物;④药物滥用、药物成瘾;⑤对治疗药物过敏;⑥同时进行介入治疗(神经毁损或鞘内吗啡泵植入等治疗)。两组一般资料比较,差异无统计学意义(P>0.05),具有可比性。见表1。
1.2 方法
对照组口服羟考酮(北京萌蒂制药有限公司,国药准字J20140125,10 mg/片),初始剂量为10 mg/12 h,开始口服即给予滴定,并24 h 内完成。采用盐酸吗啡片(东北制药集团沈阳第一制药有限公司,国药准字H20063220,5 mg/片)处理爆发痛(疼痛评分≥4 分),首次给药24 h 时根据个体化治疗原则调整羟考酮剂量(疼痛评分≤ 3 分),将前24 h 羟考酮剂量+前24 h 即释吗啡解救量(口服羟考酮10 mg 相当于口服吗啡20 mg)作为羟考酮服用剂量,口服1次/12 h,最高用药剂量为200 mg/12 h。
研究组在对照组的基础上给予度洛西汀(浙江华海药业股份有限公司,国药准字H20173355,20 mg/片)治疗,第1 周剂量为40 mg/d,口服2 次/d,第2周根据患者疼痛、耐受情况将剂量调整为60 mg/d。两组均持续治疗4 周后观察疗效。
1.3 观察指标
①两组羟考酮人均日口服剂量。②疼痛评分:分别在治疗前、治疗2 周后、治疗4 周后、静息时采用BPI 量表评估患者疼痛情况,包括目前疼痛情况、24 h 内最轻微疼痛情况、24 h 内最剧烈疼痛情况、24 h 内平均疼痛程度,每个项目0~10 分,BPI 总分40 分,分数越高表明疼痛越剧烈。③疼痛相关因子。分别于治疗前、治疗2 周后、治疗4 周后抽取患者静脉血液,离心,收集血清液,采用放射免疫分析法测定血清前列腺素E2(prostaglandin E2,PEG2)、P 物质(substance P,SP)水平。④焦虑抑郁状况评分:采用HADS 对患者治疗前、治疗2 周后、治疗4 周后焦虑抑郁情绪进行评定,该量表包括焦虑、抑郁2个亚量表(各7个条目),每个条目0~3分,总分42分,总分越高表示焦虑、抑郁程度越严重。⑤神经递质表达评价:分别于治疗前、治疗2 周后、治疗4 周后抽取患者空腹静脉血液,离心,收集血清,采用酶联免疫吸附试验测定血清NE、5-HT 水平。⑥不良反应:统计两组患者治疗期间便秘、头晕、恶心呕吐、嗜睡、心悸等不良反应情况。
1.4 统计学方法
数据分析采用SPSS 18.0 统计软件。计量资料以均数±标准差()表示,比较用t检验或重复测量设计的方差分析,进一步两两比较用LSD-t检验;计数资料以构成比或率(%)表示,比较用χ2检验。P<0.05 为差异有统计学意义。
2 结果
2.1 两组羟考酮人均日口服剂量比较
研究组、对照组的羟考酮人均日口服剂量分别为(65.43±5.57)mg、(75.12±6.03)mg,经t检验,差异有统计学意义(t=7.558,P=0.000),研究组低于对照组。
2.2 两组治疗前后BPI评分比较
研究组与对照组治疗前、治疗2 周后、治疗4 周后的静息状态下BPI 评分比较,经重复测量设计的方差分析,结果:①不同时间点的BPI 评分有差异(F=8.287,P=0.000);②两组静息状态下BPI 评分有差异(F=5.346,P=0.000),研究组治疗后较对照组低,相对镇痛效果较好;③两组BPI 评分变化趋势有差异(F=8.965,P=0.000)。见表2。
表2 两组治疗前后BPI评分比较(n=41,分,)

表2 两组治疗前后BPI评分比较(n=41,分,)
注 :①与治疗前比较,P <0.05;②与治疗2周后比较,P <0.05。
2.3 两组治疗前后PEG2、SP比较
研究组与对照组治疗前、治疗2 周后、治疗4 周后的PEG2、SP 比较,经重复测量设计的方差分析,结果:①不同时间点的PEG2、SP 有差异(F=8.036 和8.547,均P=0.000);②两组PEG2、SP 有差异(F=7.838 和7.594,均P=0.000),研究组治疗后较对照组低,相对镇痛效果较好;③两组PEG2、SP 变化趋 势有 差异(F=8.117 和8.495,均P=0.000)。见表3。
表3 两组治疗前后PEG2、SP比较(n=41,)
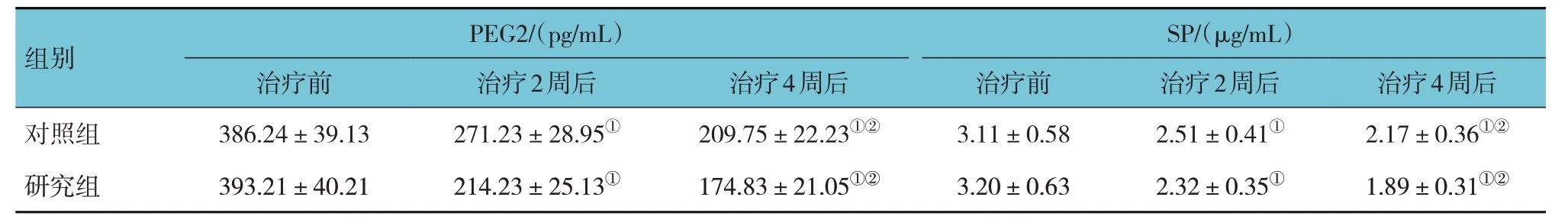
表3 两组治疗前后PEG2、SP比较(n=41,)
注 :①与治疗前比较,P <0.05;②与治疗2周后比较,P <0.05。
2.4 两组治疗前后HADS评分比较
研究组与对照组治疗前、治疗2 周后、治疗4 周后的HADS 评分比较,经重复测量设计的方差分析,结果:①不同时间点的HADS 评分有差异(F=9.108,P=0.000);②两 组HADS 评分有差 异(F=8.005,P=0.000),研究组较对照组低;③两组HADS 评分变化趋势有差异(F=8.469,P=0.000)。见表4。
表4 两组治疗前后HADS评分比较(n=41,分,)
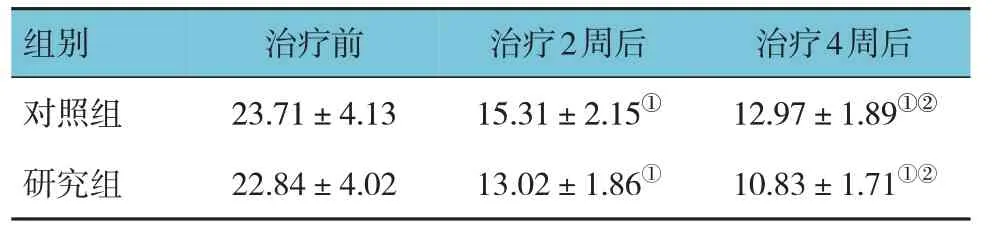
表4 两组治疗前后HADS评分比较(n=41,分,)
注 :①与治疗前比较,P <0.05;②与治疗2周后比较,P <0.05。
2.5 两组治疗前后5-HT、NE比较
研究组与对照组治疗前、治疗2 周后、治疗4 周后的5-HT、NE 比较,经重复测量设计的方差分析,结果:①不同时间点的5-HT、NE 有差异(F=8.746 和8.417,均P=0.000);②两组5-HT、NE 有差异(F=8.124 和7.895,均P=0.000),研究组治疗后较对照组高;③两组5-HT、NE 变化趋势有差异(F=8.235 和8.874,均P=0.000)。见表5。
表5 两组治疗前后5-HT、NE比较(n=41,)

表5 两组治疗前后5-HT、NE比较(n=41,)
注 :①与治疗前比较,P <0.05;②与治疗2周后比较,P <0.05。
2.6 两组不良反应比较
治疗期间对照组有3 例便秘、2 例恶心呕吐、1 例头晕、1 例嗜睡,不良反应率为17.07%,研究组有2 例便秘、3 例恶心呕吐、2 例头晕、1 例嗜睡、1 心悸,不良反应率为21.95%。两组不良反应率比较,差异无统计学意义(χ2=0.311,P=0.577)。
3 讨论
多数癌症患者会经历中度、重度癌性疼痛,需使用强效镇痛药治疗。临床上癌性疼痛基本以癌症相关神经病理性疼痛为主,多由于肿瘤或肿瘤转移造成外周或中枢神经系统损伤,导致疼痛发生,这种疼痛难以治愈,目前阿片类药物是临床针对癌性疼痛的主要方式,但部分患者需服用大剂量阿片类药物才可达到满意镇痛效果,易导致药物的耐受、滥用、成瘾以及患者内分泌紊乱等一系列问题。焦虑抑郁、疼痛具有类似的生物学途径、神经递质基础及传入神经通路,疼痛可引发焦虑抑郁等不良情绪反应,焦虑抑郁、疼痛可互相影响,不良情绪可降低疼痛阈值,增加疼痛敏感性,加重癌性疼痛,促进肿瘤生长,影响癌症患者预后及生活质量[11]。自2018 年起美国国家综合癌症网络成人癌性疼痛指南[12]将癌症患者“4A”疼痛管理改调整为“5A”,即添加了“疼痛、情绪间的联系”,指出癌症患者不仅需要止痛治疗,也应该注意改善情绪治疗的重要性。度洛西汀具有抗抑郁、中枢镇痛作用,目前有研究已证实度洛西汀在多种同时伴有抑郁及疼痛症状的疾病中有效,但度洛西汀联合阿片类镇痛药在晚期癌性疼痛患者中是否可取得满意疗效尚缺乏报道[13-14]。
本研究发现,研究组治疗后羟考酮人均日口服剂量低于对照组;研究组治疗后BPI 评分、PEG2、SP较对照组低,相对镇痛效果较好,提示联合用药可以降低患者的BPI 评分,同时降低患者血液中的PEG2、SP,提示对晚期癌性疼痛患者实施度洛西汀联合羟考酮治疗可明显减轻疼痛,笔者推测可能与疼痛相关因子水平降低有关,也可能与度洛西汀通过5-HT 和NE 调控情感及疼痛敏感度,提高机体疼痛耐受力相关。研究组与对照组的HADS 评分、NE、5-HT 有差异,研究组HADS 评分较对照组低,NE、5-HT 较对照组高,说明度洛西汀联合阿片类镇痛药治疗晚期癌性疼痛可改善神经递质含量并抑郁情绪。度洛西汀作为NE 与5-HT 的再摄取物,可提高机体中枢神经系统突触间隙的NE 与5-HT 浓度,进而发挥抗抑郁效果。此外,度洛西汀还可通过抑制神经元5-HT 和NE 的再摄取,增强下行疼痛抑制感受通路系统,恢复下行抑制与下行易化之间的平衡,抑制脊髓内伤害性刺激信号的上传递,达到镇痛作用。
LISINSKI 等[15]研究表明,度洛西汀可降低伴有疼痛症状的抑郁者血液中SP 含量,在治疗抑郁症的同时也可缓解抑郁症患者伴发的慢性疼痛。MATSUOKA 等[16]研究指出,对阿片类药物及普瑞巴林治疗无反应或不耐受的癌症相关神经病理性疼痛患者应用度洛西汀,可明显缓解难治性癌症相关神经病理性疼痛。CURRY 等[17]研究显示,相较于美沙酮,度洛西汀联合美沙酮治疗癌性相关疼痛对患者疼痛、情绪改善效果更明显,与本研究结果类似。LU 等[18]研究指出度洛西汀减轻抗肿瘤药物引起的神经性疼痛可能与聚ADP-核糖聚合酶、肿瘤抑制基因p53及Bcl2 家族细胞凋亡调节剂有关。本研究显示两组药物不良反应相似,有便秘、恶心呕吐、头晕、嗜睡,但症状轻微,未终止或更换用药方案,对症治疗症状可逐渐消失;两组不良反应率无差异,提示对晚期癌性疼痛患者实施度洛西汀联合阿片类镇痛药治疗安全可靠。王建俊等[19]研究指出,度洛西汀对持续性躯体形式疼痛障碍患者不影响治疗副反应量表评分,提示度洛西汀药物安全性较高,与本研究结果相似。
综上所述,度洛西汀联合盐酸羟考酮治疗晚期癌性疼痛可减轻患者疼痛,降低羟考酮用量及疼痛相关因子水平,改善焦虑抑郁情绪,上调神经递质表达,且安全性良好。受时间、精力、经济等多方面限制,本研究仍存在不足之处,纳入对象有限,且为单中心研究,后期仍需开展多中心、大样本量研究进一步佐证本研究结论。

