黄芪多糖对泌乳初期奶牛血清生化指标、瘤胃发酵及表观消化率的影响
■徐丽云 郑梦荷 许子豪 仝钰洁 蒋 文 邵 伟,2*
(1.新疆农业大学动物科学学院,新疆乌鲁木齐 830052;2.新疆奶业工程技术研究中心,新疆乌鲁木齐 830052)
黄芪(AR)是指蒙古黄芪、膜荚黄芪的根,主要产于山西、甘肃和黑龙江等地,含有多糖、皂苷、黄酮等多种生物活性成分,具有抗衰老、抗肿瘤、利水消肿、增强免疫力等作用[1]。黄芪多糖(Astragalus polysaccharides,APS)是从AR中提取、分离、纯化后得到一种天然活性成分,其成分与结构复杂多样,主要由单糖间的α-型糖苷键连接[2],具有抗炎、抗菌、抗氧化、增强免疫活性等生物学功能[3],对动物生产性能、机体免疫力、抗氧化性能等都具有积极作用,并且安全性高、无残留、不产生耐药性[4]。研究表明,多糖类物质可以抑制瘤胃中原虫的增殖,促进瘤胃内细菌数量的增加,提高对营养物质的降解,并且可提高瘤胃对挥发性脂肪酸(Volatile fatty acid,VFA)的吸收速率,促进瘤胃发酵性能[5]。唐姣玉等[6]发现每日为非酒精性脂肪肝大鼠灌服100、200、400 mg/kg APS 能明显抑制血清总胆固醇(Total cholesterol,TC)、三酰甘油(Triglyceride,TG)和低密度脂蛋白含量,表明APS 可降低脂肪肝大鼠血脂水平,减慢肝脏脂肪积累。李建房等[7]发现,每日为肉鸡补饲0.1%黄芪多糖可显著提高其血清总蛋白含量。目前,关于APS 在生产中的应用多见于猪、鸡等畜禽养殖上。因此,本试验通过向泌乳初期奶牛灌服不同剂量APS,探究APS 对泌乳初期奶牛血清生化指标、瘤胃发酵及表观消化率的影响,旨在初步阐明APS 对反刍动物的作用和应用价值,以期为APS 的进一步开发应用提供科学的理论依据。
1 材料与方法
1.1 试验材料
中国荷斯坦奶牛,由新疆昌吉吉缘牧业有限公司提供;黄芪多糖,购自山西百人得生物科技有限公司,为棕黄色粉末状,纯度为70%;胃管式瘤胃液采样器,购自武汉科立博科技有限公司。
1.2 试验设计与分组
选择体重为(600±50.00)kg、泌乳天数为(40±15)d、胎次为(2.70±0.93)胎以及泌乳量为(45.69±7.15)kg/d且健康的泌乳初期荷斯坦奶牛44 头,随机分为对照组(CK 组)和试验组(APS20、APS55 组和APS90 组),每组11 头,且4 组初始产奶量差异不显著(P>0.05)。所有试验牛均饲喂基础饲粮,在此基础上,试验组每日分别灌服含20、55、90 g APS 的水溶液200 mL,CK组每日灌服200 mL 温水,进行为期70 d(预试期10 d,正试期60 d)的饲养试验。
1.3 试验设计与饲养管理
所有试验奶牛均在相同饲养管理条件下进行,于每日清晨7:30 灌服,预先将20、55、90 g APS 分别加入装有200 mL 温水的灌服瓶中。其中,对照组灌服200 mL温水,试验期牛群自由采食、饮水。试验牛泌乳期日粮营养水平参照NRC(2021)配制,基础饲粮组成及营养水平见表1。
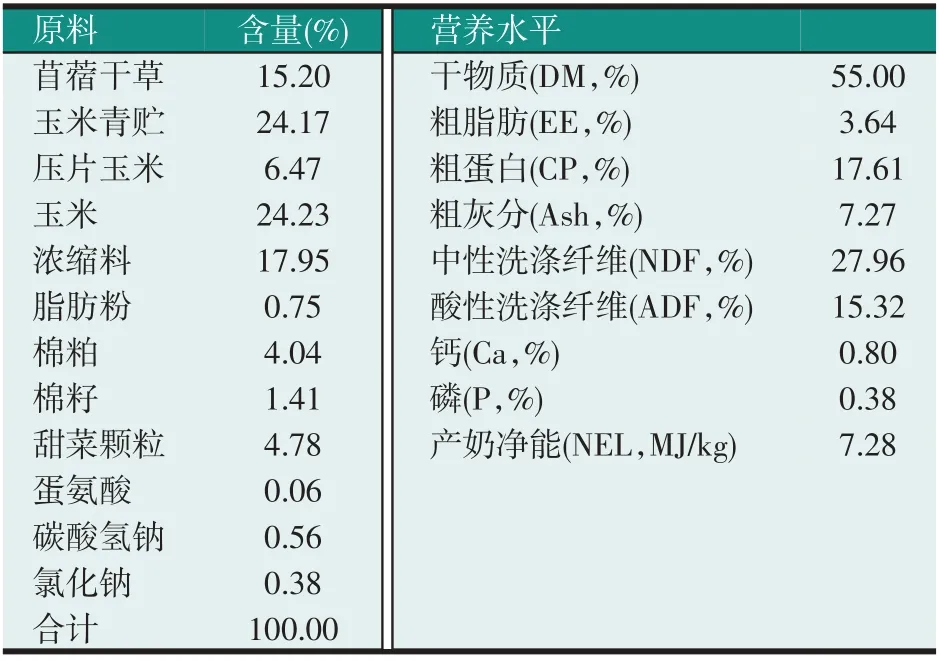
表1 基础饲粮组成及营养水平(DM基础)
1.4 样品采集
1.4.1 饲料样品的采集
正试期开始后,每10 d 为一个采集日,每个采集日收取三次圈舍的TMR 饲料,混合后采用四分法取500 g 样品,存于-20 ℃冰箱中,用于干物质(DM)、中性洗涤纤维(NDF)、酸性洗涤纤维(ADF)、粗蛋白(CP)、粗脂肪(EE)和粗灰分(Ash)等常规营养成分的测定。
1.4.2 血液样品的采集
于正试期的第0、30、60天晨饲前,对各组奶牛尾根静脉采血样10 mL,常温促凝后3 500 r/min 离心15 min,收集血清分装至2 mL Eppendorf管,存于-20 ℃冰箱中,用于测定血清中代谢物含量。
1.4.3 瘤胃液样品的采集
采用口腔采集器采集各组试验牛正试期第60天晨饲前瘤胃液,抽取前50 mL 瘤胃液舍弃,再进行抽取,立即测定pH,然后分为3部分,经四层纱布过滤后分装于3个15 mL离心管中,存于-20 ℃冰箱中,测定瘤胃发酵参数,包括挥发性脂肪酸(Volatile fatty acid,VFA)浓度、氨态氮(Ammoniacal nitrogen,NH3-N)浓度、微生物蛋白(Microprotein,MCP)含量。
1.4.4 粪样的采集
在正试期最后3 d,每组随机抽取8头奶牛,采用直肠取粪法人工收集粪样。分别在采样期第1 天的06:00、11:00、16:00 和21:00,第2 天的7:00、12:00、17:00和22:00,第3天的8:00、13:00、19:00和24:00采集250 g/头的粪样,共采样12 次。将收集到的粪样准确称量、混匀后取2 份(每份250 g)作为样品,记录重量。其中一份需进行酒石酸固氮;另一份置于-20 ℃冰箱中保存待测。添加酒石酸的样品用于CP 含量的测定,另一份未添加任何试剂的样品用于DM、EE、ADF、NDF、Ash、酸不溶灰分(AIA)含量的测定。样品于550~600 ℃高温炉中全部氧化后剩余的残渣为粗灰分,原质量-粗灰分质量即为有机物含量。
1.5 样品检测
1.5.1 营养成分表观消化率的测定
饲料样品及粪样中相关营养成分的测定方法见表2。参照刘永青等[8],利用内源指示剂法(AIA 作为指示剂)计算营养成分的表观消化率。

表2 饲料中营养成分的测定方法
某营养物质的表观消化率(%)=100-[100×(日粮中AIA含量/粪中AIA含量)×(粪中该营养物质含量/日粮中该营养物质含量)]
1.5.2 瘤胃液中发酵指标的测定
瘤胃液pH 采用pH 818 pH 仪测定;VFA 浓度参照刘文涛等[9]的方法测定;MCP 的含量参照李琛[10]的方法测定;NH3-N浓度参照李晴[11]的方法测定。
1.5.3 血清中相关代谢物含量检测
血清中总蛋白(TP)、总胆固醇(TC)、三酰甘油(TG)、肌酐(CREA)、尿素氮(BUN)含量采用比色法测定。
1.6 统计分析
试验的原始数据用Excel 2006进行初步处理,采用SAS 19.0 统计分析软件进行单因素方差分析,用Duncan’s 法进行多重比较,结果以“平均值、标准误(SEM)”表示,以P<0.05为差异显著水平,P<0.01为差异极显著水平,P>0.05为差异不显著水平。
2 结果与分析
2.1 黄芪多糖对奶牛血清代谢产物的影响
由表3 可知,试验组试验全期血清TP 含量均高于CK 组,但差异均不显著(P>0.05)。与CK 组相比,试验组血清TG、BUN 含量有所降低,但各组间差异不显著(P>0.05)。第60 天时,CK 组血清CREA 含量显著高于APS55组(P<0.05)。

表3 不同剂量APS对奶牛血清代谢产物的影响
2.2 黄芪多糖对奶牛瘤胃发酵指标的影响
由表4 可知,60 d 时,各组间pH 无显著差异(P>0.05);APS55组乙酸浓度显著高于CK组(P<0.05),丙酸浓度极显著高于CK组(P<0.01),APS20组与APS90组乙酸、丙酸浓度均高于CK 组,但无显著差异(P>0.05);APS20 与APS55 组丁酸浓度极显著高于CK 组(P<0.01),APS90 组显著高于CK 组(P<0.05);试验组TVFA 含量均高于CK 组,但无显著差异(P>0.05);APS55 组NH3-N 浓度显著高于APS90 组(P<0.05);APS90 组MCP 含量显著低于CK 组(P<0.05),极显著低于APS55组(P<0.01)。

表4 灌服不同剂量APS对奶牛瘤胃发酵的影响
2.3 黄芪多糖对奶牛营养物质表观消化率的影响
营养物质表观消化率见表5。由表5 可知,试验组各营养物质表观消化率与CK 组相比,均有不同程度的提高。其中,APS55 组DM 表观消化率显著高于CK组(P<0.05),APS55组Ash表观消化率极显著高于CK、APS20、APS90 组(P<0.01),试验组OM、CP、EE、NDF、ADF 表观消化率与CK 组之间无显著差异(P>0.05)。

表5 灌服不同剂量APS对奶牛营养物质表观消化率的影响(DM基础,%)
3 讨论
3.1 黄芪多糖对奶牛血清代谢产物的影响
血清生化指标可作为间接反映动物机体生长代谢、生理健康的重要依据[12]。血清中TP、CREA、BUN可以作为反映动物机体蛋白质代谢和氨基酸平衡状况的重要指标[13]。血清BUN 的变化与瘤胃中氨氮浓度以及肠道中氨基酸的组成有关,可反映机体对蛋白质的利用状况,其含量的变化可对肌肉等组织的蛋白质沉积产生影响,在机体对含氮物质的利用方面具有积极作用[14-17]。全雪容等[18]研究发现,为银星竹小鼠补喂600 mg/kg APS可显著提高其血清中TP浓度,降低BUN、CREA浓度。向建洲等[19]研究发现,为大白鼠补喂400 mg/kg APS 可显著提高其血清中TP 浓度以及降低血清中BUN浓度。文月玲等[20]研究发现,每日分别为奶牛补饲10、50、90 g/头APS,其血清中TP 浓度均有所提高,BUN、CREA 浓度均有降低,能促进机体蛋白质合成。本试验中,试验组血清TP浓度与CK组相比,均有所上升,这可能是因为灌服APS 能够提高饲料的转化率,促进蛋白质的合成,同时APS 对血清中TP浓度影响程度可能与动物种类、生长环境、营养状态有关。
血清BUN与CREA主要由肾脏排泄产生,其变化可以用来评价机体肾脏功能的状况,当肾脏功能受损时,肾小球的过滤能力减弱,会造成大量的BUN、CREA滞留在血清内,导致其浓度升高[21]。本试验中,试验组全期BUN、CREA 浓度无显著变化,且呈一定的降低趋势,说明灌服APS 对奶牛机体、肾脏机能无不良影响的同时可增强肾脏功能。
血清TC、TG分别在机体肝脏、脂肪组织中合成,其含量的变化能够反映出动物体内脂代谢的情况[22-24]。在健康的生理条件下,血清中TG含量较低,当其水平异常增加时,则可能导致机体脂肪营养代谢紊乱。吴雅清等[25]研究表明,多糖类物质降血脂的机制在于能够增强机体抗氧化酶的活性,降低MDA的含量,清除体内多余的活性氧自由基,减少脂质过氧化反应。本试验中,试验组TC、TG含量与CK组相比无显著差异,60 d 时TC 还有所下降,推测是APS 能够提高机体抗氧化性能,抑制脂质的过氧化积累,从而降低血清中TC的浓度。研究发现,陈思羽等[26]分别向高脂血症大鼠灌服700 mg/kg、100 mg/kg APS,可以降低其血清中TC、TG 的浓度;杨秋霞等[27]向蛋鸡分别补饲50、100、150、200 mg/kg 和250 mg/kg APS 可不同程度降低其血清中TC、TG的浓度,这均与本试验结果一致。表明APS对血清中TC和TG具有抑制作用,其原因可能是多糖类物质改善机体脂代谢的异常,可通过影响脂质在机体内的吸收,降低TC含量;也可以通过改变与脂代谢相关的基因表达[28];还能通过调控脂肪合成过程关键酶的活性,影响脂肪的合成[29]。
3.2 黄芪多糖对奶牛瘤胃发酵的影响
瘤胃内VFA能够为反刍动物提供60%~80%的能量[30]。APS 引起瘤胃VFA 浓度变化与瘤胃微生物区系结构的变化有关[31]。APS 可促进瘤胃内纤维素、蛋白质分解菌等有益菌的生长,增加其降解速率,有利于碳水化合物发酵,促进VFA合成,通过降低乙酸/丙酸值,调节瘤胃发酵模式趋于丙酸发酵,提高能量的转化效率[32]。Deng等[32]通过体外试验证明,75、100 mg/L黄芪提取物可以增加TVFA 产量,降低乙酸/丙酸值。Zhong等[33]研究发现,补喂15 g/kg APS后,羔羊瘤胃丙酸浓度得到显著提高,乙酸/丙酸值降低。本试验中,试验组乙酸浓度均高于CK组;APS20、APS55组丙酸、TVFA 浓度均高于CK 组;各试验组乙酸/丙酸值均低于CK 组。这可能是APS 使饲粮中更多的淀粉、纤维素和半纤维素在瘤胃内被微生物发酵产生乙酸和丙酸,提高了TVFA 的浓度,而瘤胃发酵类型趋于丙酸发酵,可能是由于纤维素与半纤维素降解率提高,瘤胃微生物获取到更多的碳水化合物,发酵产生更多的丙酸,改变了发酵类型,提高了能量的转化与利用率。
NH3-N 是饲料中蛋白质及非蛋白氮在瘤胃中的降解产物[34],也是瘤胃内微生物合成MCP 的底物,MCP 的合成量可以反映微生物摄取和利用NH3-N 的能力[35]。姜士凯[36]提出瘤胃内NH3-N 正常浓度为5.00~31.45 mg/100 mL,在此范围内NH3-N 浓度下降表明瘤胃微生物对其利用效率提高。本试验中,试验组NH3-N浓度与此接近,但与CK组相比,APS20组与APS90组NH3-N浓度呈下降趋势,说明减少了瘤胃内氮循环过程中的氮损失。吴和龙[37]通过体外发酵试验证明,添加菌草灵芝菌糠多糖可以提高瘤胃内NH3-N浓度以及MCP含量。本试验中APS55组NH3-N 浓度和MCP 含量,与其他组相比均有所提高,可能是与一定时间内瘤胃微生物分解蛋白质的效率和合成MCP均有所增加有关。
3.3 黄芪多糖对奶牛营养物质表观消化率的影响
消化率是衡量动物消化性能的一个重要指标[38-39]。本试验中,试验组各营养物质消化率均高于CK组,其中,试验组CP 与EE 消化率的提高,原因可能是APS可通过促进瘤胃微生物增殖,提高降解各类营养物质的消化酶活性,进而导致营养物质的降解和VFA的生成[40]。同时,试验组CP 的消化率提高,还可能与APS可促进瘤胃MCP的合成有关。NDF和ADF是动物粗饲料中主要的能量来源,在瘤胃内进行分解发酵[41]。试验组NDF与ADF消化率与CK组相比有上升趋势,可能是APS通过抑制瘤胃中原虫的数量,促进瘤胃中相关分解菌的增殖,进而提高纤维素、半纤维素的利用率和乙酸浓度[5]。本试验中,试验组DM表观消化率均高于CK组,其中APS55组DM消化显著高于CK组;王义翠等[42]研究发现,5、10 g/头APS可显著提高断奶犊牛平均日采食量;冯士彬等[43]按湖羊羔羊精料3%的比例添加1 g/mL 的APS 可显著提高其DM、CP、EE表观消化率,表明APS对动物机体营养物质的消化吸收具有积极作用,可一定程度上提高动物的生产性能。侯伟革等[44]发现,向断奶仔猪补饲0.02%、0.05%、0.1% APS 后,可提高其CP、EE 表观消化率。杨新宇等[45]发现,向獭兔日粮中添加0.15% APS,其DM、OM、CP 表观消化率有提高的趋势,说明APS 提高机体对饲料利用率的同时,也因动物种类、生活环境、营养水平等原因而表现出一定的差异。
4 结论
在本试验研究条件下,灌服不同剂量APS可改善奶牛脂代谢,促进蛋白质的沉积,对奶牛肝肾功能无显著影响,同时促进奶牛瘤胃发酵和改善瘤胃发酵模式,改变瘤胃氨态氮浓度以及挥发性脂肪酸浓度,提高奶牛对营养物质的表观消化率,且每头牛以灌服55 g/d时的效果最佳。

