膳食结构对柑橘类胡萝卜素生物利用度和抗氧化活性的影响
李梦杰,潘思轶
(华中农业大学食品科学技术学院,湖北 武汉 430070)
柑橘作为世界第一大类水果,是天然类胡萝卜素的重要来源[1]。类胡萝卜素不仅赋予了柑橘良好的营养品质,同时使柑橘呈现出诱人的色泽。类胡萝卜素是天然存在的脂溶性色素,具有抗氧化功能,并能转化为维生素A原,增强机体免疫力,对癌症和心血管疾病等也具有一定的预防作用[2]。体外模拟消化是通过模拟胃肠道环境的生物学特性,能够在一定程度上反映某些食物或药物在人体胃肠道中复杂物理化学及生理变化情况的一种方法[3]。植物源食物经过体外模拟消化后,含有的某些植物次生代谢物可能会发生降解或转化,导致其含量及生理活性等改变[4]。
类胡萝卜素由于溶解度和化学稳定性差、易与食品组分结合等因素的影响,在人体内的消化吸收和生物利用通常较差。大部分果蔬中类胡萝卜素的生物利用度通常不到10%[5]。袁曦等[6]研究发现菠菜中β-胡萝卜素经体外模拟消化后含量显著下降。Lyu等[7]研究发现南瓜果肉经体外模拟消化后,不仅类胡萝卜素含量显著下降,其抗氧化能力也显著降低。然而加入玉米油会显著减缓体外模拟消化过程中类胡萝卜素的损失,进而提高其生物利用度和抗氧化活性。da Costa等[8]研究也发现在水果饮料中添加脱脂牛奶和蔗糖会影响类胡萝卜素的消化过程(胶束的形成等),从而使类胡萝卜素生物利用度增加。而在另一项研究中却发现,加入蔗糖会使南瓜食糜的黏度增加,导致进入脂滴中的消化酶数量减少,进而减少了类胡萝卜素的释放[9]。因此,食品组分的摄入会在一定程度上影响类胡萝卜素在消化过程中的含量,进而影响其生物利用度和抗氧化活性。然而,在日常膳食中的食物组分往往更复杂,且由于各地饮食习惯不同,人们摄入的某些特定食物组分含量也有所差异。不同的膳食结构对果蔬中植物次生代谢物的生物利用度和抗氧化活性的影响也存在较大的差异。针对特定的食物和活性成分,探寻合适的膳食结构,对于促进食物中活性成分的释放、提高其生物利用度和生理活性具有重要意义。
本实验以临海涌泉蜜橘为原料,利用体外模拟消化模型系统研究由乳清蛋白、大豆油和玉米淀粉3 种食物组分通过不同比例组成的混合物与柑橘共存消化后对柑橘类胡萝卜素生物利用度和抗氧化活性的影响,以期探明不同膳食结构对类胡萝卜素消化吸收的影响机制,为提高果蔬中类胡萝卜素生物利用度、充分发挥其功效,进而改善人体健康状况提供一定的参考。
1 材料与方法
1.1 材料与试剂
临海涌泉蜜橘为市售,挑选新鲜无损伤果实;乳清蛋白、大豆油和玉米淀粉均购于上海源叶生物科技有限公司。
α-唾液淀粉酶(11 U/mg)、胃蛋白酶(599 U/mg)、胰酶(200 U/mg)、胰脂肪酶(388 U/mg)和2,6-二叔丁基-4-甲基苯酚(butylated hydroxytoluene,BHT)美国Sigma公司;牛胆粉、2,4,6-三吡啶基三嗪(2,4,6-tris(2-pyridyl)-S-triazine,TPTZ)、1,1-二苯基-2-苦基肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)、2,2’-联氨-双-(3-乙基苯并噻唑啉-6-磺酸)二铵盐(2,2’-azinobis(3-ethylbenzothiazoline-6-sulfonic acid) diammonium salt,ABTS)和6-羟基-2,5,7,8-四甲基色烷-2-羧酸(Trolox) 上海源叶生物科技有限公司;甲醇和甲基叔丁基醚(methyl tert-butyl ether,MTBE)(色谱纯)美国Fisher公司;其他试剂均为分析纯 国药集团化学试剂有限公司。
1.2 仪器与设备
e2695型高效液相色谱仪(配有紫外-可见光检测器和Empower色谱工作站) 美国Waters公司;UV-1800紫外分光光度计 日本岛津科学仪器公司;高速离心机美国Beckman Coulter公司;SHA-B恒温振荡器 江苏太仓实验设备厂;Multiskan GO酶标仪 美国Thermo公司。
1.3 方法
1.3.1 样品预处理
柑橘经过剥皮、破壁后得到柑橘浆。根据中国居民膳食指南和部分地区居民饮食习惯[10-12],将4 组样品可分为正常膳食组(normal diet,N)、高蛋白膳食组(highprotein diet,HP)、高脂膳食组(high-fat diet,HF)和高糖膳食组(high-sugar diet,HS)。操作如下:分别向50 mL离心管中加入3 g不同比例的乳清蛋白、大豆油和玉米淀粉混合物,再各加入2 g柑橘浆,混合充分后得到各组样品。其中各样品组中乳清蛋白、大豆油和玉米淀粉的组成比例(以体系质量计)由三大营养素供能比计算得出,如表1所示。
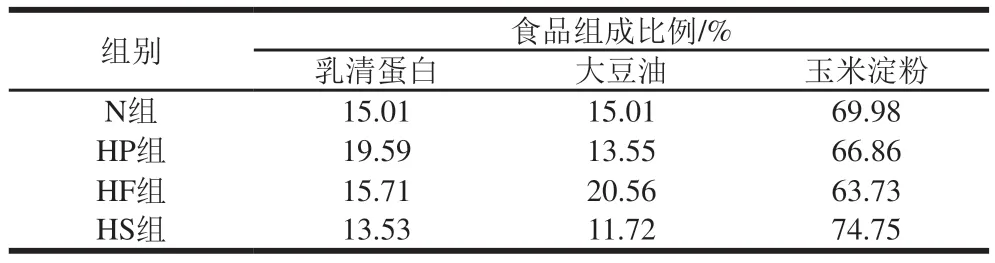
表1 各样品组中3 种食品组成比例Table 1 Proportions of three food constituents in four dietary structures
1.3.2 体外模拟消化
结合蛋白质、油脂和淀粉的消化特性,参考INFOGEST体外模拟消化程序[13]并稍作修改,构建模拟消化道,包括模拟口腔、胃和小肠3 个消化阶段。
1.3.2.1 模拟消化液的配制
模拟唾液(simulated salivary fluid,SSF)、模拟胃液(simulated gastric fluid,SGF)和模拟小肠液(simulated intestinal fluid,SIF)的配制具体见表2。
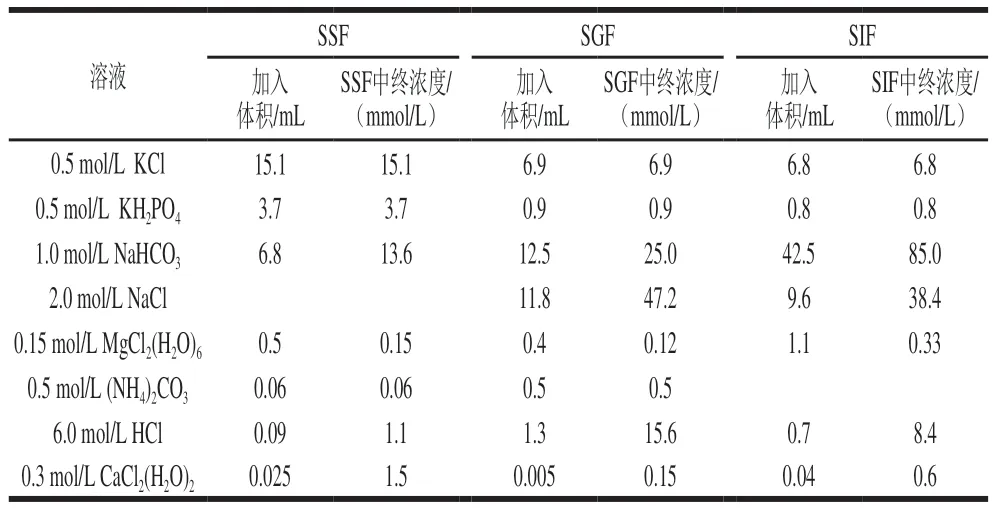
表2 模拟消化液的配制Table 2 Preparation of simulated digestion solutions
1.3.2.2 模拟口腔消化
准确称取68.18 mgα-唾液淀粉酶与4 mL SSF浓缩液混合,加入0.025 mL 0.3 mol/L CaCl2(H2O)2溶液并加超纯水至5 mL,37 ℃水浴预热5 min后,加入5 g样品并用1 mol/L NaOH溶液调节至pH 7.0。所得混合物在37 ℃下恒温振荡(150 r/min)2 min,得到模拟口腔消化液样品。
1.3.2.3 模拟胃消化
准确称取66.78 mg胃蛋白酶与8 mL SGF浓缩液混合,加入0.005 mL 0.3 mol/L CaCl2(H2O)2溶液并加超纯水至10 mL,与口腔消化样品混合后用1 mol/L的HCl溶液调节至pH 3.0。所得混合物在37 ℃下恒温振荡(150 r/min)2 h,得到模拟胃消化液样品。
1.3.2.4 模拟小肠消化
准确称取20 mg胰酶、20.62 mg胰脂肪酶和0.41 g牛胆粉与16 mL SIF浓缩液混合,加入0.04 mL 0.3 mol/L的CaCl2(H2O)2溶液并加超纯水至20 mL,与胃消化样品混合后用1 mol/L的NaOH溶液调节至pH 7.0。所得混合物在37 ℃下恒温振荡(150 r/min)2 h,得到模拟小肠消化液样品。
1.3.3 柑橘类胡萝卜素含量测定
1.3.3.1 类胡萝卜素的提取
类胡萝卜素的提取参考Biehler等[14]的方法并进行改进,分别取一定体积的各阶段消化液样品和胶束相,以体积比1∶1加入提取液(V(正己烷):V(丙酮):V(乙醇)=2∶1∶1,含0.1% BHT)后振荡30 s,在10000 r/min、4 ℃下离心5 min并收集上清液,按上述方法重复3 次至样品无色,最后将3 次离心收集到的上清液合并,并用体积分数10%甲醇-氢氧化钾溶液皂化1 h。皂化后的提取液用蒸馏水清洗3 次除去极性部分(乙醇),再用质量分数10%氯化钠溶液清洗3 次破除乳化态的类胡萝卜素(样品用于类胡萝卜素含量测定)。样品用氮气吹扫至有机溶剂挥发完毕,放置于-80 ℃下贮存备用。进行抗氧化分析前样品用2 mL甲醇-MTBE(1∶2,V/V,含0.1% BHT)溶液复溶;进行色谱分析时,样品用上述试剂复溶后过0.22 μm微孔滤膜。所有步骤均在低温下进行,注意避光。
1.3.3.2 类胡萝卜素含量测定
总类胡萝卜素含量采用紫外-分光光度法[15]测定。将不同阶段提取物样品在450 nm波长处测定吸光度(以正己烷为空白),以不同质量浓度梯度的β-胡萝卜素标准品溶液绘制标准曲线,得到类胡萝卜素标准曲线方程为y=0.0749x-0.0084,R2=0.9992。样品中的总类胡萝卜素含量以每克柑橘中所含β-胡萝卜素质量表示,单位为μg/g。
通过高效液相色谱法分析和定量样品中类胡萝卜素单体的含量。采用YMC 色谱柱:C30(250 mmh 4.6 mm,5 μm),保护柱C30(25 mmh 4.0 mm,5 μm)。流动相参考Zhang Bing等[16]的研究,流动相A为V(甲醇)∶V(MTBE)∶V(水)=81∶15∶4;流动相B为V(甲醇)∶V(MTBE)=10∶90;梯度洗脱程序:0 min,100% A;25 min,75% A;80 min,15% A;82 min,100% A。流速:1 mL/min,检测波长:450 nm,柱温:25 ℃,进样量:20 μL。
1.3.4 类胡萝卜素生物利用度的测定
经小肠消化后的样品在10000 r/min、4 ℃下离心1 h,离心后的消化液分为3 层,从下到上分别为不溶性沉淀、胶束相和未消化油脂。用注射器吸收中间胶束相,经过0.45 μm微孔滤膜过滤后于-80 ℃下保存。按下式计算总类胡萝卜素生物利用度[17]。
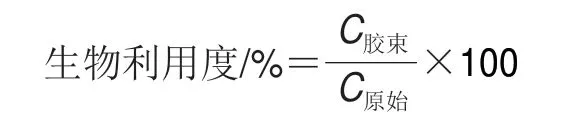
式中:C胶束为胶束相中总类胡萝卜素含量/(μg/g);C原始为原始样品中总类胡萝卜素含量/(μg/g)。
1.3.5 类胡萝卜素抗氧化活性的测定
1.3.5.1 铁离子还原力
铁离子还原力的测定参考Benzie等[18]的方法并进行改进。300 mmol/L醋酸钠缓冲液(pH 3.6)、20 mmol/L氯化铁溶液和10 mmol/L TPTZ溶液(40 mmol/L HCl溶液定容)以体积比10∶1∶1混匀制备TPTZ反应液,使用前在37 ℃下恒温水浴10~15 min。准确吸收0.1 mL类胡萝卜素提取物复溶液与3 mL TPTZ反应液在37 ℃下反应30 min,于593 nm波长处测定吸光度。用不同的Trolox溶液在0~800 μmol/L范围内绘制标准曲线,根据标准曲线方程计算样品反应后Trolox当量,结果以每升样品反应生成Trolox物质的量计,单位为μmol/L。
1.3.5.2 DPPH自由基清除能力
DPPH自由基清除能力的测定参考Wang Yongtao等[19]的方法并进行改进。准确吸取280 μL DPPH溶液(0.1 mmol/L)与20 μL类胡萝卜素提取物复溶液于96 孔板中混合,在室温下避光反应30 min,于517 nm波长处测量混合物吸光度。用不同的Trolox溶液在0~100 μmol/L范围内绘制标准曲线,根据标准曲线方程计算样品反应后Trolox当量,结果以每升样品反应生成Trolox物质的量计,单位为μmol/L。
1.3.5.3 ABTS阳离子自由基清除能力
ABTS阳离子自由基清除能力的测定参考Jeong等[20]的方法并进行改进。7.00 mmol/L ABTS溶液与2.45 mmol/L过硫酸钾溶液以体积比1∶1混合,然后在黑暗条件下孵育16 h制备得到ABTS反应液。在使用前将ABTS反应液进行稀释,使其在734 nm波长处的吸光度为0.70f 0.02。准确吸取200 μL类胡萝卜素提取物复溶液与3 mL稀释过的ABTS反应液在暗处反应1 h,于734 nm波长处测定吸光度。用不同的Trolox溶液在0~200 μmol/L范围内绘制标准曲线,根据标准曲线方程计算样品反应后Trolox当量,结果以每升样品反应生成Trolox物质的量计,单位为μmol/L。
1.4 数据统计与分析
所有实验均为3 次重复,实验数据以平均值±标准差表示。采用Origin 9.0软件制图。利用SPSS 20.0软件进行单因素方差分析(Duncan’s test),P<0.05为差异显著;采用Pearson correlation test进行相关性分析。
2 结果与分析
2.1 不同消化阶段总类胡萝卜素的含量及其生物利用度
由图1A可知,在不同体外消化阶段,不同样品组中的总类胡萝卜素含量都发生了显著变化,且整体呈下降趋势。经过模拟口腔消化后,各样品组中总类胡萝卜素含量在56.77~66.98 μg/g之间,这是因为模拟口腔阶段的振荡和孵育会破坏食品结构并减小颗粒体积,使细胞中的类胡萝卜素被释放[7]。然而,在经过模拟胃和小肠消化阶后,各样品组中总类胡萝卜素含量分别下降了24.34%~31.55%和9.14%~11.59%。这主要是由于酸性条件(pH 3.0)导致了类胡萝卜素的降解并抑制了其转移,而在高pH值环境中类胡萝卜素的稳定性增加[21-22]。此外,胆汁盐是小肠消化液的主要成分,这有助于类胡萝卜素在混合胶束中的增溶作用,从而提高了其转移效率[23]。在整个消化过程中,HF组的总类胡萝卜素含量始终高于其他组,而HP组的总类胡萝卜素含量始终低于其他组。这是因为类胡萝卜素为脂溶性色素,在各消化阶段释放后会溶解到油相中,而HF组中大豆油含量较高,为类胡萝卜素提供了较好的疏水环境,因此在消化阶段内保持较高的水平。
由图1B可知,各样品组中的类胡萝卜素生物利用度在15.27%~24.08%之间。HF组中类胡萝卜素生物利用度((24.08f 1.78)%)显著高于其他组,其中比N组((19.26f 1.06)%)高4.82%;HP组中类胡萝卜素生物利用度((15.27f 0.90)%)比N组低3.99%;HS组中类胡萝卜素生物利用度((19.71f 1.58)%)与N组之间无显著性差异。这表明部分食品组成含量较高时能够显著影响类胡萝卜素在消化过程中的稳定性,进而影响其生物利用度。

图1 不同样品组中不同消化阶段总类胡萝卜素的含量和生物利用度Fig.1 Content and bioavailability of total carotenoids in different samples at different digestion stages
2.2 不同消化阶段两种类胡萝卜素单体的含量
β-隐黄质和β-胡萝卜素是临海涌泉蜜橘中的主要类胡萝卜素单体物质,其在消化过程中的含量变化如图2所示。随着消化的进行,各样品组中β-隐黄质和β-胡萝卜素的含量均呈下降的趋势。β-隐黄质是涌泉蜜橘中含量最高的类胡萝卜素单体,各样品组原始阶段中的含量在35.7~36.58 μg/g之间,约占原始总类胡萝卜素含量的30%。经过模拟口腔消化后,β-隐黄质含量分别降低了65.59%(HP组)、64.54%(HS组)、61.12%(N组)和53.33%(HF组),且HF组和N组中β-隐黄质含量显著高于其他组。模拟胃消化阶段,HP组中β-隐黄质的含量显著高于N组和HS组,这是因为在酸性条件下,类胡萝卜素与蛋白质形成的复合物构型被破坏,使得更多的类胡萝卜素被释放出来[24]。模拟小肠消化阶段结束后,可观察到各组中β-隐黄质含量均低于5 μg/g,且HS组的β-隐黄质含量显著低于其他组。各样品组中β-胡萝卜素含量占原始总类胡萝卜素含量的12.75%~13.04%。在各消化阶段,HF组中β-胡萝卜素含量始终显著高于其他组,这表明油脂能够增加β-胡萝卜素的释放进而提高其含量。模拟胃和小肠消化阶段后,HS组的β-胡萝卜素含量(1.63 μg/g和0.58 μg/g)均最低。
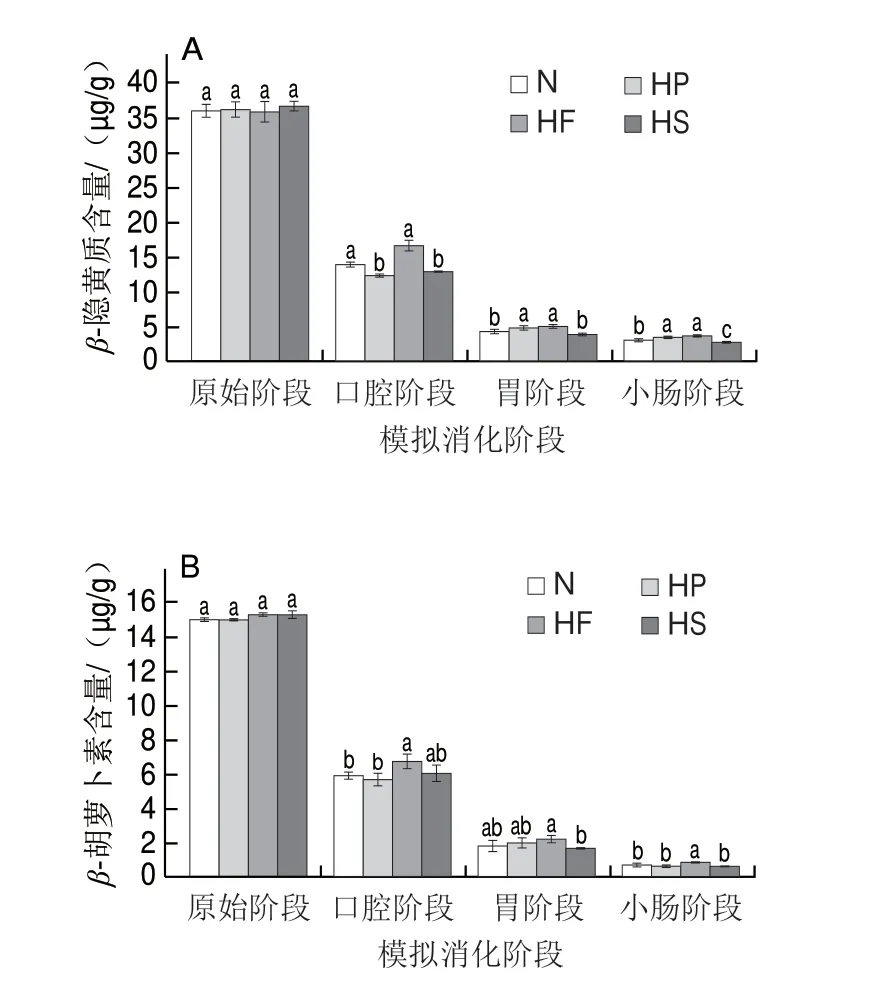
图2 不同样品组中不同消化阶段类胡萝卜素单体的含量Fig.2 Contents of β-cryptoxanthin and β-carotene in different samples at different digestion stages
2.3 不同消化阶段类胡萝卜素提取物抗氧化活性
为了进一步考察在消化过程中不同膳食结构对类胡萝卜素提取物抗氧化活性的影响,采用不同的分析方法对类胡萝卜素提取物进行抗氧化活性测定。随着消化的进行,柑橘类胡萝卜素提取物的抗氧化活性呈逐渐下降的趋势(图3),这与总类胡萝卜素及其单体含量的变化趋势一致。由图3A可知,同一消化阶段内,不同样品组的铁离子还原力存在显著差异,其中HF组的铁离子还原力在模拟胃和小肠消化阶段始终是4 个样品组中最高的,分别为605.88、502.94 μmol/L。模拟胃和小肠消化阶段后HS组的铁离子还原力始终显著低于其他组。同时,由图3B可知,经过模拟体外消化,HF组在不同消化阶段的DPPH自由基清除能力(292.50、177.29 μmol/L和53.33 μmol/L)也始终显著高于其他组。而体外模拟小肠消化结束后HS组的DPPH自由基清除能力最低(38.13 μmol/L)。上述结果表明大豆油比例的增加会提高类胡萝卜素的抗氧化能力,而玉米淀粉比例的增加会显著降低类胡萝卜素的抗氧化能力。此外,在整个消化过程中,N组和HP组的铁离子还原力和DPPH自由基清除能力始终无显著性差异,这表明乳清蛋白比例的增加并不会显著改变类胡萝卜素在消化过程中的抗氧化活性。由图3C可知,各样品组中柑橘类胡萝卜素的ABTS阳离子自由基清除能力在经过模拟胃和小肠消化后分别下降了73.55%~77.47%和42.66%~59.31%。模拟口腔消化阶段后,HF组的ABTS阳离子自由基清除能力为3657.78 μmol/L,显著高于其他组,且在模拟胃消化阶段,HP组的ABTS阳离子自由基清除能力显著低于HF组。这可以看出脂质成分在ABTS阳离子自由基清除实验中也表现出了较显著的效果。
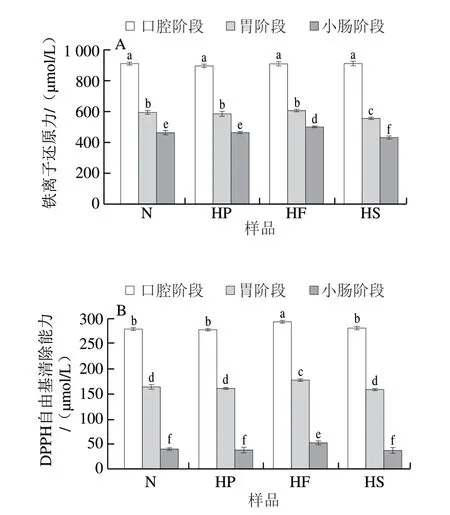

图3 不同样品组中不同消化阶段类胡萝卜素的抗氧化能力Fig.3 Antioxidant activities of carotenoids in different samples at different digestion stages
2.4 不同消化阶段的抗氧化活性与类胡萝卜素含量之间的相关性分析结果
由图4可知,在模拟体外消化过程中,柑橘类胡萝卜素提取物各消化阶段的铁离子还原力、ABTS阳离子自由基清除能力和DPPH自由基清除能力与总类胡萝卜素含量之间呈显著正相关(P<0.05);DPPH自由基清除能力与β-胡萝卜素含量之间呈显著极显著正相关(P<0.01)。此外,DPPH自由基清除能力与ABTS阳离子自由基清除能力之间也存在显著相关性(P<0.05),说明不同消化阶段类胡萝卜素含量能够较好地反映其提取物的抗氧化活性。
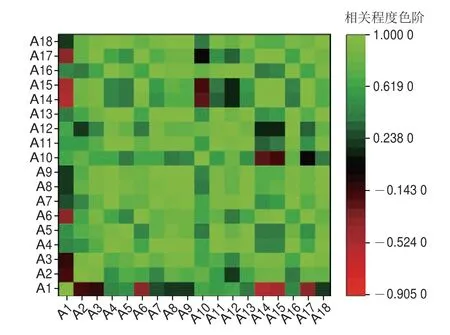
图4 不同样品不同消化阶段的类胡萝卜素抗氧化活性与总类胡萝卜素含量和两种类胡萝卜素单体含量之间的综合相关性分析Fig.4 Comprehensive correlation analysis between antioxidant activities and contents of total carotenoids,β-cryptoxanthin and β-carotene contents in different samples at different digestion stages
3 讨论
本研究采用体外模拟消化探究了不同膳食结构下柑橘类胡萝卜素提取物中总类胡萝卜素和β-隐黄质、β-胡萝卜素两种单体物质含量的变化规律,并利用铁离子还原力、DPPH自由基清除能力和ABTS阳离子自由基清除能力为综合指标评价了柑橘类胡萝卜素在各消化阶段抗氧化活性的变化情况,结果表明,柑橘与由3 种食物组分通过不同比例组成的混合物共存消化后能显著提高其类胡萝卜素生物利用度(>15%),而在消化过程中类胡萝卜素抗氧化能力降低,相关性分析结果表明类胡萝卜素含量是影响其提取物抗氧化活性的重要因素。
由于类胡萝卜素的脂溶特性和其在细胞内的特殊存在形式,类胡萝卜素被人体吸收利用前必须从有色体中释放出来,然后在消化过程中其进入油相并形成脂滴,进而在小肠消化阶段与游离脂肪酸和胆盐等成分共同形成混合胶束[25]。因此,在4 种膳食结构中,高脂膳食能够显著增加类胡萝卜素含量并提高其生物利用度,且高脂膳食组的类胡萝卜素提取物抗氧化能力也高于其他组。这不仅与类胡萝卜素含量较高有关,也可能是因为油脂中一些抗氧化成分(如丁香酸和原儿茶酸等)有助于增强样品的抗氧化活性[26]。高脂膳食不仅可提高类胡萝卜素的生物利用度,也会使消化过程中黄酮等物质的含量增加。一项研究表明,与无脂膳食相比,高脂膳食中槲皮素血液浓度提高了45%[27]。然而,也有研究表明当与含有32%油脂的饮食共同摄入时,食物中黄酮醇的生物利用度并未发生显著变化[28]。此外,张廷婷等[29]发现高脂饮食能够引起大鼠肥胖,同时还会引起血脂代谢异常,造成高脂血症。Tayyem等[30]发现高脂膳食可显著增加结直肠癌的发病风险。综上,当油脂含量过高时,不仅对食物中活性成分的生物利用度无积极影响,还会对人体健康有不利影响。
与正常膳食组相比,高蛋白膳食组中类胡萝卜素含量和生物利用度都较低。这是因为在消化过程中,类胡萝卜素会与蛋白质结合形成复合物,阻碍类胡萝卜素的转移[31]。然而,该复合物多以氢键等共价键连接,这种作用力是可逆的,易受pH值和温度等影响发生水解反应[32],因此在模拟小肠消化阶段,类胡萝卜素从类胡萝卜素-蛋白质复合物中游离出来,减缓了类胡萝卜素含量的进一步降低。同时,乳清蛋白也能显示出一定的抗氧化能力[33]。因此,在各消化阶段,高蛋白膳食组的铁离子还原力和DPPH自由基清除能力与正常膳食组之间无显著性差异。玉米淀粉会通过增加消化液的黏度、与类胡萝卜素结合减少其释放以及减少胶束的形成等影响类胡萝卜素的生物利用度[34]。然而,在本研究中,高糖膳食组的类胡萝卜素生物利用度与正常膳食组之间的差异无统计学意义。这可能是由于淀粉水解产生了人体可消化吸收的小分子糖,能够降低果胶等的抑制作用[35],对植物次生代谢物的生物利用度产生积极作用,从而抵消了淀粉本身带来的消极影响。然而,在高糖膳食组中柑橘类胡萝卜素提取物表现出较差的抗氧化能力,这可能是由于胃肠消化过程中,类胡萝卜素抑制了淀粉酶活性,使淀粉的消化率降低,类胡萝卜素难以从复合物中释放出来,从而导致其抗氧化活性的降低[36]。
由于类胡萝卜素与食物组分之间的相互作用以及食物组分本身特性,使得不同膳食结构对柑橘类胡萝卜素的生物利用度和抗氧化活性的影响有较大的差异性。然而,混合食物组分与类胡萝卜素之间的相互作用更为复杂,为深入到分子结构水平解析膳食结构对类胡萝卜素吸收利用的影响机制,后续实验仍需进行更多现代化分析检测。同时,抗氧化能力评价是一个复杂的过程,它包含了组分中各成分之间的拮抗或协同作用,需要进一步采用分离纯化手段来研究复杂提取物的活性组分与抗氧化活性之间的相关性。
4 结论
本实验通过体外模拟消化,分别对正常膳食组、高蛋白膳食组、高脂膳食组和高糖膳食组中类胡萝卜素不同消化阶段的含量、生物利用度和抗氧化活性进行动态评价,实验结果表明,在消化过程中,与正常膳食组相比,高脂膳食组的类胡萝卜素含量较高,其抗氧化能力也较强,且其生物利用度((24.08f 1.78)%)显著高于正常膳食组((19.26f 1.06)%);高蛋白膳食组的类胡萝卜素含量和抗氧化能力较低,且其生物利用度((15.27f 0.90)%)也显著低于正常膳食组;而高糖膳食组的类胡萝卜素生物利用度((19.71f 1.58)%)与正常膳食组之间无显著性差异,但其抗氧化能力较差。综上,高脂膳食可显著提高柑橘类胡萝卜素生物利用度和抗氧化活性。然而,虽然高脂膳食对类胡萝卜素的消化吸收利用有较好的影响,但其后续对人体可能带来的健康隐患(心血管疾病等)仍不可忽视。因此,在日常膳食中,要合理分配食物比例,适当降低脂质成分的比例,在保证摄入的食物成分不对人体健康造成任何危害的前提下,最大程度地发挥类胡萝卜素生理活性。

