采后茶青叶对振动力胁迫的生理响应
郝志龙,林宏政,徐邢燕,李鑫磊,俞晓敏,岳 川,孙 云,金心怡,*
(1.福建农林大学园艺学院,茶学福建省高校重点实验室,福建 福州 350002;2.浙江商业技师学院,浙江 宁波 315000;3.福建省农业科学院茶叶研究所,福建 福州 350013;4.福建农林大学海峡联合研究院,园艺植物生物学及代谢组学中心,福建 福州 350002)
乌龙茶独特的风味品质与其采后特有的加工工艺密切相关,茶梢采摘脱离茶树母体后仍是有生命活力的个体,随后的做青工艺伴随有光照、失水、冷热、力等各种非生物胁迫,诱导和促进植物多酚、挥发性物质等次生代谢物合成[1]。其中机械摇青是乌龙茶品质形成的关键工序之一,机械力胁迫作为植物主要的非生物胁迫因素之一,其生物学效应主要有激素调节机制和信号传导作用机制等,进而影响植物的光合作用、呼吸作用、活性氧代谢等一系列体内生理生化变化[2],为乌龙茶或花香红茶、白茶等特殊品质茶叶风味的最终形成奠定基础。实际生产中摇青时间主要通过做茶师傅的感官判断,目前缺乏从青叶生理变化角度判断的依据。因此,探明青叶响应持续机械胁迫的水分含量、光系统II(photosystem II,PS II)参数、抗氧化酶活性和亚细胞显微结构等生理变化规律,对指导乌龙茶摇青工艺品质调控具有重要意义。
植物对机械胁迫的生物学效应研究已由宏观水平逐渐深入到细胞和代谢水平,植物遭受机械胁迫的过程中除了宏观组织器官破损,生理活动及细胞结构也会发生较大变化。机械损伤会诱导植物受伤和邻近部位细胞壁发生栓化,形成愈伤组织,诱导细胞壁非木质化修饰,产生特殊的蛋白质和胼胝质来自我保护并适应机械损伤[3-5]。机械损伤会使细胞发生膜脂质过氧化,膜完整性遭到破坏,细胞通透性增加,进而引起组成物质渗出并降解,形成一些小分子信使物质,能够激活下游调控机制,抵御机械胁迫[6-8]。植物体在遭受机械胁迫时,细胞内氧自由基动态平衡受到影响,产生大量的活性氧,对细胞产生毒性,造成蛋白、膜脂和DNA等损伤,诱导氧化胁迫[9-10]。茶叶加工过程中抗氧化酶活性与品质形成密切相关,茶鲜叶在摊放过程中超氧化物歧化酶(superoxide dismutase,SOD)和过氧化氢酶(catalase,CAT)活性先升高后迅速降低,过氧化物酶(peroxidase,POD)活性保持升高的趋势[11]。做青前期适当晒青、摇青能够提高SOD活性,摇青过度则会抑制SOD活性提高,摇青还会使PPO活性降低,整叶PPO活性在做青过程中呈降低-升高-降低的变化规律[12-15]。摇青力属于生物力学范畴,摇青力做功能增加青叶内能,适度破损叶细胞,提高青叶能量水平[15]。叶细胞破损可通过酶作用促进内含物转化,青叶能量提高可为青叶内含物运输提供动能,促进物质运输,诱发化学反应,有利于香气形成[16]。金心怡等[15]研究发现,摇青作用力主要为机械运动力和摩擦力,不同作用力做青效果不同。机械运动力有利于青叶“走水”,机械摩擦力有利于茶多酚酶促氧化,诱发香气,运动力和摩擦力协调配合才能形成乌龙茶所特有的香高味醇品质。尽管采后果蔬振动胁迫下的生理生化变化研究较多[17-19],也有研究报道了不同振动做青工艺(包含晾青)对茶叶生理生化品质的影响[14,20-22],但有关振动力持续处理对青叶生理变化的影响尚不清楚。前期研究发现,振动力摇青具有青叶质点受力均匀、上下跳动高度一致、振动频率可精细控制等优点,能够克服滚筒摇青青叶下落高度不同而造成的受力不均匀问题,提高青叶受力均匀性,适用于小批量乌龙茶摇青试验[22]。本实验利用前期研发的振动摇青试验台为青叶提供更均匀的机械力胁迫,研究青叶对振动力胁迫的生理响应,以明确青叶响应振动力胁迫的水分含量、PS II参数、抗氧化酶活性和亚细胞显微结构等生理变化规律,为指导乌龙茶摇青工艺品质调控提供参考依据。
1 材料与方法
1.1 材料与试剂
‘铁观音’品种中开面三、四叶嫩梢采摘自福建省福清市南湖山茶业有限公司,选取长势一致的同一片生态茶园,于2017年10月统一采摘。
所用试剂均为国产分析纯。
1.2 仪器与设备
振动胁迫试验台参数:台面尺寸为1100 mmh 1200 mm,固定振幅为25 mm,功率2.2 kW,振动频率0~330 r/min,最大加速度20 g,最大负荷100 kg,可定时控制(0~60 min),最大电流5 A,电源220 V。
FE38-Meter电导率仪 瑞士梅特勒-托利多仪器有限公司;Imaging-Pam叶绿素荧光成像系统 德国WALZ公司;5430R型台式高速冷冻离心机 德国Eppendorf公司;LKB Nova超薄切片机 瑞典Bromma公司;UV-1800紫外分光光度计 美国赛默飞科技有限公司;JEM-2100高分辨透射电子显微镜 日本JEOL公司。
1.3 方法
1.3.1 茶叶的振动力胁迫处理
采摘鲜叶经适度萎凋(自然萎凋45 min)后分为两组,一组用于持续振动力处理(V组),另一组均匀摊放在相同环境条件下,不做任何处理作为对照(C组),环境温度(22.0f 0.4)℃、相对湿度(83.8f 2.0)%。以振动力胁迫时间为因素进行单因素试验,试验方案如表1所示,基于前期预试验结果,设定振动频率300 r/min使茶叶均匀振动。不同处理样品取样编号规则:萎凋叶记为C0;自然摊放5 min青叶记为C5,自然摊放10 min青叶记为C10,以此类推;持续振动力胁迫5 min青叶记为V5,持续振动力胁迫10 min青叶记为V10,以此类推。分析振动力胁迫处理150 min内(0、15、30、60、90、120、150 min)青叶第二叶水分含量变化规律,以及处理30 min内青叶气味(0、5、15、30 min)、第二叶PS II参数(0、5、10、15、30 min)、活性氧代谢酶活力(0、5、10、15、30 min)及亚细胞结构(0、5、15、30 min)变化规律。
1.3.2 指标的测定
1.3.2.1 青叶水分含量测定及青叶气味评价
参照GB/T 8304-2013《茶水分测定》[23],采用120 ℃快速烘干法测定青叶水分含量,3 次重复,取平均值。水分含量以干基水分含量表示,按式(1)计算。

式中:m1为试样烘前质量/g;m2为试样烘后质量/g。
青叶气味评价由3 位评茶经验丰富的评茶师参照茶叶感官审评的香气描述方法进行判断,并记录评语。
1.3.2.2 青叶PS II参数测定
选取5 个处理茶梢放置在暗适应箱中20 min后,将茶梢第二叶放置在Imaging-Pam叶绿素荧光成像系统叶片支架上,测定参数包含PS II实际光合效率Y(II)、非调节性能量耗散的量子产额Y(NO)、光化学猝灭系数qP、电子传递速率(electron transfer rate,ETR),每个处理重复5 次。
1.3.2.3 相对电导率测定
取备用样第二叶用自来水洗净后用蒸馏水冲洗3 次,用滤纸吸干表面水,将叶片剪成1 cmh 2 cm的长条备用,然后快速称取鲜样0.1 g,分别置于装有10 mL去离子水的试管中,盖上玻璃塞在室温下浸泡处理12 h,用电导仪测定浸提液电导率R1/(S/m),然后沸水浴加热30 min,冷却至室温后摇匀,再次测定浸提液电导率R2/(S/m),按式(2)计算相对电导率。

1.3.2.4 抗氧化酶活力测定
取备用样第二叶,用打孔器避开主脉取0.05 g左右置于预冷研钵中,加提取液(含50 mmol/L KH2PO4-KOH(pH 7.5)、5 g/100 mL不溶性交联聚乙烯吡咯烷酮、1 mmol/L乙二胺四乙酸、0.5 g/100 mL曲拉通X-100)2 mL和少量石英砂,在冰浴中研磨成匀浆,冷冻离心机15000hg离心10 min,上清液用于酶活力的测定。抗坏血酸过氧化物酶(ascorbate peroxidase,APX)、单脱氢抗坏血酸还原酶(monodehydroascorbate reductase,MDAR)、谷胱甘肽还原酶(glutathione reductase,GR)、CAT、脱氢抗坏血酸还原酶(dehydroascorbate reductase,DHAR)活力参照林郑和等[24]的方法测定。
1.3.2.5 青叶亚细胞结构观察
参照Du等[25]方法,选取各处理茶梢第二叶,避开主脉,用手术刀快速切成0.5 mmh 1.0 cm条状,置于体积分数2.5%的戊二醛固定液(以0.1 mol/L磷酸盐缓冲液配制)中,于4 ℃固定过夜,进行脱水和包埋处理后,采用LKB Nova超薄切片机切片(厚度约为70~90 nm),并将切片分别置于醋酸双氧铀和柠檬酸铅溶液中染色15 min和漂洗。在JEM-2100高分辨透射电子显微镜下选择多个视野进行观察。
1.4 数据处理与分析
采用Excel 2013以及SPSS 21.0软件分别进行数据处理和单因素方差、Duncan’s test显著性分析,以P<0.05表示差异显著。
2 结果与分析
2.1 振动力胁迫过程青叶水分含量变化
离体后的茶鲜叶在自然摊放状态下,随着时间的延长,水分不断蒸发,水分含量不断降低。本研究中青叶水分含量变化如图1所示,随着处理时间延长,水分含量逐渐降低,振动力胁迫处理青叶水分含量降低较快,但30 min内与自然摊放处理叶和萎凋叶间差异均不显著,60 min后显著低于自然摊放叶和萎凋叶(P<0.05)。由此可见,振动力持续胁迫60 min及以上能显著降低青叶的水分含量,说明振动胁迫能加速水分的散失,一定处理时间(60 min)后水分胁迫效果开始凸显,这可能是振动胁迫使青叶处于运动状态,叶表面的叶面边界层容易遭受破坏,更有利于水分的蒸发所致。因此,若要研究单纯振动力胁迫效应,则应排除因水分胁迫差异引起的效应,故后续其他生理指标分析时间点选取30 min以内。
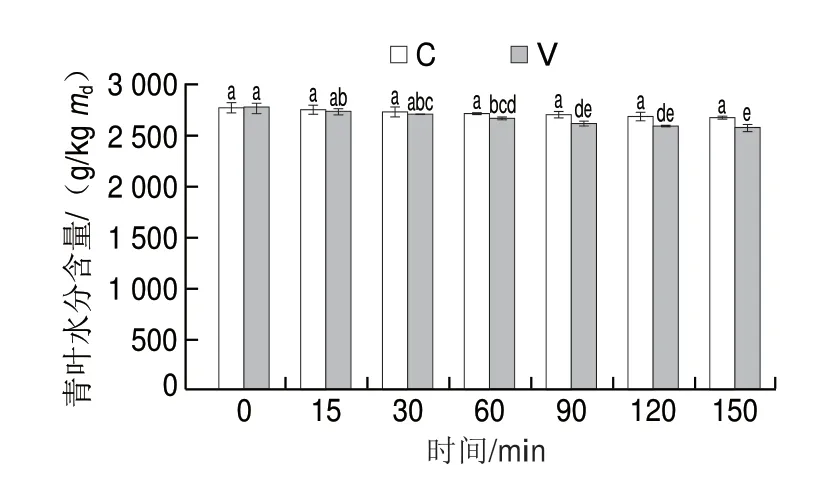
图1 振动力胁迫对青叶水分含量的影响Fig.1 Effect of vibration stress on water contents in tea leaves
2.2 振动力胁迫青叶气味变化
随着振动力胁迫时间延长,青叶气味变化如表2所示。随着振动力胁迫时间延长,青叶青臭气明显增强,萎凋阶段产生的清香减弱,而自然摊放保持萎凋的清香,青气逐渐变弱。

表2 振动力胁迫过程青叶气味变化Table 2 Changes in smell of tea leaves under vibration stress
2.3 振动力胁迫青叶PS II参数变化
植物叶片PS II参数是反映胁迫程度的重要指标,通过分析青叶PS II参数在振动力胁迫响应过程中的变化,能够明确青叶的胁迫程度及电子传递情况。叶片Y(II)为PS II反应中心实际光合效率,表示线性电子传递的量子效率,是PS II反应中心在部分关闭情况下的实际原初光能捕获效率。由图2A可知,随着振动力胁迫时间的延长,Y(II)总体逐渐降低。V5、V10的Y(II)显著低于自然摊放叶,V10达到最低值(0.0838),表明振动力胁迫使青叶光能捕获效率降低。Y(NO)为PS II反应中心非调节性能量耗散的量子产额,反映光化学能量转换、自我保护调节机制和耗散过多光能的强弱。由图2B可知,随着振动力胁迫时间的延长,Y(NO)逐渐升高,自然摊放叶相对较稳定,其中V30最大(0.1946),显著高于自然摊放叶(P<0.05)。叶片qP为PS II反应中心的光化学猝灭系数,反映PS II反应中心的开放程度及天线色素吸收的光能用于光化学反应电子传递的份额。由图2C可知,随着处理时间的延长,叶片PS II qP总体逐渐降低。振动力胁迫青叶qP下降幅度较大,V10、V15显著低于对照处理(P<0.05),V15最低,为0.2788。叶片PS II ETR为光合电子传递速率,由图2D可知,振动力胁迫青叶ETR呈先降后升的趋势,自然摊放青叶呈下降趋势,振动力作用5 min后青叶ETR显著低于自然摊放叶(P<0.05),V10的ETR从萎凋叶22.72降低到最低(15.88)。说明短时间(5~10 min)振动力胁迫使ETR显著降低,光合电子传递受阻,但随着胁迫时间的延长,青叶逐渐适应这种胁迫,ETR又逐渐恢复,呈现上升趋势。
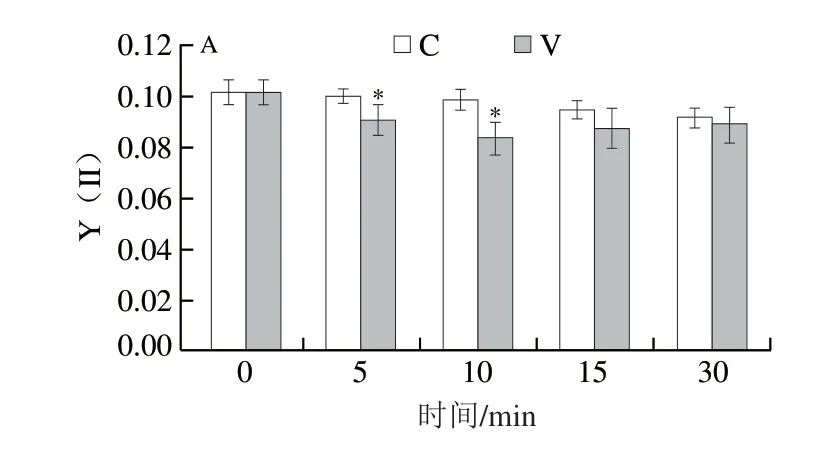
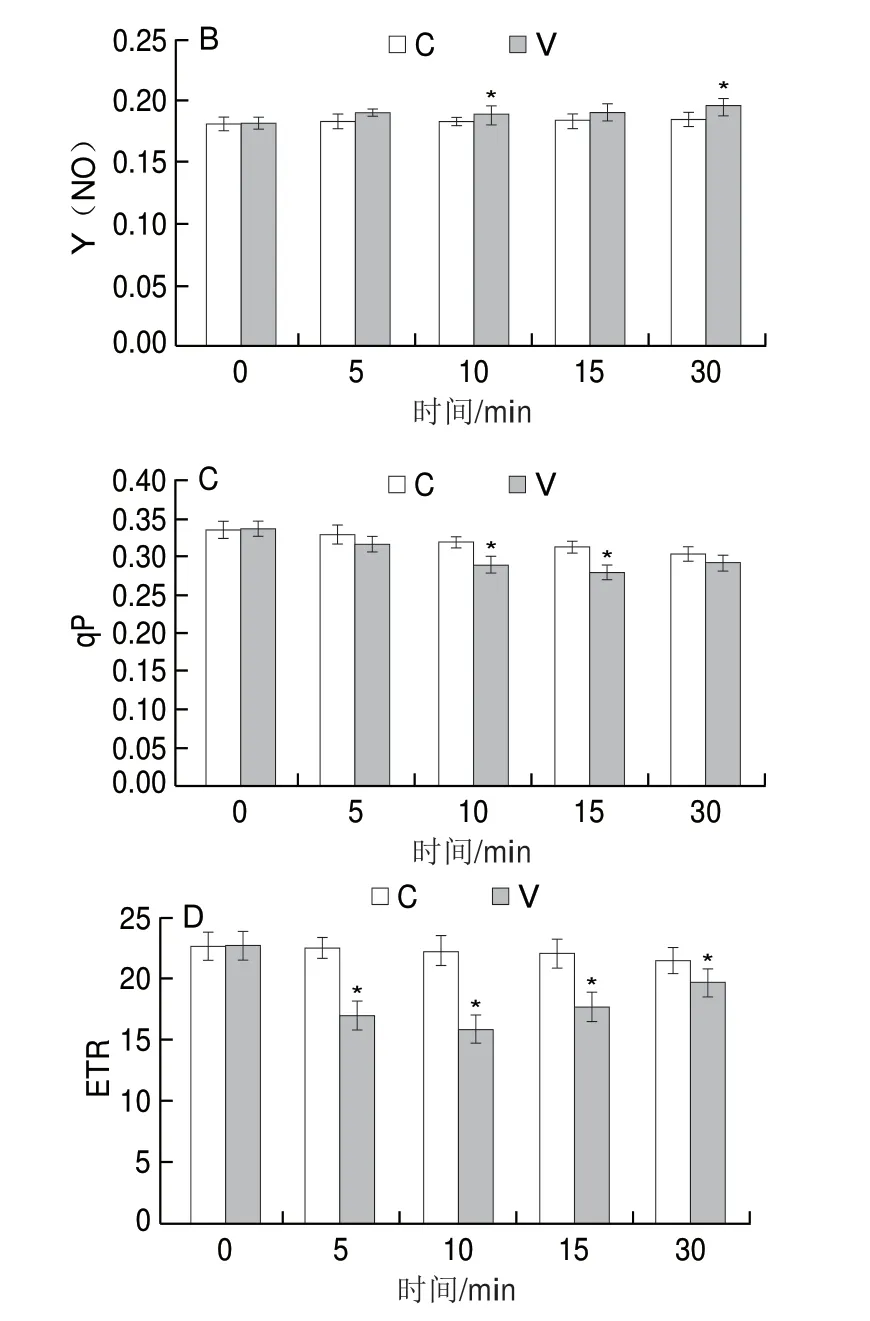
图2 振动力胁迫对青叶PSII参数的影响Fig.2 Effect of vibration stress on PS II parameters in tea leaves
振动力胁迫青叶PS II参数Y(II)和qP呈下降趋势,ETR呈先降后升的趋势,5 min和10 min时Y(II)和ETR显著低于自然摊放叶,Y(NO)呈上升趋势,30 min时与自然摊放组相比达到显著差异水平。说明青叶通过降低PS II反应中心的开放比例以及线性电子传递的量子效率,使Y(II)降低以减少光合碳同化提供的能量;随着振动力作用时间延长,Y(NO)升高,PS II反应中心光化学能量转换和自我保护调节机制逐渐减弱,无法耗散过多的能量,青叶受到伤害加重;振动力胁迫能够降低青叶PS II反应中心的开放程度,天线色素吸收的光能用于光化学反应电子传递的份额减少,qP降低,胁迫加剧,光合电子传递受阻,传递速率ETR显著降低,这与郭春芳[26]、柯玉琴[27]等研究茶树受水分和聚乙二醇重度胁迫时叶绿素荧光参数变化的趋势一致,说明振动力处理能在较短时间(5~15 min)对采后青叶产生明显胁迫效应,长时间(30 min)处理产生重度胁迫效应。
2.4 振动力胁迫青叶电导率及活性氧代谢酶活力变化
相对电导率是评估植物叶片细胞膜透性的基本指标,其高低相应代表细胞膜透性大小。如图3A所示,随着处理时间的延长,青叶相对电导率呈上升趋势,振动力胁迫青叶相对电导率升高较快,处理10 min后均显著高于自然摊放叶(P<0.05),由萎凋叶的0.3097增加到0.3843,V30达最大值,为0.5242,而C30仅上升至0.3891,与V10相当。这与黄毅彪[14]、刘波[20]等研究所得振动强度越大,叶片相对电导率越高、细胞渗透率越大的结果一致。说明振动力胁迫能够加剧青叶细胞膜系统损伤,提高其透性,促进膜内可溶物渗出,为形成茶叶品质的生化反应提供条件。
APX、CAT、DHAR、GR和MDAR是植物抗坏血酸-谷胱甘肽(ascorbic acid-glutathione,ASA-GSH)氧化还原途径的重要酶,对还原型ASA和GSH再生具有重要作用,而ASA和GSH是重要的非酶促抗氧化物质[28]。如图3B~F所示,除CAT和MDAR外,其他抗氧化酶活力随着处理时间延长,总体呈上升或先升后降趋势。振动力胁迫青叶MDAR活力呈波浪式变化(图3D),V5最高,为0.1664 µmol/(gg s),显著高于自然摊放叶,V10最低,为0.0739 µmol/(gg s),之后略有升高,但均显著低于自然摊放叶;APX(图3B)、DHAR(图3C)、GR(图3F)随着处理时间延长,活力呈先升后降趋势,APX、GR活力在处理10 min时达到峰值,分别为0.8259、0.0051 µmol/(gg s),显著高于自然摊放叶(P<0.05),之后显著低于自然摊放叶(P<0.05);DHAR活力在处理15 min时达到最高值(0.0144 µmol/(gg s)),显著高于自然摊放叶(P<0.05),但处理30 min时显著低于自然摊放叶(P<0.05);振动力胁迫青叶CAT活力呈降低-升高-降低的变化趋势,V10达到另一峰值(0.0600 µmol/(gg s)),V10、V15显著高于自然摊放叶(P<0.05),V30显著低于自然摊放叶(P<0.05)(图3E)。说明萎凋后青叶在持续受到振动力胁迫时,短时间(5~15 min)内会通过提高抗氧化酶活性来抵御这种机械胁迫,但随着胁迫时间的延长,青叶对这种胁迫逐渐适应,相关酶活力又逐渐恢复到较低的水平。
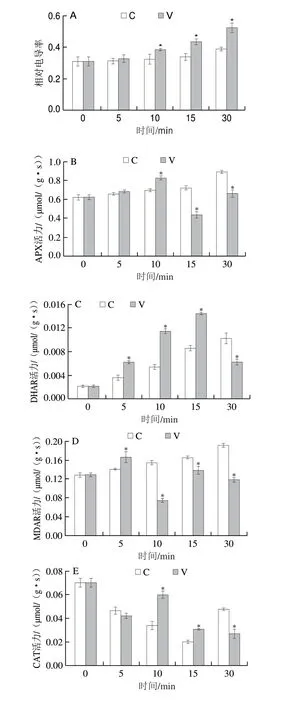
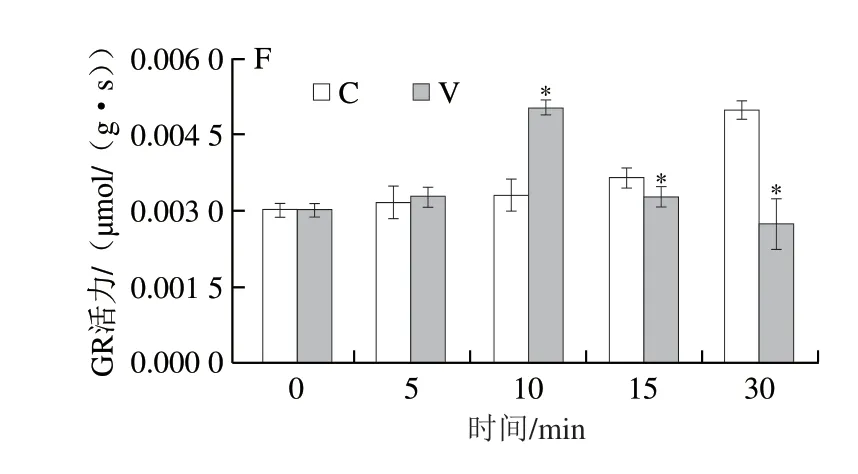
图3 振动力胁迫对青叶电导率与抗氧化酶活性的影响Fig.3 Effect of vibration stress on relative conductivity and antioxidant enzyme activities in tea leaves
本研究中APX、DHAR、GR活性随着处理时间延长呈先升后降趋势,APX活性直接影响ASA的含量,其活性提高标志着青叶清除活性氧能力增强,本研究结果与周子维等[29]研究摇青机械力使APX活性升高的结果一致。GR主要在NADPH作用下催化氧化型谷胱甘肽还原为GSH,GR活性提高能维持机械胁迫青叶中较高水平的GSH,有利于细胞保持氧化还原势,有研究认为GR活性提高与胁迫环境下植物茉莉酸的积累有关[30]。MDAR和DHAR是调控植物体内ASA氧化还原态的关键酶,其活性提高有利于植物体内ASA代谢清除过剩的活性氧自由基,保护植物细胞免受氧化损伤[31-32]。振动力胁迫短时间(5 min)内青叶CAT活性变化趋势与西瓜遭受硼胁迫后CAT活性降低的趋势相似[30],因CAT对胁迫的响应更加敏感,较长时间(10~30 min)胁迫使其活性升高后再降低。振动力胁迫短时间(5~15 min)内青叶中ASA-GSH氧化还原途径的重要酶活性总体高于自然摊放叶,表明青叶清除活性氧能力增强,振动力胁迫短时间内青叶通过提高MDAR(5 min)和DHAR(5~15 min)活性以维持ASA再生,协同提高APX和CAT活性从而抵御机械胁迫产生的活性氧对叶细胞的损伤,这与前人研究发现乌龙茶机械摇青后,青叶抗氧化酶活性升高的结果[33]一致。
2.5 青叶亚显微结构变化
对30 min内振动力胁迫青叶进行亚细胞结构观察,结果如图4所示,各处理叶片细胞整体结构无明显变化。能观察到C0叶绿体、类囊体片层结构,叶绿体紧贴细胞壁(图4A),细胞壁、细胞膜和液泡完整。随着处理时间延长,细胞间隙增大,尤其是V30细胞间隙明显变大,且细胞排列发生紊乱。如图4C所示,通过放大倍数观察叶绿体变化,可以发现C0和C5的叶绿体片层结构排列紧密而清晰,淀粉粒大而多,能观察到嗜锇颗粒(也称脂质球)。V5的叶绿体和淀粉粒移向细胞中央,淀粉粒数量明显增加,叶绿体、类囊体紧密而清晰的片层结构开始出现松散(图4A);之后淀粉粒数量随着处理时间的延长逐渐减少,粒径逐渐变小,叶绿体、类囊体逐渐收缩,紧密而清晰的层状结构进一步遭到破坏,开始松散、变形;V15的叶绿体外膜模糊不清,部分片层结构模糊(图4B),V30的叶绿体、类囊体严重收缩,部分片层结构已经瓦解,排列紊乱(图4C);V5、V15中嗜锇颗粒数量明显增加,V15甚至出现聚集现象(图4C),但V30的嗜锇颗粒数量明显减少,有的几乎消失(图4C)。
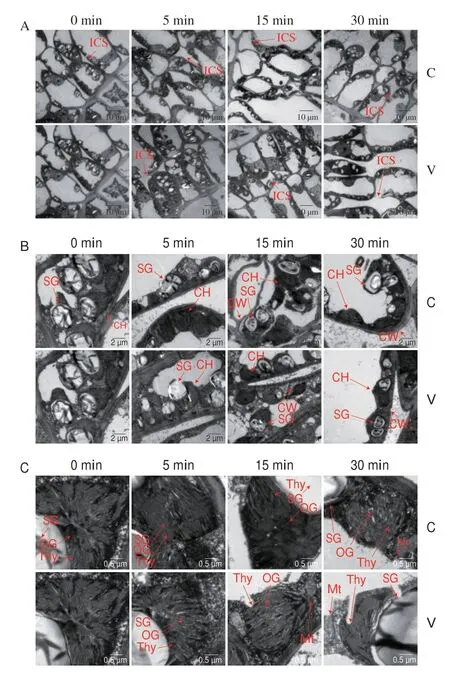
图4 振动力胁迫对青叶亚显微结构的影响Fig.4 Effect of vibrating stress on subcellular structure in tea leaves
植物叶片亚细胞显微结构变化与受胁迫程度关系密切,振动力胁迫青叶细胞整体结构无明显变化,但随着处理时间延长,细胞间隙增大,在30 min时明显变大,细胞排列发生紊乱。振动力胁迫使淀粉粒数量先增后减,粒径逐渐减小,嗜锇颗粒数量明显增加,V15出现聚集现象,V30中嗜锇颗粒数量又明显减少;叶绿体、类囊体紧密而清晰的片层结构逐渐松散、变形、收缩、紊乱、瓦解。淀粉粒是植物中最普遍的碳水化合物贮藏物质,有研究表明高盐胁迫使植物细胞通过叶绿体内淀粉粒数量和体积的变化,从而缓解能量短缺,保证细胞正常的生命活动[34]。综上,短时间(5 min)振动力胁迫使叶绿体内淀粉粒数量增加,以此缓解机械胁迫后的细胞能量短缺,提高叶片抗性,维持正常的生命活动。严学成等[35]研究发现叶绿体结构中含有较多嗜锇颗粒的品种所制茶叶香气更高,嗜锇颗粒中含有大量类脂物质,这是植物受到较重胁迫时类囊体降解以及脂质聚集所致,其通常在衰老的叶绿体中大量产生。适度的振动力胁迫(5~15 min)能够促使青叶类囊体降解、叶绿体衰老以及降解产物脂质聚集,从而导致绿体内嗜锇颗粒数量和体积明显增加,这些结构变化表明青叶细胞衰老加速,淀粉和嗜锇颗粒的聚集为乌龙茶加工过程中以淀粉水解和脂类物质降解为主的品质形成提供了物质基础。较长时间(30 min)振动力胁迫使叶绿体片层结构紊乱,接近瓦解,这与武传兰[36]、吴凯[37]等研究盐胁迫对植物细胞超微结构的影响结果相似。结合叶绿素荧光参数变化说明振动力胁迫对采后青叶胁迫明显,能够加速青叶叶绿体结构的瓦解和叶细胞衰老。
3 结论
振动力胁迫30 min内青叶水分含量与自然摊放叶和萎凋叶无显著差异,60 min时显著低于自然摊放叶和萎凋叶。随着振动力作用时间延长,青臭气变浓,清香减退。振动力胁迫10 min后青叶相对电导率显著高于自然摊放叶,5 min和10 min时PS II Y(II)和ETR显著低于自然摊放叶。随着振动力胁迫时间的延长,叶绿体和类囊体紧密而清晰的片层结构逐渐松散、变形、收缩、紊乱、瓦解,5 min时淀粉粒数量明显增加,15 min时嗜锇颗粒数量明显增多,并出现聚集。青叶抗氧化酶APX、DHAR、GR和MDAR活性在处理5~10 min总体高于自然摊放叶。振动力胁迫作为乌龙茶加工过程中的一种摇青力形式,一定时间(30 min以内)对青叶水分含量影响不显著,但会造成青气变浓,加剧青叶细胞膜系统损伤,使其透性提高,促进膜内可溶物渗出,使相对电导率显著升高,类囊体降解,叶绿体严重受损,青叶PS II系统被破坏,提高活性氧代谢酶活性从而抵御机械胁迫对叶细胞的损伤,为乌龙茶品质形成的生化反应提供条件。综上,一定时间的振动力胁迫(5~15 min)能够对乌龙茶产生较强的胁迫效应,并启动抗氧化酶系以抵御振动力胁迫带来的伤害,加速青叶叶绿体结构的瓦解和叶细胞衰老,为乌龙茶摇青工艺后的物质代谢提供基础。本实验可为生产上乌龙茶摇青时间的调控提供参考依据。

