林奇综合征相关子宫内膜癌研究进展
刘 晓,李玉兰,马 杏,许飞雪
1兰州大学第一临床医学院,兰州 730000 2兰州大学第一医院妇产科 甘肃省妇科肿瘤重点实验室,兰州 730000
林奇综合征(Lynch syndrome,LS)是常染色体显性遗传病,与错配修复基因结构改变或功能缺失引起的DNA重复序列及长度不稳定有关。这种改变也被称为微卫星不稳定(microsatellite instability,MSI),可引起正常细胞信号通路受阻及蛋白表达异常。多系统恶性肿瘤易感是LS的主要临床特征,其中以结直肠癌最为多见,其次为子宫、卵巢恶性肿瘤。子宫内膜癌(endometrial cancer,EC)是LS最常见的肠外前哨癌,发病率约为40%~60%[1]。EC也可作为LS的原发癌出现,以子宫下段受累及肿瘤大量免疫细胞浸润为主要特征,且患者发病时年龄和体质量指数(body mass index,BMI)均较低[2]。LS继发EC风险高、恶变速度快[3],因此早期准确识别LS不但对LS相关子宫内膜癌(LS associated endometrial cancer,LS-EC)的治疗具有指导作用,也对预防LS相关其他恶性肿瘤具有参考意义。本文将综述LS-EC筛查及预防手段最新进展,以期为当前和未来LS-EC的准确诊断以及LS相关癌症的防治提供借鉴。
1 LS-EC遗传特点
LS及其相关肿瘤易感性是由MMR基因胚系突变引起,包括MLH1、MSH2、MSH6和PMS2,其中任何一个等位基因存在表达异常或突变致编码DNA错配修复系统功能异常,细胞突变率将增加100~1000倍[4]。约50%~60%的LS由MLH1或MSH2突变引起,MSH6和PMS2突变各占10%~20%,另约3%是由上皮细胞黏附分子(epithelial cell adhesion molecule,EPCAM)基因突变引起[5]。MLH1上游基因LRRFIP2的大量缺失可导致启动子甲基化MLH1等位基因的体细胞突变[6]。EPCAM基因30端(紧邻MSH2)的变异缺失可导致MSH2启动子的高甲基化或MSH2部分缺失[2]。雌二醇可上调雌激素受体(estrogen receptor,ER)阳性细胞中MLH1和MSH2基因的表达,ERα/β通过MSH3/MSH6相互作用域与MSH2结合发挥促生长作用,MSH2又可通过反转录激活增强配体ERα的功能,这可能与LS-EC的发病机制有关。前瞻性LS数据库(Prospective Lynch Syndrome Database,PLSD)显示,75岁女性MLH1、MSH2、MSH6和PMS2突变的EC累积风险分别为37.0%、48.9%、41.1%和12.8%,LS-EC个体MSH2突变率高达48%,其次为MSH6,提示MSH2、MSH6突变是LS-EC的主要突变基因[7]。但在我国,LS-EC以MSH1、MSH6突变为主,突变率分别为32%、15%。
2 LS-EC临床/病理特征
LS-EC的临床特征与散发性EC具有明显差别。LS-EC患者诊断时的平均年龄低于散发型患者,不同胚系突变引起的发病年龄也不同,MLH1和MSH2基因突变患者EC发病年龄多为39~49.5岁,而MSH6携带者发生LS-EC的年龄较晚,多为50.6~59.5岁,明确的发病年龄可为临床LS患者制定个体化预防措施提供理论依据[8]。肥胖是散发性EC发病的高危因素,但尚未发现BMI与LS-EC的直接相关性,与散发性EC患者相比,低度MSI(MSI-low,MSI-L)与微卫星稳定(microsatellite stability,MSS)LS-EC患者的BMI无明显差异,错配修复缺陷(mismatch repair deficiency,dMMR)、高度MSI(MSI-high,MSI-H)和胚系突变患者的BMI偏低[9],但目前此结论尚存争议。子宫内膜样腺癌是LS-EC最常见的类型,但MSH2突变的患者更多表现为非子宫内膜样腺癌,以致LS-EC的组织学更加复杂多变,这与基因突变类型、种族、生活环境、生活习惯及病理组织分析方法的差异有关。78%的LS-EC患者发现时尚处于疾病早期阶段,总体存活率良好[10]。与散发性EC相比,LS-EC易累及子宫下段,研究发现MLH2突变的LS-EC患者子宫下段累及率较高,累及子宫下段也是淋巴结转移的危险因素,与LS-EC的预后呈负相关[11]。高突变特点可诱导肿瘤细胞新抗原增加,故MSI-H/dMMR诱导的LS-EC更多表现为肿瘤浸润淋巴细胞(tumor infiltrating lymphocyte,TIL)阳性,例如程序性死亡[蛋白]1(programmed death-1,PD-1)、CD8+、CD45RO+和细胞毒性T淋巴细胞,但PD-1及其配体可上调MSI/dMMR表达水平,一定程度上可抵消TIL介导的积极效应,因此,PD-1免疫检查点抑制剂作为免疫疗法可在临床治疗中发挥重要作用[12]。
3 LS-EC筛查
EC患者多因早期特异性临床症状(绝经后阴道出血)而就诊,但对于LS患者来说,罹患EC的风险(约为40%~60%)远高于普通人群[13],因此LS-EC的筛查意义重大。然而,目前我国尚缺乏标准的LS-EC筛查流程和基因检测指南,且对LS-EC患者基因诊断的研究甚少。现阶段,LS-EC筛查主要包括MMR免疫组化、MLH1甲基化检测、MSI检测和基因测序,其可显著提高LS-EC诊断准确性(图1)[2]。准确详细的筛查可指导LS-EC相关治疗,识别易感多系统恶性肿瘤的高危人群,警示LS-EC家族其他成员尽早做好LS相关恶性肿瘤筛查,从而降低患者罹患其他LS相关恶性肿瘤风险以及家族其他成员LS相关恶性肿瘤的发生率。
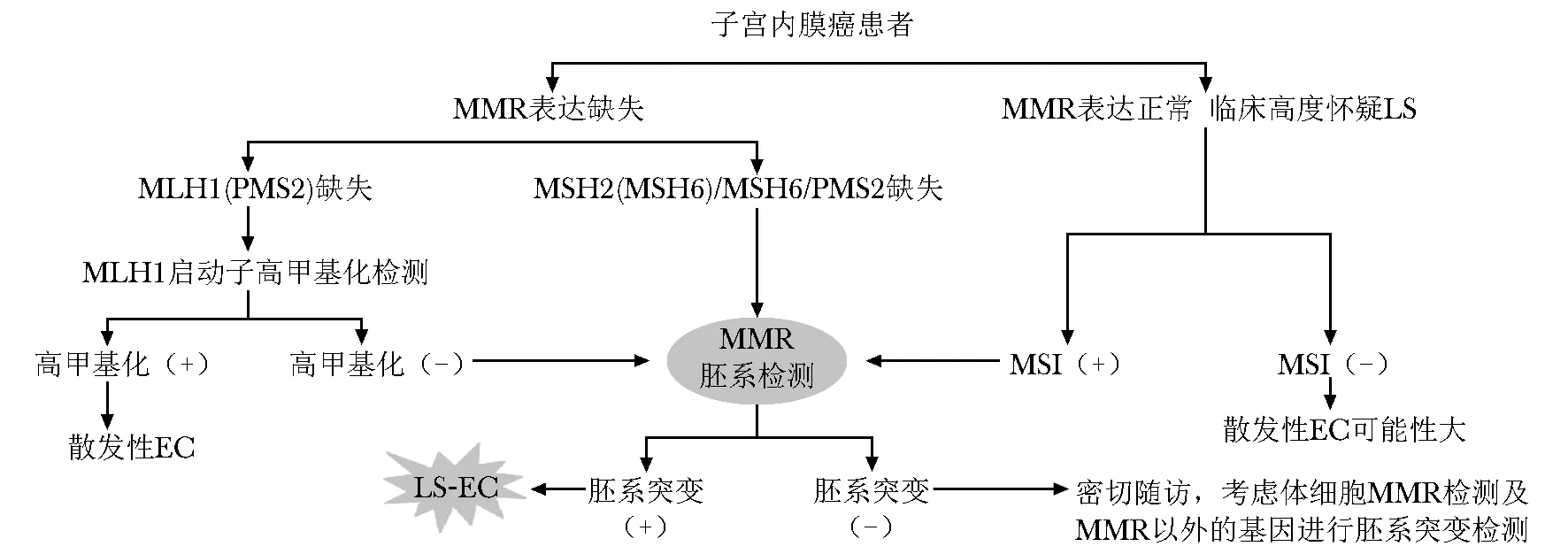
图1 LS-EC患者筛查流程建议[2]
3.1 MMR免疫组化
MMR通过形成异质二聚体保持稳定性,例如,MLH1可与PMS2、PMS1及MLH3形成二聚体,MSH2可与MSH6或MSH3形成二聚体。其中以MLH1和MSH2为主体,若主体存在缺失表达即整个二聚体表达异常[14]。免疫组化是临床普遍采用的染色技术,可用于检测MMR蛋白表达。MLH1蛋白缺失可能是胚系细胞突变或是由于启动子甲基化导致的MLH1基因沉默表达,需进一步检测其甲基化状态;MSH2、MSH6或PMS2发生缺失高度提示LS可能,需进一步检测胚系突变状态;LS中并非所有胚系突变均表现为MMR蛋白表达缺失,氧化应激、组织缺氧等也可影响MMR蛋白表达。因此,MMR蛋白表达仅用于LS的筛查,而非诊断性检测[15]。但免疫组化检测费用相对较低、检测设备易获取,操作简单,因此便于基层医院开展,不同MMR基因的蛋白表达缺失可对相应基因突变具有一定指向性,是目前LS-EC筛查的首选。
3.2 MLH1甲基化检测
MLH1表达缺失可在MLH1胚系突变和表观遗传沉默2种情况下发生,主要依据MLH1启动子甲基化状态区分:一种是由MLH1启动子超甲基化致MLH1表观遗传沉默,常发生于散发性EC;另一种是MLH1启动子甲基化阴性,高度怀疑LS-EC,建议行基因检测[16]。因此,MLH1表达缺失需行MLH1启动子甲基化检测。免疫组化联合MLH1甲基化检测可提示发生突变的MMR基因,并通过甲基化检测排除非LS-EC患者,但由于检查者主观因素及标本质量等问题,将产生极少数假阴性结果。
3.3 MSI检测
目前主要采用微卫星重复序列扩增状态评估MSI。美国国家癌症研究所推荐的微卫星位点包括3个双核苷酸序列(D2S123、D5S346和D17S250)和两个单核苷酸序列(BAT-25和BAT-26)[17]。≥2个微卫星位点显示微卫星长度变化即为MSI-H,1个位点显示微卫星长度变化则为MSI-L,位点未显示微卫星长度变化则为MSS,前者称为MSI阳性,后两者统称为MSI阴性[18]。临床多采用免疫组化联合MSI检测,以识别MSI-H和dMMR等高危患者。MSI检测最大的局限性在于无法区分dMMR是由表观遗传还是胚系突变所导致,此外,部分MSI-H的EC患者可能由MLH1启动子的超甲基化引起,对于MSI-H仍需进一步检测胚系突变情况。相较于免疫组化,MSI检测价格昂贵,缺乏特异性,临床接受度低于免疫组化。
3.4 基因测序
下一代测序技术(next-generation sequencing,NGS)近年来发展迅速,其具有通量高、速度快等优点,缺点为价格昂贵。对MMR基因的胚系突变进行 NGS检测可明确诊断LS-EC,并可确定具体突变的MMR基因。然而,基因测序仍存在一定局限性,例如,对于未知显著性突变,即MMR基因序列仅有一个氨基酸发生突变时,则不能确定是否会引起LS[19]。因此,基因测序也可能因点突变、基因重组等特殊情况出现假阴性从而造成LS-EC漏诊。相较于NGS,长读长测序(long-read sequencing)在检测点突变、伪基因(如PMS2)在表观遗传修饰方面更具有优势,且其通量高、长度长、价格更便宜,在LS诊断中显示出良好效果[20],应用前景广阔。若患者临床病史高度怀疑LS-EC,但基因测序阴性应密切随访。
4 LS-EC治疗及预防
4.1 治疗
4.1.1 传统治疗
LS-EC的治疗策略与散发性EC相似,手术、化疗、放疗是EC经典的治疗方式。全子宫+双附件+盆腔和腹主动脉淋巴结切除术是所有EC的标准术式,可依据患者年龄、病灶累及范围调整手术范围,但对LS-EC患者,即使年龄小、病灶局限,仍建议切除双侧附件以降低卵巢恶性肿瘤的发生率[21]。术后依据病理分期、分化程度、病灶范围进行辅助治疗,目前指南推荐卡铂和紫杉醇为一线化疗方案,临床效果良好,放疗依据残留病灶范围进行个体化选择[22]。
4.1.2 内分泌及免疫治疗
近年来,内分泌及免疫治疗的临床应用较普遍。雌激素过度暴露是EC的高危因素,依据病理结果可采用高效孕激素进行内分泌对抗治疗[23]。dMMR肿瘤中高突变负荷和大量的免疫细胞浸润促进了免疫治疗的兴起。机体免疫系统对识别及杀伤肿瘤细胞具有重要作用,恶性肿瘤细胞抑制性免疫检查点受体可抑制机体自身免疫,导致肿瘤细胞免疫逃逸及免疫耐受。Le等[24]给予dMMR患者PD-1信号抑制剂派姆单抗治疗,dMMR肿瘤患者对派姆单抗高度敏感,客观缓解率高达53%。一项Ⅱ期多队列临床试验KEYNOTE-158显示,MSI-H/dMMR EC患者使用派姆单抗的客观缓解率高达57.1%,中位无进展生存期高达25.7个月,证明了派姆单抗在LS-EC治疗中的临床疗效[25]。
4.2 预防
由于LS-EC与散发性EC的临床特征不同,对于无生育要求的高危女性,有研究表明使用药物及预防性手术可降低LS-EC的发病率。随着免疫治疗近展,癌症预防疫苗(cancer vaccine prevention,CVP)为预防LS-EC提供了新的思路。
4.2.1 预防性药物
研究表明,无论MMR状态如何,黄体酮均可对抗雌激素作用从而降低女性发生EC的风险。前瞻性试验结果表明,醋酸甲羟孕酮或联合口服避孕药(combined oral contraceptives,COCP)可降低LS患者子宫内膜增生风险,但此过程不可忽视COCP引起的高凝状态[23]。研究表明,每天服用600 mg阿司匹林可降低LS-EC的发病率,其他药物,包括布洛芬和萘普生,均被证明可降低LS患者发生结直肠癌的风险,萘普生治疗也有助于延长同一患者群体的生存期[26],其在LS-EC中的疗效尚待大样本研究数据加以证明。
4.2.2 预防性手术
研究表明,降低风险手术(risk-reducing surgery,RRS)在预防LS患者发生妇科恶性肿瘤方面具有重要作用。当LS患者无生育要求时,建议行子宫和双侧附件切除术,以降低子宫内膜癌、卵巢癌的风险。RRS的时机和选择可根据生育需求、更年期状态、家族史和MMR基因缺陷类型进行个性化选择[27]。LS-EC的风险年龄因MMR基因类型而异,MSH6异常者发病中位年龄高于MLH1和MSH2异常者,建议MSH6异常者在40岁后行RRS,而MLH1或MSH2异常者如无生育需求建议35岁左右可考虑行RRS。考虑到PMS2异常者EC风险较低,RRS对PMS2功能缺失者的作用有待进一步评估[28]。此外,预防性手术前应进行妇科体检,以防遗漏散发性EC,术后应重视更年期症状,包括失眠潮热、性欲减退、情绪变化以及骨质疏松的风险。
4.2.3 CVP
CVP是免疫疗法策略之一,旨在调节宿主免疫系统,诱导持久的保护性免疫反应,对抗癌症相关抗原[29]。LS-EC高突变可产生大量新抗原及淋巴细胞浸润,为CVP的应用奠定了基础。癌症高风险的健康个体甚至恶性病变前接种CVP,可加强已存在的特异性免疫反应,从而消除新出现的病变并维持免疫平衡。随着高通量测序技术(如NGS)的兴起,体外验证的新抗原疫苗已经出现,对LS-EC及其他系统恶性肿瘤的预防具有重要意义。有研究提出LS相关恶性肿瘤患者是CVP的临床理想模型,也是未来开拓免疫疗法的重要方向[30]。
5 小结与展望
随着精准医疗的不断发展,LS-EC筛查越来越受到关注,但由于临床对LS-EC认识不足且缺乏标准的筛查流程,存在LS-EC漏诊现象,目前推荐免疫组化观察MMR蛋白表达并识别MSI-H,MLH1甲基化检测排除散发性EC,最终通过基因测序确诊LS-EC。由于LS-EC存在多系统肿瘤易感性,对EC患者进行LS筛查是减少LS相关恶性肿瘤发生的重要手段。对于确诊的LS患者,建议定期进行EC筛查,根据患者年龄及生育需求进行药物及适时手术以预防LS-EC的发生。随着免疫疗法的不断发展,CVP成为研究热点,而LS是CVP的理想预防模型,未来有望在癌症疫苗方向取得更大进展,以减少甚至避免LS-EC等相关恶性肿瘤的发生,为临床LS-EC患者及其家庭成员带来获益。
作者贡献:刘晓负责检索文献、框架设计和论文初稿撰写;李玉兰负责修订论文初稿;马杏负责指导论文写作及终稿审核。
利益冲突:所有作者均声明不存在利益冲突

