新冠疫情的新挑战:Omicron变异株特征及科学防疫新阶段
李 懿,徐英春
中国医学科学院北京协和医院 1检验科 2疑难重症及罕见病国家重点实验室,北京 100730 3中国医学科学院北京协和医学院研究生院,北京 100730
自2021年11月首次报道以来,Omicron变异株以超强的传播力迅速席卷全球,并于2022年1月替代Delta变异株成为肆虐全球的主导变异株。作为第五个世界卫生组织(World Health Organization,WHO)公布的值得关注的变异株(variants of concern,VOCs),Omicron变异株与之前的VOCs在基因组学、生物学以及流行病学特征方面存在显著差异,Omicron似乎是一个新的流行起点,开启了新冠疫情防控的新挑战,面对其极强的传播力伴随较低的重症率和病死率,如何在疫情控制与民生经济方面优化防疫策略,对疫情进行科学防控是全球各国面临的共同难题。本文对Omicron变异株及其亚种在基因组学、生物学及流行病学特征上的变化及其与流感病毒的差异进行阐述,以期为优化疫情防控策略提供科学依据。
1 Omicron变异株及其亚种的基因组特征
RNA病毒通常以高变异率适应不断变化的生存环境。新冠病毒作为一种RNA病毒,变异率高且基因重组频繁,自新冠疫情暴发以来已进化出数千种变异株,WHO将其中广泛传播且证据表明具有更强传染性、能够引起更严重疾病和/或减少抗体中和能力的变异株定义为VOCs[1]。继Alpha、Beta、Gamma和Delta变异株之后,WHO于2021年11月26日将Omicron(B.1.1.529)变异株归类为第五个VOCs。
相较于2019年最初分离的新冠病毒基因组Wuhan-Hu-1,最初的Omicron变异株(BA.1)在刺突蛋白S上有30个氨基酸替换[2],3个框内缺失以及3个氨基酸插入(ins214EPE),远超Delta变异株的6个突变。其中15个突变位于刺突蛋白受体结合域(receptor-binding domain,RBD),RBD是病毒与宿主细胞上的受体以及中和抗体结合的区域,对病毒的传播和免疫逃逸具有重要生物学意义。在15个位于RBD的突变中,9个位于与人血管紧张素转换酶2(angiotensin converting enzyme 2,ACE2)结合的区域[3]。这些突变可能强化病毒与受体的结合能力或逃逸与中和抗体的结合能力从而获得进化优势。据人工智能模型预测,Omicron变异株的S蛋白与受体结合的亲和力是原始毒株的13倍,是Delta变异株的2.8倍[4]。S蛋白的结构分析显示,突变所导致的抗体逃逸能力增强同时与受体强结合能力的维持,是Omicron迅速在全球传播的分子基础[5]。
Omicron以一个发散且多样的谱系(BA.1、BA.2和 BA.3)迅速在全球蔓延,BA.2逐渐在全球占据主导地位,随后两个新的亚种BA.4和BA.5在南非和多个国家被发现,并于2022年4月快速替代了BA.2的主导地位。BA.4和BA.5的S蛋白与BA.2最为接近,在BA.2的基础上携带了69~70缺失突变、L452R、F486V以及回复突变Q493,不同亚种在其他蛋白上存在差异[6]。截至2022年11月6日,根据WHO全世界新冠病毒基因序列分析显示,BA.5变异株在全球占据主导地位,其流行率为72.1%[7]。采用Nextstrain软件[8]制作全球SARS-CoV-2基因组的时间尺度系统发育树(图1),从系统进化分析可以看出,Omicron进化和变异的速度远超原始毒株,其进化变异仍在继续,新的优势变异株会一直更替。
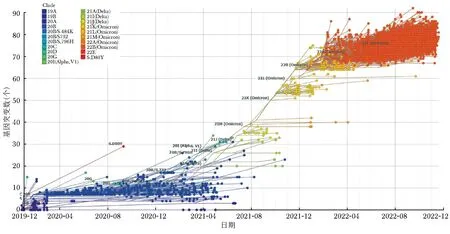
图1 全球SARS-CoV-2基因组的时间尺度系统发育树
既往研究也证实,Omicron并非由早期的VOCs发展而来,而是在黑暗中平行进化来的[9]。BA.1变异株在RBD区存在15个氨基酸替换,与BA.2和BA.3共享其中14个氨基酸替换,而之前的VOCs在RBD区仅存在1~3个氨基酸替换。有学者对S蛋白的系统进化分析显示,Omicron及其亚种与之前的VOCs存在明显分支,因此Omicron亦被认为是一种截然不同的新冠病毒变异株,应将其与其他VOCs分为两个不同的血清型[10]。此外,Omicron变异株与其他VOCs存在有限的交叉免疫反应,对其他VOCs刺激产生的抗体特别不敏感[10]。抗原分析表明,除Omicron外的所有VOCs均属于一个大的抗原簇,而Omicron形成一个新的抗原簇,从而对疫苗或恢复期血浆具备免疫逃逸能力[11]。Omicron在基因组上与其他VOCs存在的巨大差异引起了学术界对其来源的热议。学术界对其由来产生了诸多非互斥的假设,包括在基因组检测能力有限的区域流行进化而来、在免疫缺陷的个体内(如HIV感染者)长期进化而来以及在动物宿主内复制和重组进化而来[12]。
综上所述,Omicron在基因组学和生物学特征上与之前流行的VOCs差异悬殊,是新冠病毒血清型分化的开端,是新冠疫情的一个新起点。虽然Omicron诡异的进化来源不得而知,但可以明确的是,Omicron的流行是在全球大规模感染和疫苗接种的环境下产生的,其进化和流行是为适应宿主愈发成熟的免疫防御,同时Omicron在致病能力方面也为此付出了相应代价。
2 Omicron变异株及其亚种的致病能力
自Omicron流行以来,越来越多的流行病学及生物学研究均表明,其相较于继往流行的VOCs感染症状存在差异,且致病力和住院率明显降低。
英国一项针对63 002例Omicron感染者的前瞻性研究显示,相较于Delta变异株,Omicron感染后下呼吸道症状减少且住院率更低,急性症状的持续时间更短[13],其研究结果与Omicron疫情早期阶段南非和韩国报道的低住院率结果相符[14-15]。相较于Delta变异株,感染Omicron后进展为重症的可能性更低[16-17]。2022年6月,WHO发布的报告显示,在校正了年龄、性别、种族、其他变异株感染史、疫苗接种情况和并发症等影响因素后,Omicron相较于Delta变异株的重症率和死亡率均明显降低[18]。加拿大的一项研究显示[19],Omicron感染导致的住院率为0.6%,死亡率为0.03%,而Delta感染导致的住院率为1.4%,死亡率为0.3%。新英格兰的多中心研究显示[20],Omicron(B.1.1.529)感染导致的死亡率为0.4%,Omicron(BA.2)感染导致的死亡率为0.3%,Delta(B.1.617.2)感染导致的死亡率为0.7%。对于近期占据优势的BA.4/BA.5亚种,南非的一项研究表明,其重症率与前几波Omicron疫情相比无差异[21],也有研究表明BA.4/BA.5相较于既往的Omicron亚种死亡率进一步降低[22]。然而,Omicron致病性的降低是源于病毒本身致病能力的削弱还是人群对新冠病毒的免疫能力增强值得进一步探讨。
体外实验证明了Omicron致病力的减弱以及侵袭部位的转移。研究人员在携带ACE2受体的小鼠模型中发现,相较于原始毒株和Delta变异株,感染Omicron后恢复速度更快且上呼吸道和下呼吸道的病毒载量更低[23]。有学者采用体外培养的人支气管和肺组织研究发现,Omicron BA.1变异株在支气管组织中的复制能力是Delta和原始毒株的70倍,而在肺组织中是后两者的1/10[24]。其他研究也表明,Omicron(BA.1)在肺组织中的病毒载量低于鼻腔[25]。在体外分化的人鼻上皮培养物中,与Delta和原始毒株相比,Omicron的复制能力明显增强[26]。更重要的是,多项研究表明Omicron感染导致的重症率下降主要源于感染后合胞体的形成能力降低,不像其他VOCs通过诱导细胞融合而在细胞间传播[27]。这种细胞融合依赖跨膜丝氨酸蛋白酶2(transmembrane serine protease 2,TMPRSS2),而Omicron的感染部位局限于上呼吸道,不依赖TMPRSS2途径在细胞间传播,因而其在肺组织中的扩散减少,造成肺组织的损伤降低。综上,多项体外实验证实Omicron相较于其他VOCs致病性减弱,主要侵袭部位由下呼吸道向上呼吸道转移。另一项临床研究也从侧面证实了Omicron流行期间感染者症状减轻是由于病毒本身致病性减弱而非人群免疫水平增强[28],为去除人群免疫水平对评估Omicron致病性的影响,该研究分析了疫苗接种者在Beta、Delta和Omicron变异株流行期间突破感染的情况(即对疫苗产生有效应答后依然发生感染)。结果发现在Beta和Delta流行期间,43%的住院患者需吸氧治疗,8%的住院患者需机械通气,而Omicron流行期间两项数据仅为16%和0.2%,此外Omicron感染者的住院时间也更短。
虽然研究证据对于Omicron本身致病性减弱的支持似乎更有力,但人群免疫水平提供的屏障亦不容忽视,至少现在可以明确的是,Omicron的致病性明显下降。
3 Omicron变异株及其亚种的免疫逃逸能力
Omicron被发现后迅速扩散至全球并取代Delta变异株的统治地位,其极强的传播力背后,除S蛋白突变导致其与受体的结合能力增强外,还具备对疫苗和既往感染所建立的免疫屏障的逃逸能力。多项研究证实,Omicron携带的S蛋白突变降低了单克隆抗体、恢复期血浆和接种疫苗后血浆的中和能力。
既往感染其他变异株机体所提供的保护效力针对Omicron是有限的。研究表明,既往感染史针对Alpha变异株提供的保护效力为90.2%,针对Beta变异株为85.7%,针对Delta变异株为92.0%,而针对Omicron变异株仅为56.0%[29]。研究发现,新冠疫情早期Alpha、Beta、Gamma及Delta流行期的疫苗接种者和恢复期血浆对Omicron BA.1的中和能力大幅降低或未能中和,揭示了Omicron对既往感染或疫苗接种所建立的免疫屏障的逃逸能力[3]。近期研究发现,即使既往感染过Omicron(BA.1),机体针对BA.4和BA.5亚种提供的保护效力仍然有限[30]。研究人员针对接种和未接种疫苗的BA.1感染者血浆进行研究发现,未接种疫苗的感染者血浆对BA.4和BA.5的中和水平降低为原来的1/7,接种疫苗的感染者血浆中和水平降低为原来的1/3。
目前应用的新冠疫苗主要以S蛋白为靶点,如前所述Omicron在S蛋白上的大量突变可使部分S蛋白不被抗体识别,导致其对于体液免疫具备强大的逃逸能力[4]。体外试验证实,多种上市的单克隆抗体对Omicron的中和能力相较于其他VOCs明显下降[31-33],提示单克隆抗体对于Omicron感染者的治疗效果可能大打折扣。
Omicron对于疫苗的影响相对复杂。研究表明,2针辉瑞公司的mRNA疫苗复必泰(BNT162b2)对原始毒株、BA.1和BA.2的几何平均中和抗体滴度(geometric mean titres,GMTs)分别为658、29和24,6个月后对原始毒株的GMTs为129,而对BA.1和BA.2的GMTs不足20[34]。接种3针BNT162b2疫苗1个月后,对BA.1、BA.2、BA.2.12.1、BA.4和BA.5的GMTs分别降低至原始毒株的27.8%、22.2%、23.8%、16.1%和7.7%[35-36]。此外,BNT162b2加强针对BA.4/BA.5的GMTs也低于BA.1和BA.2[37-38]。虽然疫苗刺激产生的抗体对Omicron的中和能力明显减弱,但疫苗仍可在预防Omicron感染导致的重症和死亡方面发挥作用,这一作用往往是由细胞免疫介导。T淋巴细胞代表的细胞免疫虽不能预防感染,但在减少重症方面发挥了重要作用[39-40]。轻度症状与支气管灌洗液中CD8+T淋巴细胞数量增加有关[41]。多项研究证实,既往感染者或疫苗接种者体内的T淋巴细胞免疫记忆可对Omicron变异株产生应答,且这种应答可因加强免疫而强化[42-43]。
此外,越来越多的研究数据提示,加强免疫对于降低Omicron感染相关重症率和死亡率的重要性,既往感染和疫苗加强针的混合免疫可提供相对较高的保护效力。研究发现,既往感染、3针BNT162b2疫苗接种、既往感染+2针BNT162b2疫苗接种以及既往感染+3针BNT162b2疫苗接种对于有症状的BA.2感染的保护效力分别为46.1%、52.2%、55.1%和77.3%,加强免疫1周后对于BA.1和BA.2的保护效力可分别提高至71.3%和72.2%[44]。我国香港此次Omicron流行期间的数据显示,加强免疫不仅降低了感染率,同时也降低了重症率和死亡率,即使加强免疫的人群中有人发生了突破感染,但症状较轻或无症状[45]。对于80岁以上的老人,新加坡的数据显示,相较于未完成计划免疫的人群,加强免疫的死亡率是其4%;相较于接种2针疫苗的群体,加强免疫的死亡率是其24.4%[46]。我国广泛使用灭活疫苗,香港Omicron流行期间的数据显示,灭活疫苗虽然对60岁以上的高风险人群(接种2针疫苗后)提供的保护效力低于mRNA疫苗,但两种疫苗(接种3针后)防止重症或死亡的整体效果均达97%以上[47];吉林Omicron流行期间的数据亦显示,3针灭活疫苗对于重症的保护效力为68.1%[48]。因此,针对60岁以上及有基础疾病的高危人群提供充足有效的保护,可在很大程度上降低重症率和死亡率。我国香港Omicron疫情数据显示,60岁以上人群中19.3%未接种疫苗,其粗病死率为2.7%。相比之下,新西兰65岁以上人群中仅2%未接种疫苗,其与0.07%的粗病死率高度相关[49]。
综上,虽然Omicron强大的免疫逃逸能力可突破既往感染和疫苗接种所建立的免疫屏障,但疫苗接种所建立的细胞免疫记忆依然能够对Omicron产生应答且可被免疫强化。同时,Omicron本身致病性降低,导致其感染后的重症率和死亡率相较于其他VOCs明显下降。因此,大力推进高风险人群加强免疫,在控制Omicron导致的重症率和死亡率方面发挥重要作用。
4 Omicron变异株感染相关后遗症
WHO将新冠病毒感染后3个月出现症状,最短持续2个月,且无法用其他诊断解释者,称为“后新冠症状”(post-COVID-19),即新冠后遗症。
对于原始毒株和其他VOCs感染相关的后遗症,最常见的症状是疲劳、疼痛或不适、气短、认知障碍和心理健康问题[50]。JAMA近期发表的研究汇总了2020年至2021年120万例COVID-19确诊患者自我报告的随访情况,该研究将新冠后遗症分为3个症状群:(1)持续性疲劳伴身体疼痛(肌肉疼痛)或情绪波动;(2)认知问题(健忘或注意力不集中,即脑雾);(3)持续性呼吸系统问题(以气促和持续性咳嗽为主)[51]。研究发现,在有症状感染3个月后,仍存在至少1个后遗症的患者占比6.2%,其中3.7%为持续性呼吸系统问题,3.2%为持续性疲劳合并身体疼痛或情绪异常,2.2%为认知水平异常;此外,感染的严重程度与后遗症的发生存在密切关系,ICU 监护患者、住院患者和非住院患者在感染3个月时仍有后遗症的比例分别为43.1%、27.5%和5.7%;住院患者后遗症的平均持续时间为9个月,非住院患者为4个月[51]。因此,后遗症的出现和持续时间与感染的严重程度相关。另一项大型研究也提示感染严重程度与后遗症的相关性,同时发现无症状感染者未出现任何后遗症[52]。此外,接种疫苗可有效预防后遗症[53]。对于未接种疫苗的群体,感染后再接种疫苗亦可降低后遗症的发生风险[54]。
由于感染后遗症的观察需要较长时间,对于Omicron感染相关后遗症及其长期影响,可参考的研究有限。近期Lancet发布了一项研究,针对Omicron流行期间的56 003例感染者和Delta流行期间的41 361例感染者进行分析,发现10.8%的Delta感染者发生了后遗症,而Omicron感染者发生后遗症的比例仅为4.5%,相较于Delta,Omicron后遗症的发病率降低了24%~50%[55]。
综上,新冠后遗症的发生与感染后的严重程度高度相关、与疫苗接种相关,且无症状感染者几乎不产生后遗症。现有证据表明,Omicron感染后相关后遗症的发病率低于Delta,后续仍有待深入研究。
5 Omicron疫情与季节性流感
Omicron极强的传播力和明显降低的致死率与季节性流感相似。如何看待Omicron疫情,对防疫政策、民生和社会经济运转产生诸多影响。Omicron疫情与季节性流感之间的差异值得探讨。
实际上在新冠疫情暴发初期,季节性流感的流行病学数据就已被用来与新冠疫情作比较[56],流感被作为新冠疫情临床研究的参照。研究表明,疫情初期原始毒株感染导致的死亡率高于流感病毒[56-57]。而在Omicron流行期间,研究人员应用数学模型分析显示,Omicron的致死率低于季节性流感和2009年的H1N1流感[58]。此外,由于疫苗接种情况和防疫政策等多种因素均可影响Omicron的致死率,同时流感的诊断不像新冠那样严格,不会进行大规模筛查,因此要科学且系统地比较二者的致死率十分困难。目前的数据主要来源于各国疾控中心,由于各国国情不同,在防疫政策、疫苗接种率、医疗条件以及前几波疫情期间人群的暴露情况存在差异,数据的解释能力在一定程度上受限。一份英国社区健康数据报告显示,Omicron导致的死亡率低于季节性流感[59]。JAMA最新发表的研究统计分析了2021年12月至2022年3月21个国家的Omicron死亡率,其中日本和韩国的死亡率分别为7.4/10万和18.2/10万[60]。2022年11月6日至12月4日新加坡新增感染者44 571例,死亡率为0.02%[61]。而根据2018年Lancet发布的统计数据显示,中国65岁以下、65至75岁以及75岁以上三种人群的流感相关呼吸道超额死亡率分别为0.7/10万、19.1/10万和112.7/10万;日本为0.2/10万、3.5/10万和27.5/10万;韩国为0.1/10万、3.8/10万和24.9/10万;新加坡为1.5/10万、39.5/10万和187.9/10万[62]。结合各国的疫情数据,粗略比较下Omicron感染相关的重症率和病死率已下降至与季节性流感类似的水平,但考虑到Omicron极强的传播力以及上述流感病毒流行病学数据的局限性,Omicron感染导致的死亡率(尤其对老年人)不容小觑。
更重要的是,随着对Omicron防疫政策的放松,未来将面对Omicron和流感的双重流行,对于高风险人群将是一个重大威胁。由于我国前两年的防疫政策在控制新冠疫情的同时也对季节性流感的传播起到了有效控制,在疫情暴发的第1年流感病毒在中国的流行和传播被中断[63],在疫情暴发的第2年随着防疫政策适当放松,流感病毒的流行也逐渐恢复[64],本研究团队根据2016年至2022年北京协和医院80 386例患者流感病毒的检测数据分析发现,在Omicron流行期间北京市流感病毒的流行已完全恢复甚至超过了疫情前水平。分析原因可能是疫情初期严格的防疫政策减少了流感病毒对于人群的免疫刺激,机体缺乏适当的免疫记忆,导致Omicron流行期间对流感病毒更易感[65]。因此在后疫情时代,如何减少Omicron和流感病毒对于高风险人群的双重威胁是即将面临的严峻考验。
6 小结与展望
新冠疫情即将迎来第4个年头,从最初的原始毒株到现在席卷世界的第五代VOCs,Omicron在基因组学和生物学特征上发生了明显变化,极强的传播力伴随着病毒本身致病力的下降,结合既往感染和疫苗接种所建立的人群免疫屏障,相较于其他变异株,Omicron疫情呈现出传播力强、重症率和死亡率低的特征,开启了新冠疫情的新起点。人类对于新冠疫情的认知和应对也将进入一个新阶段。
Omicron极强的传播力和免疫逃逸能力使得既往感染和疫苗接种对于重复感染的预防能力非常有限。对于中国而言,在Omicron不断突破防疫壁垒和防疫资源损耗不断增高的情况下,能否和病毒共存已不是问题,问题是如何以最小代价的方式与病毒共存。与世界上相继“躺平”的其他国家不同,中国有其特殊的国情。在疫情初期,中国的防疫政策在极大程度上保障了民生和经济,但在某种程度上也导致了人群缺乏既往感染和疫苗接种建立的混合免疫屏障,当然这也是其他国家付出巨大代价换来的。面对Omicron,疫苗提供的保护能力有限,目前中国高风险人群加强免疫的比例低,虽然Omicron感染导致的死亡率明显降低,但Omicron极强的传播力使我们绝不能低估共存后的死亡人数以及共存后可能面对的医疗挤兑问题。Omicron在不断进化,未来的流行趋势以及优势变异株对人类和社会的影响无人知晓,如何调整防疫政策以实现“软着陆”是我们国家面临的一个考验。
目前,首要的措施是提高以老年人为主的高风险人群加强针疫苗的接种率。加强免疫在预防Omicron感染导致的重症和死亡方面发挥重要作用,有研究通过建模估计,如果对所有60岁以上人群完成加强免疫,我国Omicron的死亡率将降低61%[66]。但目前我国60岁以上人群加强针的接种率为69%,80岁以上人群的接种率仅为40%[67]。首先,提升高风险人群加强免疫水平是逐步放开的首要条件。其次,鼓励不同类型的疫苗异源接种及第4针疫苗接种。再次,应为可能发生的医疗挤兑做好准备,加大科普宣传力度,消除民众恐慌情绪,减少盲目就医挤兑医疗资源。同时,医院也应加强分级诊疗,确保危重症患者得到及时救治,对于感染的高风险患者应及早使用小分子抗病毒药物以减少疾病进展的可能。
综上,2022年Omicron大流行开启了新冠疫情的新起点,我国疫情防控面临新形势、新任务。在大力推进高风险人群加强免疫的基础上,逐步放松疫情防控,预防医疗挤兑,保护高风险人群,逐步调整防疫策略,将防疫重点转移至防治重症和死亡上,同时坚持流行病学监测为可能出现的新变异株做好准备。
作者贡献:李懿负责资料收集和论文撰写;徐英春负责论文修订并审阅定稿。
利益冲突:所有作者均声明不存在利益冲突

