体质量控制与非酒精性脂肪性肝病:来自中国人群的证据
杨晨露,赵欣宇,2,胡诗琪,蓝彦琦,冯宝玉,王 丽
1中国医学科学院基础医学研究所 北京协和医学院基础学院流行病学与卫生统计学系,北京 100730 2首都医科大学附属北京友谊医院临床流行病学与循证医学研究室,北京 100050
非酒精性脂肪性肝病(non-alcoholic fatty liver disease, NAFLD)是排除过量饮酒、病毒性肝炎等其他病因后,脂肪在肝脏过度堆积进而引起的一系列肝损伤,其已成为我国甚至全球排名第一的慢性肝脏疾病,全球成人患病率为25.24%[1],而在我国该数据则达到了29.2%,且呈逐渐上升的趋势[2]。NAFLD可导致肝内及肝外一系列不良结局[3-6],已超越乙型病毒性肝炎和丙型病毒性肝炎,成为全球肝脏相关死亡的最主要原因[7]。
通过改善生活方式实现减重是降低NAFLD疾病负担的有效方法,已被指南推荐为该病的首要预防措施[8-11],但由于NAFLD具有较强的异质性,不同患者可表现为不同程度的肝脏脂肪变性和纤维化[12],并伴随高度复杂的代谢表型[1, 13],而不同代谢表型发生肝内外不良结局的风险存在明显差异[12, 14-15]。因此,减重为不同特征NAFLD患者带来的获益可能具有异质性,但相关证据尚不充足。美国临床内分泌协会及美国肝脏病协会制定的指南指出,NAFLD患者减重超过5%可降低肝脏脂肪含量并可改善心脏代谢,减重超过10%有望逆转脂肪性肝炎或肝纤维化[16],但其研究数据均源于国外人群,尚缺乏中国本土证据。因此,本文基于国内相关队列研究和临床试验数据,分析我国人群中体质量/体质量指数(body mass index, BMI)水平及其变化与NAFLD发生风险以及患者远期结局的关联性,以期为通过体质量控制进行NAFLD预防相关策略的制订提供参考依据。
1 体质量与NAFLD及其不良结局的关联性
1.1 体质量与NAFLD发生风险
2023年最新发表的系统综述显示,全球范围内超重(BMI:非亚洲人群25.0~<30.0 kg/m2,亚洲人群23.0~<27.5 kg/m2)、肥胖(BMI:非亚洲人群≥30.0 kg/m2,亚洲人群≥27.5 kg/m2)人群的NAFLD患病率分别高达70.0%(95% CI: 65.4%~74.2%)和75.3%(95% CI: 70.9%~79.2%)[17],而中国超重/肥胖人群(BMI≥24.0 kg/m2)的NAFLD患病率相对较低(45.4%)[18]。虽然不同研究中基于BMI评估的超重或肥胖定义不同,但大量基于中国人群的研究显示,NAFLD发生风险与超重或肥胖显著相关。一项基于包括中国人群在内的21个亚洲队列人群的Meta分析显示,肥胖者(纳入研究中多以BMI≥25 kg/m2定义为肥胖)的NAFLD发生风险为BMI正常者的3.53倍(RR=3.53, 95% CI:2.48~5.53),且BMI与NAFLD发生风险呈显著的剂量反应关系,即BMI每增加1 kg/m2,NAFLD发生风险增加20%(RR=1.20,95% CI:1.14~1.26)[19]。基于中国河北省开滦队列的研究亦观察到了一致结果(RR=1.17,95% CI: 1.15~1.19)[20]。一项基于我国西北地区甘肃金昌队列中20 051名非NAFLD人群的随访数据显示,相较于基线BMI正常者(BMI<24.0 kg/m2),超重(BMI 24.0~28.0 kg/m2)、肥胖(BMI≥28.0 kg/m2)人群NAFLD发生风险分别增加0.35倍和1.31倍[21]。
1.2 体质量与NAFLD患者不良结局
NAFLD具有可逆转性。基于我国南北方人群的2个队列研究均显示,NAFLD患者基线BMI水平与NAFLD缓解率呈负相关[22-23],基线BMI每增加1 kg/m2,NAFLD病情得到缓解的概率降低19%(95% CI: 6%~30%)[23]。
以死亡或肿瘤为终点事件时,基于开滦队列的研究显示,BMI与NAFLD人群全因死亡、肝脏相关死亡、消化系统肿瘤、肥胖相关肿瘤等不良结局发生风险具有不同的非线性剂量反应关系,且异于非NAFLD人群[24]。若以BMI≥23.0 kg/m2作为超重或肥胖的标准,结合NAFLD状态,可将研究人群分为瘦型NAFLD、超重或肥胖型NAFLD、瘦型非NAFLD、超重或肥胖型非NAFLD 4种亚型。其中瘦型NAFLD患者全因死亡、肝脏相关死亡、消化系统肿瘤和肥胖相关肿瘤的发生风险最高,超重或肥胖型NAFLD患者心血管疾病发生风险最高[24]。
开滦队列的长期随访数据进一步揭示了NAFLD人群基线BMI水平与其不良结局的关联可能受其他代谢指标的影响。综合代谢相关指标(包括BMI、腰围、空腹血糖、血压、高密度脂蛋白胆固醇、甘油三酯和C-反应蛋白),采用无监督的聚类方法对开滦队列中2008—2012年入组的11 458例男性新发NAFLD患者进行再分类,并将超重或肥胖(BMI≥23.0 kg/m2)NAFLD患者分为年龄相关肥胖NAFLD、代谢综合征相关肥胖NAFLD和早发的严重肥胖NAFLD 3个亚型,瘦型NAFLD分为伴重度高血压的瘦型NAFLD、伴适度代谢紊乱的瘦型NAFLD 2个亚型。结果显示,不同亚型男性新发NAFLD患者的不良结局发生风险显著不同,表现为伴重度高血压的瘦型NAFLD患者全因死亡和肿瘤的发生风险最高,但其发生心血管疾病和慢性肾脏病的风险略低于年龄相关肥胖NAFLD患者;代谢综合征相关肥胖NAFLD患者的心血管疾病发生风险最高(图1)[25]。
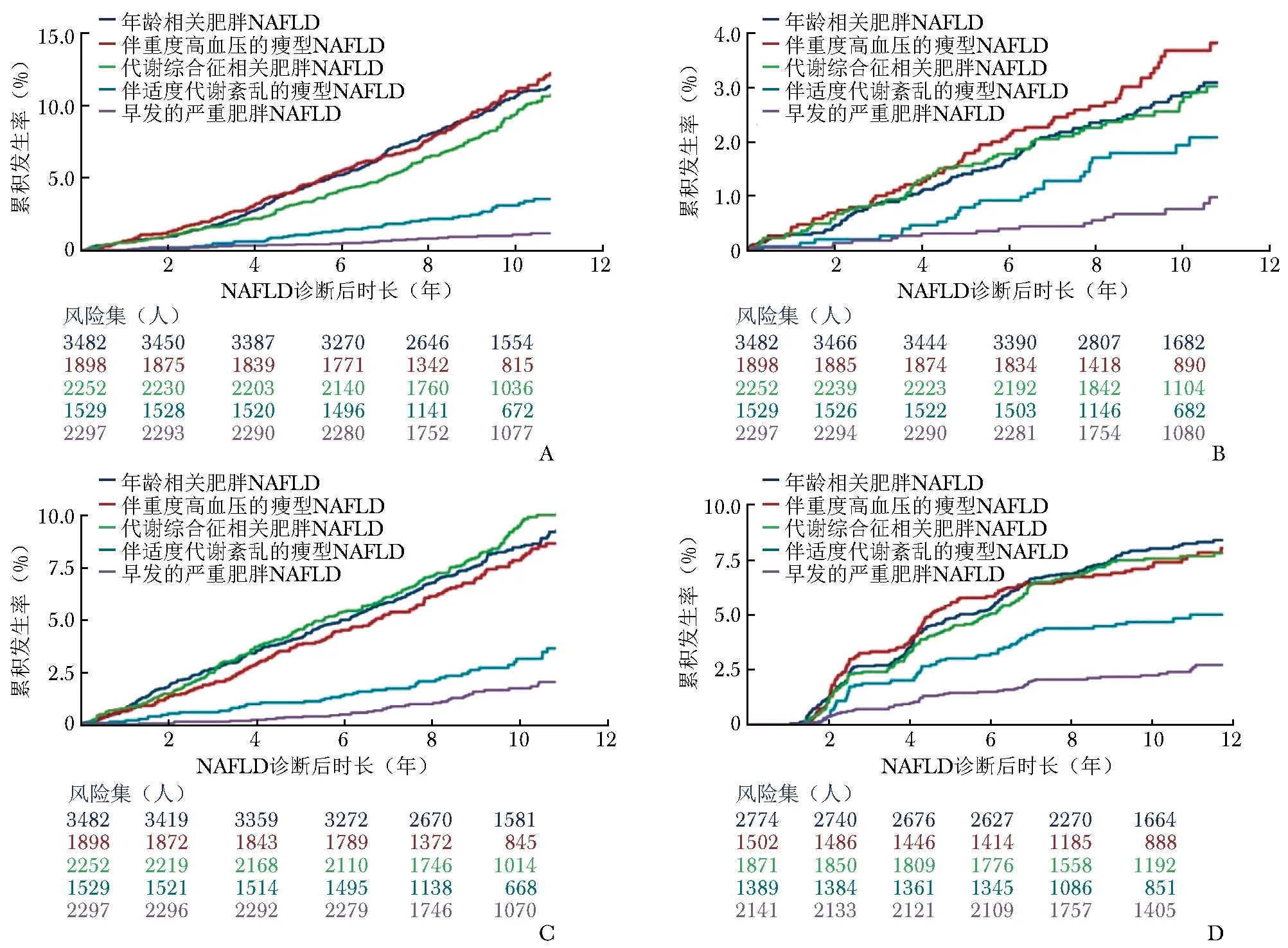
图1 不同亚型男性新发NAFLD患者不良结局累积发生率[25]
2 体质量控制与NAFLD预防
虽然4项基于中国北方基线非NAFLD人群的研究均提示,控制体质量可降低一般人群NAFLD发生风险[26-29],但由于不同研究对BMI变化的评估方法及评估时间窗不同,目前对于如何控制体质量进行NAFLD预防尚未达成一致结论。基于群体水平的轨迹分析方法评估BMI及其变化对NAFLD影响的研究显示,相较于BMI稳定组,BMI增加组NAFLD发生风险增加;另一项观察人群窗口期内BMI均相对稳定的研究提示,基线BMI水平较高者NAFLD发病率较基线BMI水平较低者显著增加[26-27]。上述研究初步提示,体质量控制对NAFLD具有预防作用,但该分析方法仅能作出定性评估结果,无法进行定量分析。
多项研究基于个体水平评估了体质量变化对NAFLD发生风险的影响,但不同研究之间评估方法亦不同。哈尔滨医科大学一项针对成年后不同时期体质量变化与NAFLD相关性的回顾性研究发现,成年早期(25~40岁)年均体质量每增加1 kg,NAFLD发生风险升高105%(95% CI: 29%~224%),但该研究未观察到成年晚期(>40岁)人群体质量年均变化量与NAFLD具有显著关联;中介分析结果显示,BMI增加可通过影响胰岛素水平和胰岛素抵抗指数进而对NAFLD发生风险产生影响[28]。另一项基于开滦队列中19 447名非NAFLD人群临床资料的前瞻性队列研究则发现,体质量控制对于NAFLD的影响需充分考虑其基线体质量水平及性别差异。相较于体质量稳定者(BMI变化量为-3%~3%),仅在基线BMI<24 kg/m2的男性人群中观察到体质量减轻(BMI变化量<-3%)可降低NAFLD发生风险;在基线BMI≥24 kg/m2的男性、女性人群中均可观察到体质量减轻对NAFLD发生风险具有预防作用[29]。
3 体质量控制与NAFLD患者不良结局
3.1 体质量控制与NAFLD代谢状态
来自中国人群的队列研究与临床试验均显示,控制体质量可改善代谢状态[30-31]。一项基于中国老年男性退伍军人的研究显示,相较于非NAFLD人群,NAFLD患者发生2型糖尿病的风险随BMI变化量增加而升高,BMI变化量<-1.00 kg/m2,-1.00~1.00 kg/m2、>1.00 kg/m2的NAFLD患者发生2型糖尿病的风险分别增加59.9%、64.0%和91.8%[30]。基于厦门地区开展的随机对照试验显示,相较于不进行运动干预的对照组,中等强度运动和高强度运动12个月可显著改善NAFLD患者的体质量、腰围、血压及肝内甘油三酯水平;但调整体质量减轻这一变量后,运动组与对照组肝内甘油三酯水平无显著差异[31],提示运动带来的肝内甘油三酯含量减少获益可能与减重密切相关。
3.2 体质量控制与NAFLD患者不良结局预防
目前,体质量控制与NAFLD患者不良结局发生风险的相关性仅在开滦队列研究中被报告。该研究对基线无慢性肾脏病的10 311例新发成年(18~79岁)男性NAFLD患者进行了中位10年的随访,结果显示随减重程度增加,NAFLD患者慢性肾脏病发生风险逐渐降低,二者呈线性变化趋势(P=0.01),其中减重≥7%可显著降低慢性肾脏病发生风险,如减重7%~9.9%、≥10%分别可将慢性肾脏病发病风险降低47%(HR=0.53,95% CI:0.28~0.99)、42%(HR=0.58,95% CI:0.34~0.97)[32]。但后续研究未见体质量下降对心血管疾病具有保护作用。基于开滦队列中基线无心血管疾病史的8591名成年(18~59岁)男性长期随访数据(中位随访9.41年)进一步分析了体质量控制对NAFLD人群心血管疾病发生风险的影响,并根据第二次随访相对初次随访(间隔1~4年)时BMI变化情况,将患者分为持续非肥胖组、增重组、减重组和持续肥胖组。结果显示,相较于持续非肥胖组,增重组(HR=1.57, 95% CI: 1.03~2.38)和减重组(HR=1.52, 95% CI: 1.00~2.30)心血管疾病发生风险均显著增加[33],提示对NAFLD人群进行体质量控制应在对其未来不同不良结局发生风险综合评价的基础上有针对性地开展。
4 NAFLD研究展望
4.1 体质量控制与NAFLD多种不良结局的研究
虽然美国临床内分泌协会及美国肝脏病协会制定的指南认为,无论是超重、肥胖或是正常体质量的NAFLD人群,均可通过减重实现NAFLD病情逆转[16],但其证据主要来源于高加索人群。鉴于包括中国在内的亚洲人群在相同BMI下呈现的代谢状态,尤其体脂水平与西方国家人群显著不同[34],提示中国人群中NAFLD患者的体质量控制策略可能具有不同于西方国家人群的异质性,如基于开滦队列的研究结果显示,体质量下降>3%并不能降低正常体质量(BMI<24 kg/m2)女性NAFLD发生风险。
此外,目前的研究证据多以NAFLD缓解、肝脏纤维化进展等中间指标为结局事件,而对NAFLD远期不良结局尚缺乏深入研究。基于我国开滦队列的研究显示,体质量控制虽然可降低NAFLD人群远期慢性肾脏病发生风险,但该方法在预防心血管疾病方面未带来获益,此结果与国际指南[16]不相符。由于目前国内NAFLD患者进行体质量控制与其肝内外不良结局发生风险相关性的证据非常有限且多来源于开滦队列,期望未来可纳入更多长期随访的队列数据,以进一步挖掘体质量控制对NAFLD患者远期预后的影响,并进一步开展干预性研究,以期为NAFLD人群制定科学的减重策略。
4.2 基于NAFLD异质性评估体质量控制的作用
除评估BMI变化的方法及时间窗不同外,NAFLD较强的异质性可能是导致不同研究中体质量控制对NAFLD预防效果存在差异的另外一个重要原因。相同BMI下NAFLD患者可具有不同的代谢表型,本团队前期研究发现,超重或肥胖以及瘦型BMI人群可基于伴随的代谢表型实现分层,且再分层人群不良结局的差异性进一步验证了伴随不同代谢表型、不同BMI水平的NAFLD患者预后风险不同的假说。此外,相同的体质量控制标准下,慢性肾脏病、心血管疾病等不良结局风险具有较强的异质性,亦提示基于风险分层后进一步对NAFLD人群进行体质量精准控制具有必要性。精准分层需考虑年龄、性别、种族、膳食、代谢状态、遗传等因素[35],最终根据患者个体疾病驱动因素提供精准的体质量控制建议及阈值。
4.3 多种诊断方式验证体质量控制在NAFLD预防及其不良结局发生风险中的作用
NAFLD作为一种长期被忽视的慢性肝病,其远期不良结局发生风险的证据仍需基于不同人种、不同来源的队列人群,包括基于不同诊断标准NAFLD人群的长期随访数据进行验证。目前,全球NAFLD相关队列主要包括3类,即自然人群队列、特殊人群队列及NAFLD专病队列。由于多数自然人群队列、特殊人群队列并非基于NAFLD人群构建,因此90%以上队列中的NAFLD诊断方法均为基于腹部超声诊断为脂肪肝的基础上,排除过量饮酒、乙型或丙型肝炎病毒感染等导致肝脂肪变性的其他病因后确定,除此之外,少数队列研究基于分子标志物进行NAFLD识别、诊断[12]。但上述NAFLD诊断方法存在一定局限性,如超声对脂肪含量低于20%的脂肪变性无法准确检出[36],目前尚缺乏可在整个疾病谱中进行NAFLD准确诊断和分期的可靠生物标志物[37-38]。因此,期待后续基于NAFLD准确诊断方式的研究问世,以对前期研究结果进行验证。
5 小结与展望
NAFLD已成为全球最主要的慢性肝脏疾病,其不仅是肝硬化、肝癌等肝脏病变的重要诱因,且可能增加慢性肾脏病、心血管疾病、肿瘤等肝外不良事件发生风险,以致全因死亡风险增加,但不同研究结果具有异质性。体质量控制被认为是有应用前景的NAFLD预防与控制方式,已获得指南认可,但仍需高质量临床研究加以验证。本文基于中国人群的随访数据,分析了体质量控制对NAFLD预防及其远期结局的影响,为该病的预防与控制提供了高质量循证医学证据。由于本文仅整理了现有国内临床试验及队列研究中的相关证据,缺乏多维度对NAFLD患者异质性的分层,未来需开展多中心前瞻性队列研究,充分考虑NAFLD的异质性,整合人口学特征、生活方式、遗传等多方面因素,以精准判定NAFLD高危人群,并制订针对性、个体化体质量控制策略,以期实现NAFLD的精准防控。
作者贡献:杨晨露负责论文撰写;王丽负责选题设计、论文修订;赵欣宇、胡诗琪、蓝彦琦、冯宝玉负责文献分析。
利益冲突:所有作者均声明不存在利益冲突

