某规模化奶牛场奶牛乳房炎患病率及主要致病菌调查
张家瑞,剡文亮,宋 洁,庞 路,田江亚,何 军,李智星,魏 勇*
( 1.新疆生产建设兵团畜牧兽医工作总站,新疆 乌鲁木齐 830063 ; 2.新疆天润乳业股份有限公司,新疆 乌鲁木齐 830063 )
随着奶牛养殖业逐步实现规模化和现代化,奶牛受到自身免疫能力下降、饲养环境不良、天气骤然变化、日粮营养摄入失衡以及致病菌侵入等诸多因素影响均可能引起奶牛乳房炎,对养牛业造成一定经济损失[1]。对于奶牛临床型乳房炎,兽医可通过观察奶牛乳头状况和乳汁的颜色、气味、黏稠度以及有无絮片、凝块等临床症状进行诊断。有研究发现,能够引起奶牛乳房炎的常见致病菌有二十多种,其中包括许多易产生耐药性的菌株;无法较准确获知主要致病菌,会对后续针对性的临床治疗和处置方案制定造成巨大障碍[2]。患隐性乳房炎的奶牛一般不会表现明显的临床体征变化,但牛奶质量和产量会受到严重影响。为快速、准确地筛选出可能患有隐性乳房炎的牛,需结合多种快速检测方法进行判定才更具科学性和实用性。
近年来,运用快检方法和致病菌分离鉴定法对当地的奶牛乳房炎患病情况和主要致病菌种类的研究逐渐受到重视。罗金印等[3]应用兰州乳房炎检测法(MT)诊断法进行兰州地区奶牛乳房炎流行病学调查及病原菌的分离鉴定。胡海燕等[4]先采用美国加州乳房炎(CMT)方法筛选出天津某牧场患乳房炎病奶牛,再通过传统培养方法对乳房炎奶样、患病牛畜舍及奶厅样品进行细菌分离与鉴定,了解了牧场奶牛乳房炎奶样及环境中细菌的种类和流行性。奶牛乳房炎的快速诊断和主要致病菌的鉴定会提高牧场奶牛乳房炎的治愈率,降低细菌产生耐药性的概率。本试验采用CMT和体细胞数检测(SCC)对隐性型乳房炎进行快速诊断,临床外观法诊断临床型乳房炎并进行主要致病菌分离鉴定,以期为该场奶牛乳房炎后续治疗和防控提供参考。
1 材料与方法
1.1 试验材料
脑心浸出液肉汤(BHI)、麦康凯琼脂培养基、甘露醇高盐琼脂培养基、哥伦比亚血琼脂基均购自青岛高科技工业园海博生物技术有限公司,伊红美蓝琼脂购自北京奥博星生物技术有限责任公司,30%过氧化氢溶液购自西安化学试剂厂,革兰氏染色液购自珠海贝索生物技术有限公司,CMT检测试剂购自生泰尔(内蒙古)科技有限公司。
Ⅲ型体细胞检测仪购自华诚睿光(中国)生物科技有限公司、电热恒温培养箱购自上海鸿都电子科技有限公司、超净工作台购自苏州苏洁净化设备有限公司。
1.2 样品来源
该某规模化奶牛场截止至2022年7月存栏量为1 771头,其中泌乳牛728头、干奶牛118头、青年牛698头、犊牛227头。泌乳牛基本饲养于封闭式圈舍,犊牛饲养于犊牛岛和半开放式牛棚,其他牛群饲养于开放式牛棚。
本试验对该规模化奶牛场的728头荷斯坦泌乳牛进行临床观察,从每头患临床乳房炎奶牛的患病乳区采集乳样15 mL,共采集临床型乳房炎牛乳汁12份。从每头CMT阳性奶牛的患病乳区采集乳样15 mL,共采集隐性乳房炎牛乳汁39份。
1.3 试验方法
1.3.1 临床型乳房炎诊断
该牛场挤奶厅采用全自动套杯式挤奶机,弃头三把奶时检查乳汁是否存在颜色、性状等的变化,若出现气味恶臭、清水样、絮片和凝块等典型的乳房炎症状则可诊断为临床型乳房炎。
1.3.2 CMT检测及结果判定
挤奶前进行乳区药浴,随后用经过消毒的热毛巾擦拭待检乳头,擦拭完一头牛后立刻更换毛巾再擦拭下一头。待检乳头随后经碘伏溶液药浴35 s后,弃头三把奶,检测员将检测盘水平放置于对应待检乳头下,将乳汁分别挤在对应的检测盘内。弃去多余乳汁,使各检测盘内的乳汁量基本一致,向每个检测杯中加入与乳汁等量的CMT检测液,水平摇匀两种液体,按照CMT试剂判定标准进行隐性乳房炎判定。
CMT检测结果判定:乳汁和CMT检测液混合后,无明显变化且不出现沉淀,或少许沉淀但不久即消失判为阴性(-);出现少量凝胶沉淀判为弱阳性(+);出现大量凝胶块呈凹凸附着于盘底判为阳性(++);出现整块凝胶块,无法回转搅动附着于盘底判为强阳性(+++)。
1.3.3 SCC检测及结果判定
采用15 mL乳样收集管收集CMT检测结果为“+”以上的乳区乳汁样品,送至牛场化验室,按照Ⅲ型体细胞检测仪操作说明书进行乳样SCC诊断检测。
SCC检测结果判定:根据国际乳业联合会(IDF)牛乳体细胞数推荐分级标准的具体规定,牛乳汁中体细胞数在50万个/mL以上的牛可判断为隐性乳房炎[5]。
1.3.4 细菌分离鉴定
无菌采集患临床型奶牛乳房炎的乳汁样品,在超净工作台内用无菌枪头吸取100 μL乳汁滴加并涂布至BHI培养基中,置于37 ℃恒温培养箱培养18~24 h,观察培养基中菌落形态、颜色和大小,逐一挑取单个菌落进行纯化。细菌被纯化至只能观察到单一形态的菌落时进行革兰氏染色,100倍油镜下观察细菌形态。
根据革兰氏阳性菌和革兰氏阴性菌分别无菌挑取BHI培养基中的单个菌落划线于哥伦比亚血琼脂培养基、甘露醇高盐琼脂培养基、麦康凯琼脂和伊红美蓝琼脂,置于37 ℃恒温培养箱培养18~24 h后,根据细菌的形态特征按照奶牛乳房炎细菌分离鉴定程序[6]进行初步鉴定。
1.4 数据统计与分析
试验数据采用Excel软件、SPSS软件进行统计分析,统计待检奶牛胎次与奶牛隐性乳房炎头阳性率的关系。
2 结果与分析
2.1 奶牛场临床型乳房炎和隐性乳房炎患病率(见表1、表2)
由表1可知,本试验对728头泌乳奶牛进行乳房炎患病率调查,发现12头奶牛的12个乳区患临床型乳房炎,该规模化奶牛场的临床型乳房炎头阳性率及乳区阳性率分别为1.65%(12/728)和0.41%(12/2 896),瞎乳头率为0.55%(16/2 912)。

表1 奶牛场奶牛临床型乳房炎患病情况Tab.1 Prevalence of clinical mastitis in dairy cows
由表2可知,运用CMT法从剩余未表现出临床乳房炎症状的716头奶牛中检测出隐性乳房炎头阳性率及乳区阳性率分别为5.45%(39/716)和1.46%(42/2 884)。为避免肉眼观察造成的失误,将39头奶牛的42个乳区的乳样进行SCC法检测,结果均为隐性乳房炎。

表2 奶牛场奶牛隐性乳房炎患病情况Tab.2 Prevalence of latent mastitis in dairy cows
2.2 不同胎次的奶牛隐性奶牛乳房炎的患病情况(见表3)
由表3可知,该规模化奶牛场不同胎次间的奶牛患隐性乳房炎的头阳性率存在明显差异,其中4胎泌乳牛隐性乳房炎的患病头数明显高于其他胎次的泌乳牛,6胎及以上泌乳牛的头阳性率明显高于其他胎次。
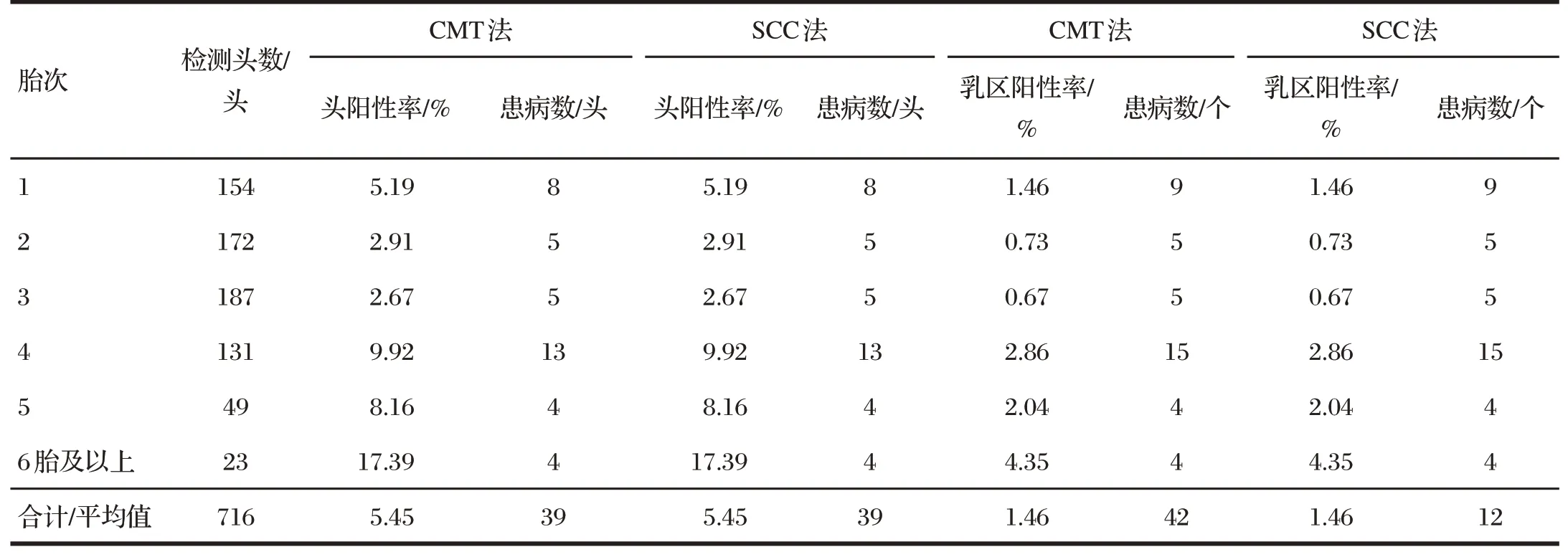
表3 不同胎次的奶牛隐性奶牛乳房炎的患病情况Tab.3 Prevalence of recessive mastitis in cows with different parity
2.3 细菌分离鉴定试验结果(见图1)
由图1(a)~图1(c)可知,挑取BHI琼脂中经分离纯化出的单一菌落,经革兰氏染色,镜检观察到呈圆形或椭圆形,单个菌体较大,多成簇、成对或单个存在的革兰氏阳性菌。单个菌体稍小,多为链状排列,链的长短不一,长者可多达十几乃至近百个菌体相连;短者为成对出现的革兰氏阳性菌和两端圆,中等大,单个或两个菌体相连出现的革兰氏阴性短杆菌。
由图1(d)可知,甘露醇高盐琼脂培养基上的菌落生长良好,呈黄玉米色且不透明,菌落下的琼脂也呈黄玉米色。由图1(e)可知,哥伦比亚血琼脂上的菌落灰白色不透明,出现β溶血。由图1(f)可知,麦康凯琼脂培养基上的菌落生长旺盛,菌落呈粉红色,不透明,菌落下的琼脂也呈粉红色。由图1(g)可知,伊红美蓝琼脂中观察到带有金属光泽的单个菌落。由图1(h)可知,圆圈中3%过氧化氢溶液中出现气泡,方框中3%过氧化氢溶液中无气泡。
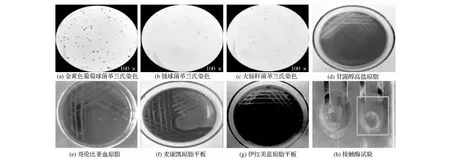
图1 细菌分离鉴定结果Fig.1 Results of bacterial isolation and identification
3 讨论
如今,奶牛乳房炎仍然是阻碍养牛业良性发展的因素之一。快速、准确地筛选出可能患有隐性乳房炎的牛及较准确地获知引起奶牛乳房炎的主要致病菌,以减少制定后续针对患乳房炎牛的临床治疗和处置方案的障碍,从而降低其对牛奶质量和产量方面造成的经济损失,促进奶牛养殖业的健康发展奠定良好的基础[7]。
3.1 该牛场奶牛乳房炎的患病率较低但仍需改善
本试验通过采用CMT和SCC对隐性型乳房炎进行诊断,临床外观法诊断临床型乳房炎。结果显示,该规模化奶牛场的临床型乳房炎头阳性率及乳区阳性率分别为1.65%(12/728)和0.41%(12/2 896);隐性乳房炎头阳性率及乳区阳性率分别为5.45%(39/716)和1.46%(42/2 884);瞎乳头率为0.55%(16/2 912)。
宋家骐等[8]对兖州区某规模牛场进行隐性乳房炎和临床型乳房炎实地调查,奶牛隐性乳房炎的阳性率为23.7%,临床型乳房炎发病率为4.3%。刘鸽等[9]采用SCC法对石河子某奶牛场奶牛隐性乳房炎的发病情况进行调查,头阳性率高达39.81%(164/412),乳区阳性率为26.95%(436/1 618)。虽然本研究中牛场奶牛乳房炎的患病率低于上述调查结果,但该牛场的奶牛乳房炎患病情况和国内一流奶牛养殖企业的养殖水平仍存在一定距离,还需具体分析复杂的患病原因,方可有效改善泌乳牛的健康情况。
3.2 不同胎次的奶牛患隐性乳房炎的主要风险因素不同
本试验发现,该牛场不同胎次间的奶牛患隐性乳房炎的头阳性率均差异显著,其中6胎及以上的泌乳牛的隐性乳房炎的患病头数均显著高于其他胎次的泌乳牛。刘鸽[10]对新疆石河子地区某规模化奶牛场的712头澳系荷斯坦泌乳牛进行的乳房炎患病情况调查,使用LMT法和SCC法统计分析出奶牛的生产胎次和奶牛乳房炎患病率呈正相关,奶牛乳房炎患病率与年龄增长基本呈正相关,与本研究得出的结果相似。
初步分析出现该结果的原因可能是年龄偏大的奶牛乳房韧带松弛,下坠的乳头会增加挤奶工检查乳汁性状变化的难度,难以及时发现处于乳房炎初期的牛乳汁异常情况,导致患病奶牛不能及时得到治疗,后续增加了发展成隐性乳房炎的概率,患牛还会变为不断排毒的传染源,威胁同群其他健康牛[11]。此外,日常的生产中,年龄偏大的奶牛乳房受伤的概率会大大增加,加之年龄偏大的奶牛自身免疫力下降,感染乳房炎致病菌的机会增加。因此,在奶牛场的实际生产中,应有计划地淘汰年龄偏大的奶牛,适时调整泌乳牛年龄结构。
本研究中,头胎牛的隐性乳房炎的头阳性率稍低于4胎牛,分析原因可能是头胎牛攻击性强,对待挤奶员的刺激会有激烈的自卫性反应,挤奶员出于对个人安全的考虑会放弃对其进行细致消毒。此外,若挤奶前消毒不规范,未做到在擦完前一头奶牛后及时更换毛巾;挤奶员在挤完患病牛后不及时清洗双手或更换橡胶手套,只在一批牛挤奶完毕后才进行手套的消毒工作,不规范操作极易造成健康牛受到病原微生物侵害而患病[12]。
3.3 致病菌的感染依然是主要风险因素之一
本试验从12份临床型乳房炎乳汁样本中初步分离鉴定出2株金黄色葡萄球菌、5株大肠杆菌和5株链球菌属。本研究结果与罗金印[3]的兰州地区无乳链球菌和大肠杆菌检出率最高,金黄色葡萄球菌检出率其次的结论基本一致。由于某些因素造成奶牛乳头受损或奶牛机体发生比较严重的感染时,机体的防御平衡被打破,病原微生物趁机入侵;或原本寄居于乳房内的条件性病原微生物开始活化,并大量增殖而使乳房致病[13]。
大多数奶牛场只重视隐性乳房炎对乳品质检测中体细胞数等指标的影响,但对引发奶牛患临床型乳房炎的主要致病菌的危害性认识不足。金黄色葡萄球菌广泛分布于日常环境中,具有很强的传染性、对抵御环境和外部压力的耐受能力强等特点,对抗生素的耐药性十分明显,是导致奶牛患乳房炎的主要致病菌[14]。随着细菌变异、耐药菌株增多,奶牛乳房炎临床治疗和淘汰处置难度增加,需要对患牛进行有针对性的治疗,方可达到更好的治疗效果,有效规避产生耐药菌产生。有研究发现,大肠杆菌可在偏酸性的环境下进行增殖。当泌乳牛的饲料配方中出现蛋白质含量偏高,脂肪含量偏低等营养失衡的情况时,可能会导致乳房内出现偏酸性环境,大肠杆菌可大量定植[15]。只有当奶牛自身免疫力降低时,链球菌才会引起奶牛患乳房炎,但单纯由链球菌诱发的奶牛隐性型乳房炎仍然会使产奶量急剧下降。因此,若牛场未对泌乳牛进行分段饲喂可能会增加大肠杆菌和链球菌等条件致病菌的侵入,进而诱发奶牛乳房炎[16]。
4 结论
综上所述,该奶牛场奶牛乳房炎患病率较低但仍需进一步加强预防管理,金黄色葡萄球菌、大肠杆菌和链球菌属可能是该牛场乳房炎主要致病菌。

