青蒿素纳米脂质体的制备工艺研究
曹永强,吴昌旭,王婷婷,张铭林,胡庭俊,于美玲
( 广西大学动物科学技术学院,广西 南宁 530005 )
青蒿素是一种分离自植物青蒿(黄花蒿叶)中的倍半萜烯内酯[1]。自屠呦呦教授于20世纪70年代发现青蒿素后,关于青蒿素及其衍生物的研究层出不穷。有研究发现,青蒿素及其衍生物具有抗寄生虫[2-3]、抗肿瘤[4]、抗病毒[5]、抗菌[6]、抗炎[7]、抗纤维化[8]和保护肾脏[9]等作用。青蒿素的应用研究主要集中于各种动物寄生虫疾病的防治,如应用青蒿素治疗猪附红细胞体病、鸡柔嫩艾美尔球虫、牛焦虫病、锥虫病和血吸虫病等[10-13]。但因青蒿素存在水溶性差、生物利用度低、半衰期短和稳定性差等特点限制了其在兽医临床中的应用[14]。纳米脂质体药物递送系统能够提高青蒿素的水溶性,并将药物靶向递送到靶器官,从而解决青蒿素溶解度差的问题;还能够提高药物生物利用度,具有很好的缓释作用和穿透作用[15]。本试验通过比较薄膜分散法、逆向蒸发法、乙醇注入法和改良乙醇注入法,优选制得脂质体粒径较小、包封率较高、操作简单的制备方法,并通过单因素试验和Box-Benhnken响应面法优化了其制备工艺,为应用青蒿素防控动物疾病提供参考。
1 材料与方法
1.1 试验材料
1.1.1 药品及试剂耗材
青蒿素(批号:20210720,陕西宝鸡市方晟生物开发有限公司)、青蒿素标准品(北京索莱宝科技有限公司)、大豆卵磷脂(上海生工生物工程股份有限公司,BC级,纯度≥60%)、胆固醇(上海生工生物工程股份有限公司,Reagent级)、2%磷钨酸负染色液(北京索莱宝科技有限公司)、透析袋MD34(规格:MD34,透析膜截留分子量:3500D,北京索莱宝科技有限公司)、200目碳膜铜网(深圳市瑞格锐思科技有限公司)。NaOH、无水乙醇、二甲基亚砜(DMSO)和NaCl试剂等均为国产分析纯。
1.1.2 仪器设备
HEI VAP ADVANTAGE旋转蒸发仪(海道夫公司)、UV-1800紫外可见光分光光度计(岛津仪器有限公司)、Zetasizer Nano-ZS纳米粒度电位分析仪(Malvern instrument lid)、SCIENTZ-IID超声波细胞粉碎仪(宁波新芝生物科技股份有限公司)、HH-4数显恒温水浴锅(常州澳华仪器有限公司)、524G恒温磁力搅拌器(上海梅颖浦仪器仪表制造有限公司)、himac CF16RN多用途冷冻离心机(日立公司)、日立HT7700透射电子显微镜(日立公司)。
1.2 试验方法
1.2.1 青蒿素纳米脂质体制备方法的优选
1.2.1.1 薄膜分散法
精确称取大豆卵磷脂250 mg、胆固醇50 mg、青蒿素12.5 mg,加入无水乙醇超声溶解。45 ℃旋转减压蒸发除去有机溶剂,形成一层均匀的薄膜后,加入10 mL生理盐水,边振摇边水浴超声使脂质膜溶于水相呈混悬液。混悬液经0.45 μm有机滤膜过滤,得青蒿素纳米脂质体。
1.2.1.2 逆向蒸发法
精确称取大豆卵磷脂250 mg、胆固醇50 mg、青蒿素12.5 mg,加入无水乙醇超声溶解。将10 mL生理盐水加入有机相中,振摇使之呈淡黄色乳状液。45 ℃旋转减压蒸发除去有机溶剂。混悬液经0.45 μm有机滤膜过滤,得青蒿素纳米脂质体。
1.2.1.3 乙醇注入法
精确称取大豆卵磷脂250 mg、胆固醇50 mg、青蒿素12.5 mg,加入无水乙醇超声溶解。将有机相用注射器缓缓地滴加入45 ℃水浴的10 mL生理盐水中,边滴加边搅拌,然后置于磁力搅拌器上常温搅拌3~4 h。混悬液经0.45 μm有机滤膜过滤,得青蒿素纳米脂质体。
1.2.1.4 改良乙醇注入法
精确称取大豆卵磷脂250 mg、胆固醇50 mg、青蒿素12.5 mg,加入无水乙醇超声溶解。将有机相用注射器缓缓地滴加入45 ℃水浴的10 mL生理盐水中,边滴加边搅拌,然后置于恒温磁力搅拌器搅拌30 min,40 ℃旋转蒸发30 min后,常温磁力搅拌1~2 h。混悬液用细胞破碎仪探头超声10 min,期间每超声10 s,暂停10 s。混悬液经0.45 μm有机滤膜过滤,得青蒿素纳米脂质体。
1.2.1.5 标准曲线的绘制
准确称取青蒿素标准品2 mg,溶解于1 mL DMSO中,配制2 000 mg/L溶液。精密量取溶液于10 mL容量瓶中,用2% NaOH溶液-DMSO(1∶1,V/V)定容至刻度,配成10、20、30、40、50、100和125 mg/L的青蒿素标准溶液,室温反应1 h。在291 nm处进行吸光度值测定,以青蒿素标准品质量浓度为横坐标,吸光度值为纵坐标,绘制标准曲线。
1.2.1.6 包封率、粒径、多分散性指数(PDI)和Zeta电位的测定
包封率测定参考Isacchi等[16]的方法。将2 mL脂质体转移到透析袋中,在800 mL生理盐水中透析2 h,中间将水介质更换一次,利用透析法去除游离青蒿素。收集透析袋中液体,加入适量2% NaOH-DMSO混合液超声破乳10 min,室温反应35 min,8 000 r/min离心15 min,取上清液,在291 nm处测定吸光度值。另取未经透析的脂质体溶液2 mL,同法操作。通过青蒿素标准曲线计算包封率。

式中:w1为透析后的纳米脂质体中青蒿素的质量;w2为纳米脂质体中青蒿素的总量。
粒径、PDI和Zeta电位测定:将纳米脂质体稀释10倍,用马尔文纳米粒度电位分析仪测定脂质体粒径分布、PDI和Zeta电位。
1.2.2 青蒿素纳米脂质体制备单因素试验
根据制备方法筛选结果选择本试验条件下的最佳制备方法进行工艺优化。通过单因素试验分别考察药脂比(1∶10、1∶12、1∶14、1∶16、1∶18、1∶20、1∶22和1∶26)、磷胆比(3∶1、4∶1、5∶1、6∶1和7∶1)、生理盐水体积(5、10、15、20、25和30 mL)、超声时间(5、10、15和20 min)对青蒿素纳米脂质体包封率的影响。
1.2.3 Box-Behnken响应面设计
单因素考察结果表明,药脂比、磷胆比和生理盐水体积对青蒿素纳米脂质体的包封率的影响较为显著,故选取这3个因素作为考察对象。每个因素选取3个水平,各因素及水平见表1。以包封率(Y)作为响应值,建立数学模型,优化青蒿素纳米脂质体制备工艺。利用Design Expert 13.0 软件建立Box-Behnken试验设计。

表1 Box-Behnken试验设计因素和水平Tab.1 Factors and levels of Box-Behnken experimental design
1.2.4 青蒿素纳米脂质体制备工艺验证试验
在响应面优化的最佳条件下重复青蒿素纳米脂质体的制备和包封率的测定。每个样品进行3个重复,测定脂质体的包封率、粒径、PDI和Zeta电位。
1.2.5 青蒿素纳米脂质体形态学研究
将青蒿素纳米脂质体用超纯水进行10倍稀释,取适量稀释液滴加至200目的碳膜铜网上,静置3~5 min,用滤纸条从液滴边缘吸去多余液体,自然干燥。滴加2%的磷钨酸负染色液,静置2 min,吸去多余液体,静置干燥。使用透射电镜观察脂质体的形态。
2 结果与分析
2.1 青蒿素标准曲线(见图1)
由图1可知,线性回归方程:y=0.013 2x-0.019 2,y为吸光度,x为青蒿素对照品浓度,相关系数R2=0.999 8。
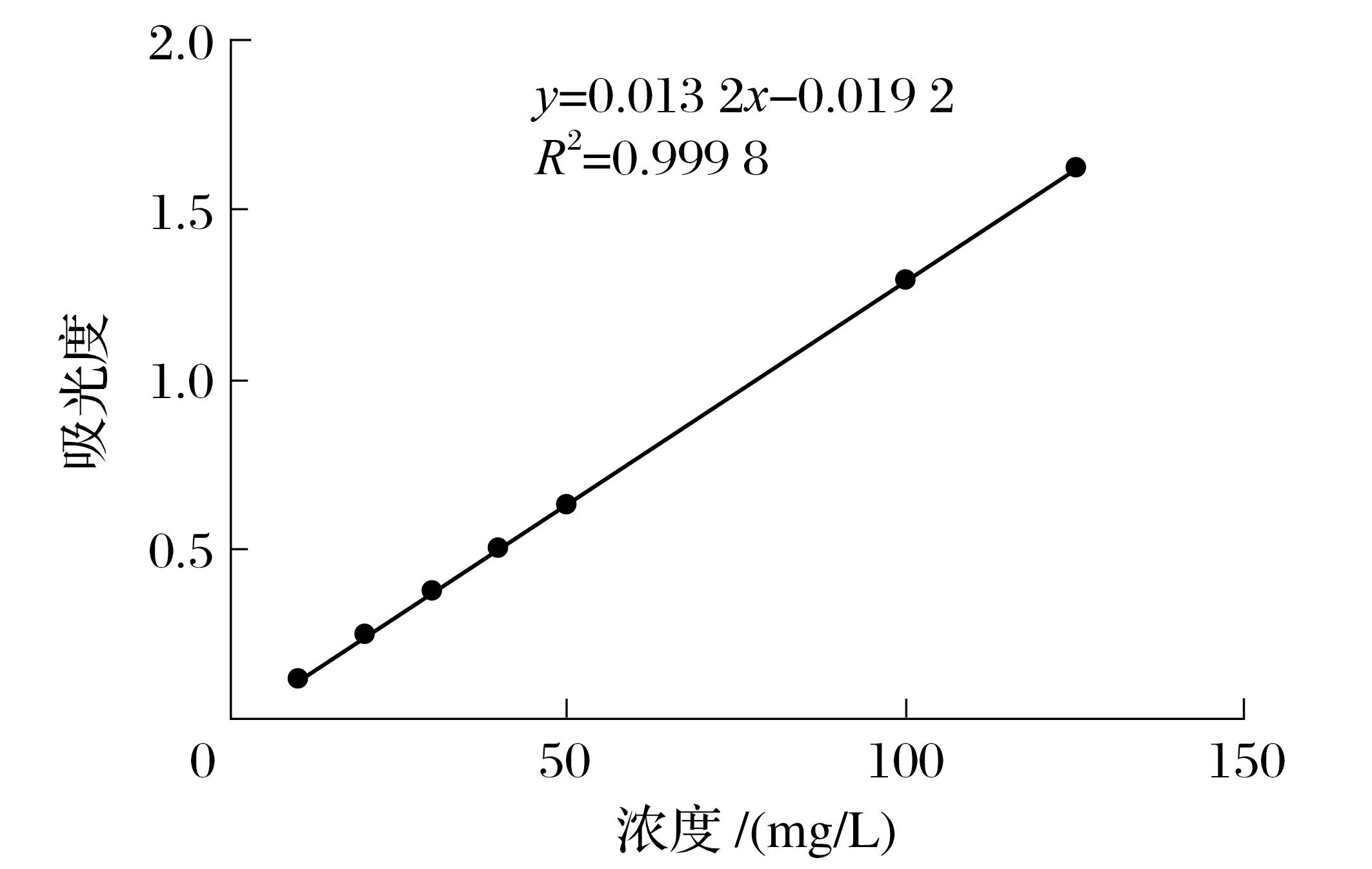
图1 青蒿素标准曲线Fig.1 Artemisinin standard curve
2.2 不同方法制备脂质体的包封率、平均粒径和PDI(见表2)
由表2可知,薄膜分散法的包封率和逆向蒸发法的包封率均较低,分别为41.31%和41.04%。乙醇注入法包封率为48.65%,平均粒径为(214.20±2.48)nm。改良乙醇注入法的包封率为58.79%,为4种方法中最高,其平均粒径和PDI最低,为本试验条件下最佳方法,故选择改良乙醇注入法进行工艺优化。

表2 不同方法制备脂质体的包封率、平均粒径和PDITab.2 Encapsulation efficiency, mean particle size and PDI of different preparation methods
2.3 各因素对青蒿素纳米脂质体包封率的影响(见图2)

图2 各因素对青蒿素纳米脂质体包封率的影响Fig.2 Effects of various factors on encapsulation efficiency of artemisinin nanoliposomes
由图2(a)可知,药脂比对脂质体的包封率影响较大。药脂比为1∶10~1∶14时,包封率随药脂比增加而增高;药脂比为1∶14时包封率最高,为59.99%;药脂比为1∶14~1∶26时,包封率随药脂比增加而逐渐减小。
由图2(b)可知,磷胆比对脂质体的包封率影响较大。磷胆比在3∶1~5∶1范围内时,包封率随着磷胆比增加而增高,磷胆比在5∶1时,包封率最高,为56.90%。磷胆比在5∶1~7∶1范围内时,包封率随着磷胆比增加而逐渐减小。
由图2(c)可知,生理盐水体积对脂质体的包封率影响较大。生理盐水体积在5~10 mL范围内,包封率随着生理盐水体积增大而增高,生理盐水体积为10 mL时包封率最高,达58.67%。生理盐水体积在10~30 mL范围内,包封率随着生理盐水体积增加而逐渐减小。
由图2(d)可知,超声时间对脂质体的包封率影响较小。青蒿素纳米脂质体包封率呈微小的上下波动趋势。
2.4 Box-Behnken响应面优化制备工艺
2.4.1 回归模型的建立
利用Design Expert 13.0软件建立Box-Behnken试验设计。对试验测得数据进行二次多元回归分析,得到A、B、C与Y的二次多项回归方程:Y=61.03+1.20A+4.80B-1.35C-0.54AB+0.43AC-0.715BC-5.90A2-11.20B2-14.30C2,R2=0.994 5,模型的变异系数为2.65%,表明本试验建立的模型精密度良好。失拟项F值为0.534 2,失拟项不显著,表明该回归方程拟合情况良好,见表3。
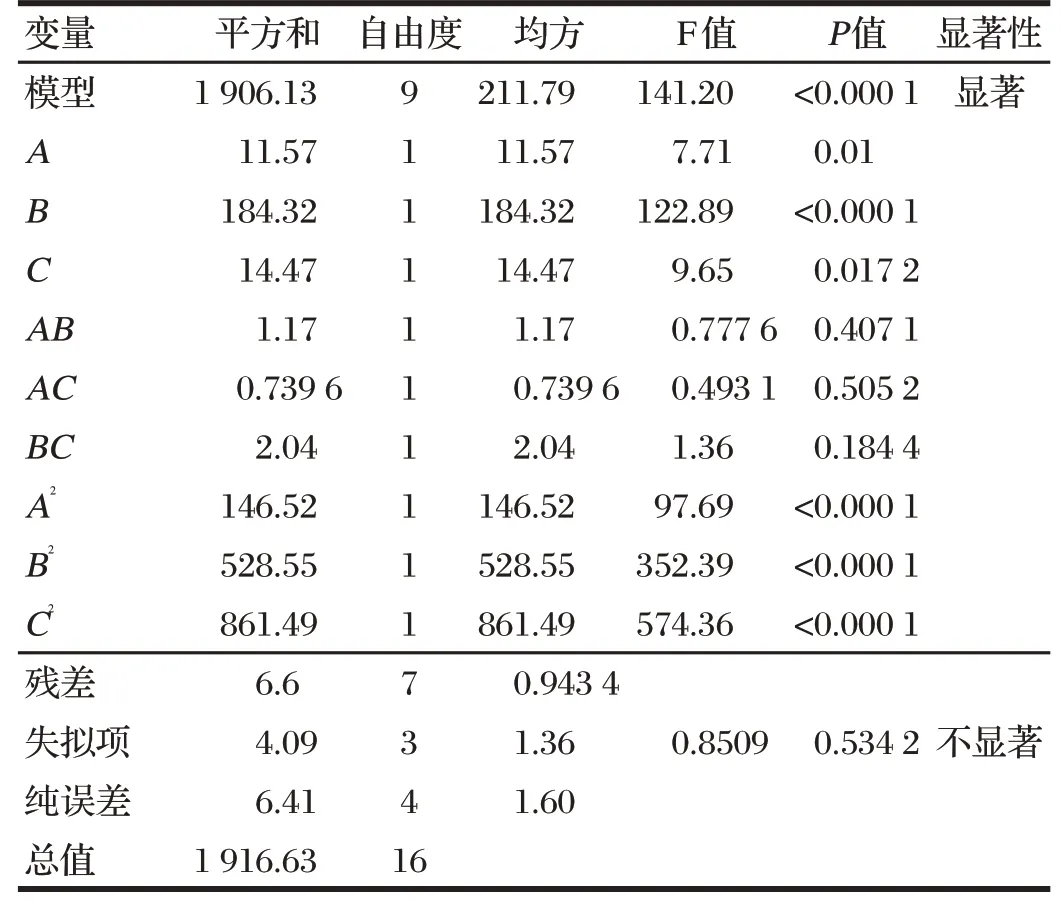
表3 青蒿素纳米脂质体响应面回归模型的方差分析Tab.3 Analysis of variance for regression model of artemisinin nanoliposomes
2.4.2 响应曲面分析与优化条件的确定
Box-Behnken试验设计方案及结果见表4。3种影响因素对于响应值的3D曲面图的影响结果见图3~图5。
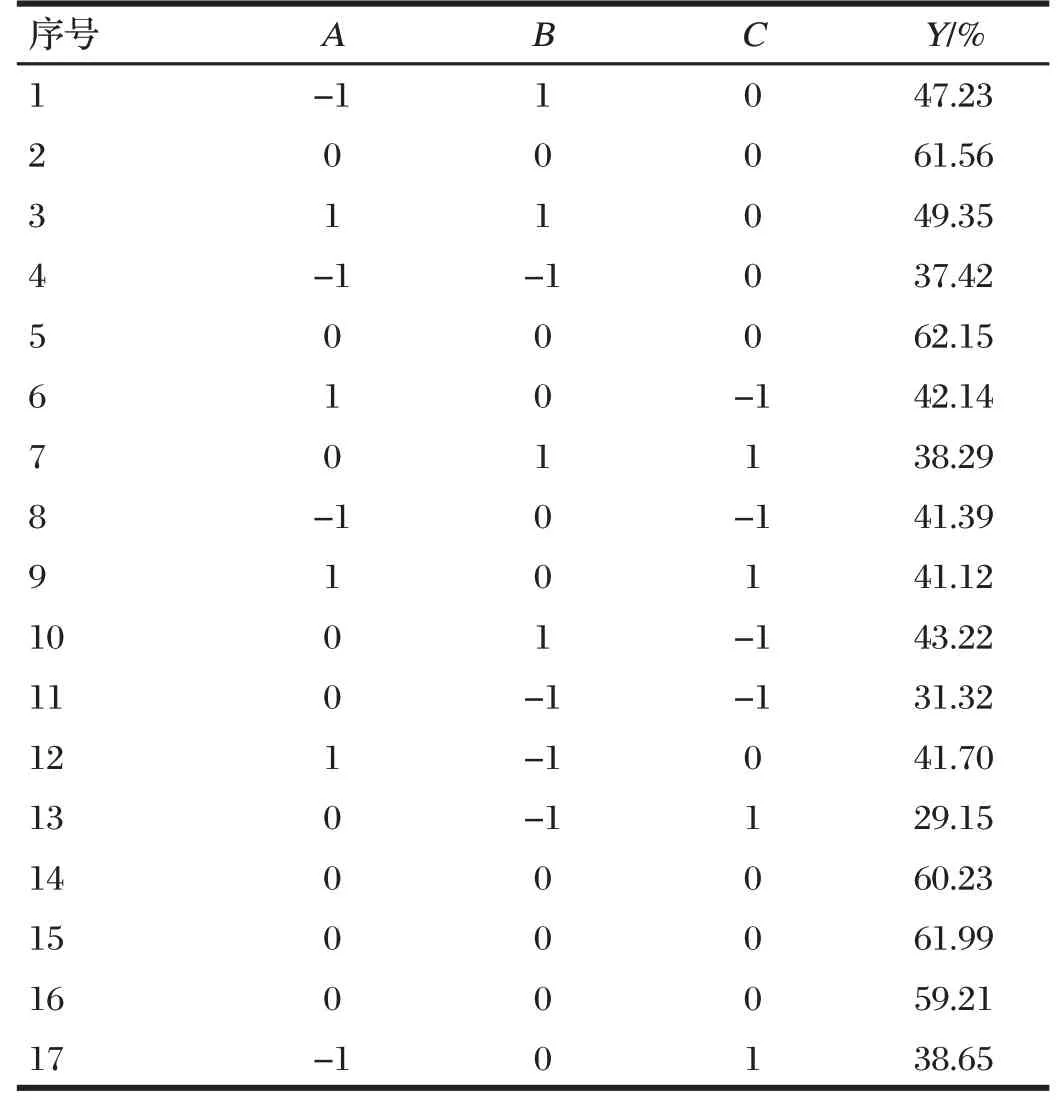
表4 Box-Behnken试验设计方案及结果Tab.4 Box-Behnken experimental design scheme and results
由图3~图5可知,包封率随着药脂比、磷胆比及生理盐水体积增大,均呈先增大后减小的趋势。得到最优制备工艺条件为药脂比为1∶14.53,磷胆比为5.42∶1,生理盐水体积为9.74 mL(此时磷脂质量为250 mg)。
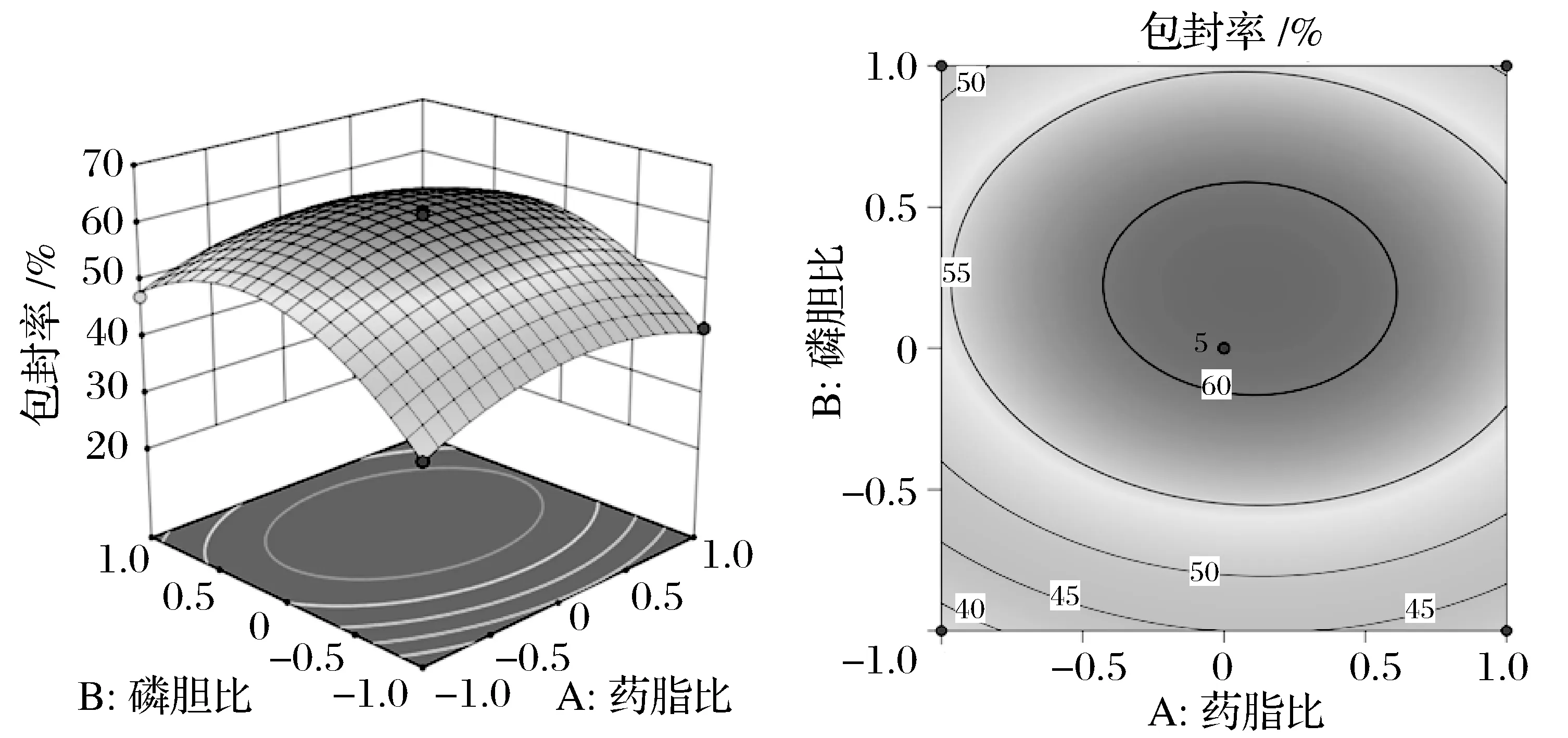
图3 药脂比和磷胆比对包封率的影响Fig.3 Effect of drug lipid ratio and phosphorus bile ratio on encapsulation efficiency

图5 磷胆比和生理盐水体积对包封率的影响Fig.5 Effect of phosphorus/bile ratio and normal saline volume on encapsulation efficiency

图4 药脂比和生理盐水体积对包封率的影响Fig.4 Effect of drug lipid ratio and normal saline volume on encapsulation efficiency
2.5 青蒿素纳米脂质体制备工艺验证试验结果(见表5)
由表5可知,最佳制备工艺条件下,3次重复制备的青蒿素纳米脂质体包封率平均值为68.57%,平均粒径为195.13 nm,PDI为0.19,Zeta电位为-12.10 mV。
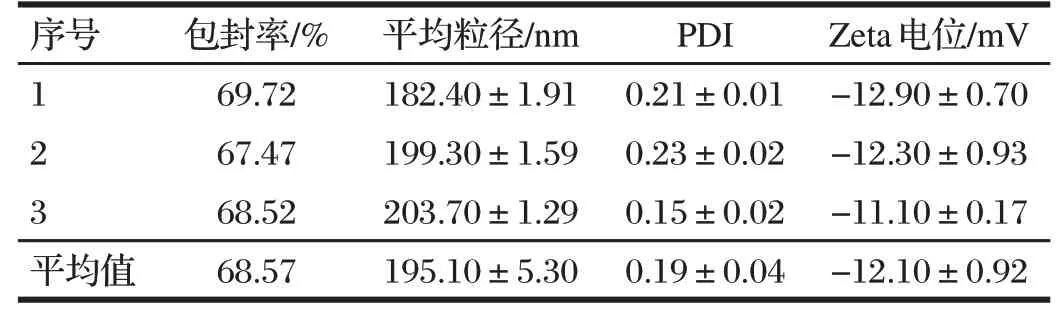
表5 青蒿素纳米脂质体制备工艺验证试验结果Tab.5 Validation test results of artemisinin nanoliposomes preparation process
2.6 青蒿素纳米脂质体形态学研究
透射电镜观察脂质体的形态,结果见图6。
由图6可知,制备的青蒿素纳米脂质体形态呈双层球形,且脂质体大小与马尔文粒径电位分析测定仪测定的结果一致。
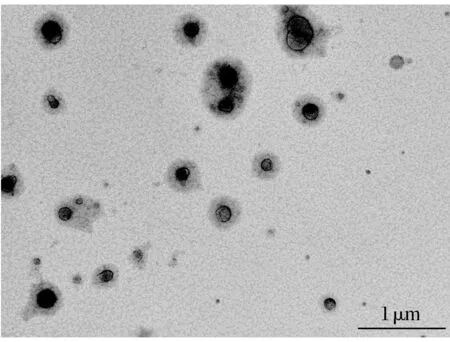
图6 青蒿素纳米脂质体透射电镜观察结果Fig.6 Transmission electron microscopic observation of artemisinin nanoliposomes
3 讨论
青蒿素的问世拯救了全球无数受疟疾折磨的生命[17],青蒿素的抗寄生虫和抗肿瘤作用是目前研究的两大热点[18-21]。但由于青蒿素具有溶解性和稳定性,限制了其发展。纳米脂质体技术可延长药物的半衰期,递送药物透过细胞膜进入细胞[22-23],为青蒿素的进一步发展提供了更多可能性。
青蒿素纳米脂质体制备工艺中使用最多的是薄膜分散法,关于不同制备方法对包封率的影响研究较少,大多数研究忽略了不同制备方法对包封率和粒径的影响[16,24-25]。许贤会[26]制备阿维菌素脂质体时联合薄膜分散法与冻融法,发现改良薄膜分散法的包封率为90.36%,薄膜分散法为86.51%。王虹雅[27]采用薄膜分散法、注入法、逆向蒸发法以及改良后的逆向蒸发-薄膜分散法制备头孢噻呋钠纳米脂质体,发现注入法的包封率最高(74.2%),但粒径比改良后的逆向蒸发-薄膜分散法大。
本试验通过比较常用的脂质体制备方法,并将传统乙醇注入法进行改良。在传统乙醇注入法的基础上,利用旋转蒸发仪和细胞破碎仪,结合超声法和乙醇注入法。试验结果表明,改良乙醇注入法制备的脂质体包封率较高、粒径较小。通过使用旋转蒸发仪将大部分有机溶剂快速蒸发,降低环境温度对注入法的影响,缩短制备时间,从而解决了传统乙醇注入法因长时间搅拌导致青蒿素析出的问题,提高包封率。
使用细胞破碎仪进行超声可进一步提高包封率,减小粒径和PDI。白先群等[28]利用旋转蒸发法制备青蒿琥脂纳米脂质体,其包封率为44.14%,经超声粉碎的脂质体包封率达到74.10%,表明超声法的融入能够有效提高脂质体包封率,与本试验结果一致。本研究进一步通过单因素试验和响应面法优化乙醇注入法制备青蒿素纳米脂质体工艺,优化工艺后制备的青蒿素纳米脂质体包封率达69.62%、粒径为167.50 nm。陆慧等[29]使用薄膜分散法制备青蒿素脂质体包封率大于43%,粒径为194 nm,本研究中改良乙醇注入法明显优于该试验使用的薄膜分散法。余荧蓝等[24]采用薄膜分散法制备青蒿素长循环脂质体粒径为113.3 nm,包封率为95.88%,分析其原因是该研究使用的磷脂纯度高达98%,磷脂纯度对脂质体的包封率影响较大,长循环修饰和高纯度磷脂提高了脂质体包封率,减小了脂质体平均粒径。彭盛峰[30]研究发现,磷脂中磷脂酰胆碱纯度与姜黄素在脂质体中包封率和热稳定性成正比,表明磷脂纯度是影响脂质体包封率的重要因素。本试验采用磷脂纯度为60%,后续研究将进一步提高大豆卵磷脂纯度以提高青蒿素脂质体包封率。
4 结论
本试验通过比较不同的脂质体制备方法,发现改良乙醇注入法明显优于薄膜分散法、逆向蒸发法和传统乙醇注入法。通过单因素试验和Box-Benhnken响应面优化得出青蒿素纳米脂质体制备的最佳工艺条件为青蒿素与磷脂的质量比1∶14.53,磷脂与胆固醇的质量比5.42∶1,生理盐水体积9.74 mL(此时磷脂质量为250 mg)。此条件下制备的青蒿素纳米脂质体形态呈双层球形,包封率68.57%,平均粒径为195.13 nm,PDI为0.19,Zeta电位为-12.10 mV。
本研究优化了青蒿素纳米脂质体制备工艺,可为青蒿素纳米脂质体在动物寄生虫疾病防控和宠物肿瘤治疗方面的研究提供参考。
——青蒿素

