负载卟啉镓化合物的水凝胶材料抗菌性能研究*
郭欣宇,吴 哲,马红艳
(天津科技大学 化工与材料学院,天津 300457)
0 引 言
生物膜是生物膜是粘附在固体表面的,由生物膜自身的细胞外基质包裹活菌细胞形成具有的膜状复合物[1]。据估计,每年有许多病人死于人工装置感染产生的并发症[2],也是手术失败的常见原因,如相关性尿路感染,关节假体感染等[3]。这是由植入部分的细菌粘附和生物膜形成导致的,细菌特别容易吸附在植入物表面[4],在植入物和组织界面上形成生物膜[5]。设备表面的生物膜很难根除[6],而且比浮游生物更牢固,不容易被抗生素所清除。目前预防生物材料感染的策略一般是用高浓度抗生素系统地治疗患者,而抗生素的过度使用,使得细菌的耐药性正在以惊人的速度增长[7]。L.M. Baddour等研究表明,传统的治疗效果十分有限[8],久而久之抗生素耐药性发展的风险大大增加。因此,由于这种感染导致的植入物切除甚至截肢越来越普遍。因此,开发两性离子水凝胶作为药物载体放置在植入生物材料与菌落细菌相互作用的界面作为一种治疗策略[9]。本文选择两性离子聚合物材料(聚羧基甜菜碱,pCB)和非离子材料(聚甲基丙烯酸羟乙酯,pHEMA)进行了研究。
硝酸镓(Ga(NO3)3)早就被美国食品药品监督管理局(FDA)批准用于治疗肿瘤病人高血钙病症[10]。人们于是将目光投向镓类抗菌剂的抗菌效果及抗菌持效性。在大多数病原体中,Fe3+对其生长和关键酶的功能至关重要[11]。由于Ga3+与Fe3+有很强的相似性,细菌可能会识别不出Ga3+与Fe3+的区别[12],从而破坏细菌的代谢过程,抑制细菌生长。而单一Ga3+的抗菌活性较低,需要与载体结合来提高其抗菌活性。本文利用Ga-CMP作为元素铁类似物,代替Fe3+与铁转运蛋白形成复合物并将其传递到细胞中,将竞争性地抑制和细菌中的铁代谢。
在常规给药方式中,药物浓度首先将达到峰值(爆发效应),然后下降,达到所需的短暂治疗剂量[13]。而控制给药方法旨在一定时间内将全身药物浓度保持在所需的治疗范围内,其中爆发效应可以忽略不计[14]。在这里,将开发一种模型水凝胶,它将持续释放Ga配合物,这种负载聚合物系统可以开发成全新的植入物(敷料、导管、分流器、组织工程支架)[15],或作为应用于现有留置设备的外部涂层[16]。
1 实 验
1.1 选用菌种
表1为主要菌种。

表1 主要菌种Table 1 The main species
1.2 实验仪器设备
AL204型精密电子天平,赛多利科学仪器(北京)有限公司;FE20型实验室pH 计,梅特勒-托利多仪器(上海)有限公司;78HW-1型数显恒温磁力搅拌器,杭州仪表电机有限公司;QL-861型漩涡振荡器,海门市其林贝尔仪器制造有限公司;BSD-YX2400型立式双层恒温摇床,上海博迅医疗生物仪器股份有限公司;UV-1800型紫外可见分光光度计,岛津企业管理(中国)有限公司;SB-1200型超声波清洗机,宁波新芝生物科技股份有限公司;IMS-50型全自动雪花制冰机,常熟市学科电器有限公司;Scientz-IID超声波破碎仪,宁波新芝生物科技有限公司;伯腾Cytation1细胞成像多功能酶标仪,美国伯腾仪器有限公司;WPL-65BE 型电热恒温培养箱,天津市泰斯特仪器有限公司;SW-CJ-2FD 型双人单面净化工作台,苏州净化设备有限公司;YA28X-4T/10Ⅱ型高压蒸汽灭菌锅,宁波永兴医疗器械公司。
1.3 培养基与试剂
10%LB培养基(g·L-1):蛋白胨10,酵母浸粉5,氯化钠10,调节pH值至7.2±0.2;0.3%LB培养基(g/L):蛋白胨0.6,酵母浸粉0.3,氯化钠0.6,调节pH至7.2±0.2;固体培养基是在液体培养基搅拌溶解后再加入20 g的琼脂粉,其他步骤不变。PBS缓冲液(g/L):4.1562 Na2HPO4,0.5286 NaH2PO4,调节pH值至7.0。在使用前需121 ℃,20 min灭菌。
PAGE胶促凝剂,西格玛奥德里奇(上海)贸易有限公司;乙二醇,天津百伦斯生物技术有限公司;过硫酸铵,上海Acmec生物科技有限公司;焦亚硫酸钠,上海Acmec生物科技有限公司;N,N-亚甲基双丙烯酰胺,阿拉丁试剂(上海)有限公司;甲基丙烯酸羟乙酯,上海吉至生化科技有限公司;四乙二醇二甲基丙烯酸酯,上海贤鼎生物科技有限公司。
1.4 抗菌剂
阳离子改性卟啉镓(Ga-CMP),天津大学化工学院生物化工合成产物,紫红色粉末。在使用前需配置成溶液并用0.22 μm针头式过滤器过滤灭菌。
1.5 试验方法
1.5.1 两性离子水凝胶材料(pCB)的制备
准确称取两性离子水凝胶单体(CBMA)0.2000 g,交联剂(N,N-亚甲基双丙烯酰胺)0.0050 g,溶解于500 μL 0.1 mol/L PBS(pH=7.4)缓冲溶液中,备用。为防止其他水掺进单体溶液,需用封口膜完全包裹离心管,在超声波清洗仪超声冰浴30 min。之后加入5 mg的热引发剂(过硫酸铵)促进单体交联聚合,加快成胶速度。分别吸取25 μL 0.5 mg/mL和1 mg/mL Ga-CMP溶液置于单体溶液中,再加入10 μL PAGE胶促凝剂,混匀。由于添加促凝剂的作用,pCB溶液非常容易迅速交联成胶状固体,因此需要快速用移液枪将溶液液体转移至事先准备好的模具(100 mm×20 mm×1.0 mm)中进行聚合反应,用夹子夹好后并将模具置于烘箱37 ℃下,时间为20~30 min。
1.5.2 非离子水凝胶材料(pHEMA)的制备
分别吸取甲基丙烯酸羟乙酯(HEMA)328 μL,乙二醇100 μL,去离子水65 μL,四乙二醇二甲基丙烯酸酯(TEGDMA)15 μL,按照顺序加入到离心管中,作为单体溶液放置备用;准确称量过硫酸铵0.13125 g,焦亚硫酸钠0.04925 g,溶于656 μL去离子水中,并置于震荡仪上震荡至固体全部溶解,作为引发剂放置备用。
分别移取25 μL 0.5 mg/mL和1 mg/mL Ga-CMP溶液到单体溶液中,上下复吸几次混合均匀;再吸取引发剂溶液74 μL置于单体溶液中,二者混匀后引发剂使单体聚合交联成胶状。置于冷冻高速离心机中。4 ℃,6000 r/min,2 min。待离心结束,快速将溶液用转移至事先准备好的聚四氟乙烯模具(100 mm×20 mm×1.0 mm)中,将模具用夹子夹稳后置于37 ℃烘箱,烘干时间为15~20 min。
1.5.3 最低抑菌浓度(MIC)
挑取三区划线培养的大肠杆菌(E.coli)与金黄色葡萄球菌(S.aureus)平板中的单菌落,接种在50 mL 10g/L的LB液体培养基中培养12 h。分别在5 mL 3% LB液体培养基中加入50 μL 105CFU/mL的菌悬液。经过预实验,在各个离心管中分别移取定量10 mg/L Ga-CMP溶液,使得S.aureus悬浮液中Ga-CMP溶液的终浓度为 0,1,2,3,4 μM;E.coli悬浮液中Ga-CMP溶液的终浓度为 0,5,6,7,8,9,10 μmol/L。分别做3组平行,放在37℃摇床内培养24小时后,分别用PBS缓冲液稀释105倍,取10 μL点样在10% LB固体培养基平板内,将平板放置在37 ℃培养箱中培养12 h,最后数出平板中细菌的个数并计算各个药物在相应浓度的抗菌率以及Ga-CMP的MIC。
1.5.4 载有Ga-CMP的水凝胶缓释载体模型
测定Ga-CMP释放研究中使用的所有水凝胶的干重。在假设药物均匀分布的情况下,计算每个圆形样本中的“净载药量”。为了确定每个样品的释放动力学,用打孔器将制备好的整张水凝胶打成直径为1 cm的圆形水凝胶,将达到吸水平衡的含有不同浓度Ga-CMP的1 cm的圆形水凝胶样品置于24孔板中,每孔1片,在每孔加入2 mL PBS 缓冲液浸泡,记为第1天,从第1天到第30天,吸取水凝胶的全部浸出液,并用相同量的PBS缓冲液替换。为了防止药物在光照下降解,每个孔板都用铝箔包裹。然后将孔板放在37 ℃,120 r/min的振荡器上培养。通过标准曲线法测试溶液在420 nm波长下的吸光度,从而对水凝胶样品浸出液中的卟啉镓进行精确定量,以获得水凝胶中包埋Ga-CMP的缓释数据。空白对照为不载有Ga-CMP的水凝胶。水凝胶缓释释放实验重复3次试验得到稳定的数据。药物缓释动力学的公式:
一段时间内累积释放的药物总量为:
(1)
式中:MACC(t):在任何时间t释放的累积药物总量;Vs:洗脱介质的体积;Cdrug(t):时间t时的药物浓度。
药物随时间的累计释放百分比为:
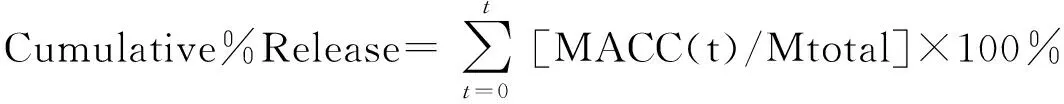
(2)
式中:Mtotal为每个样品中的药物总量。
1.5.5 载有Ga-CMP水凝胶的抗菌效果
(1)活化细菌:从已划好线的平板上挑取单菌落,接到10 g/L LB培养基中,在恒温摇床37℃培养12 h。将过夜培养后的细菌离心,去上清后,用PBS缓冲溶液重悬,稀释后保证细菌OD值为1.0,此时按照10%的接种比例接种到0.3 g/L LB培养基中。在恒温摇床培养6 h后,在24孔板中每孔加入2 mL。
(2)细菌和水凝胶共培养:将制备好的直径为1 cm的圆形水凝胶样品在紫外环境下灭菌15~20 min,期间隔一段时间翻面,使其完全灭菌。灭菌后在含有上述细菌的24孔板中每孔1片,做3组平行。为防止光照下降解,将孔板用锡纸包裹好。放在恒温摇床中培养,温度为37 ℃,转速设置为120 r/min。
(3)为了探究水凝胶表面上并没有生物膜存在,在8 h、12 h、24 h时,将水凝胶从孔板中取出置于加样槽中,并用灭菌的PBS缓冲液沿加样槽内壁缓缓洗涤两次,然后放入含有2 mL PBS的离心管中,用细胞破碎仪探针进行超声。超声后分别稀释105倍、104倍后在平板上进行点样,重复3次。静置培养24 h后,观察记录结果。
2 结果与讨论
2.1 最低抑菌浓度
图1(a)和图2(a)分别是Ga-CMP在不同浓度下对金黄色葡萄球菌和大肠杆菌的抑菌率变化曲线。由图1(a)所示,测得Ga-CMP对金黄色葡萄球菌的MIC为4 μm。Ga-CMP浓度范围在2~3 μm时,抗菌率变化最大,直至4 μm时抗菌率达到100%。图2(a)可以看出,Ga-CMP在添加浓度为10 μm时对大肠杆菌的抑菌率达到100%。图1(b)、图2(b)分别为对应的菌落生长情况,其中的数字代表添加的Ga-CMP的浓度。
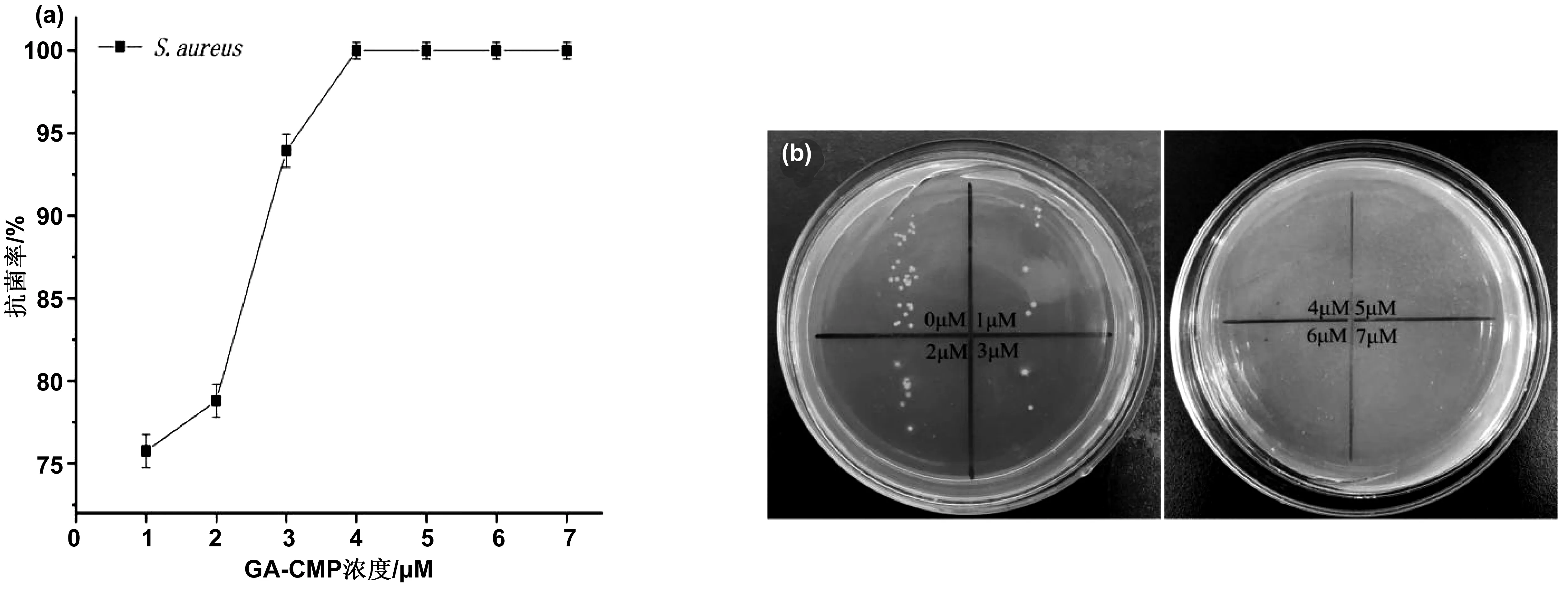
图1 金黄色葡萄球菌在添加不同浓度Ga-CMP下的抗菌曲线及菌落生长状况:(a)金黄色葡萄球菌的抗菌率曲线;(b)金黄色葡萄球菌的菌落生长状况Fig.1 Antibacterial curves of S. aureus with different concentrations of GA-CMP:(a)antibacterial rate curve of S. aureus;(b)Colony growth of S. aureus

图2 大肠杆菌在添加不同浓度Ga-CMP下的抗菌曲线及菌落生长状况:(a)大肠杆菌的抗菌率曲线;(b)大肠杆菌的菌落生长状况Fig.2 Antibacterial curves of E.coli with different concentrations of GA-CMP:(a)antibacterial rate curve of E.coli;(b)Colony growth of E.coli
以上结果说明,在实验浓度范围内,细菌的生长均会随着用药量的增加而受到更强的抑制和毒害。在实验中大肠杆菌和金黄色葡萄球菌分别为革兰氏阴性菌和革兰氏阳性菌具有代表性的细菌,Ga-CMP对金黄色葡萄球菌的最低抑菌浓度为4 μM,对大肠杆菌的最低抑菌浓度为10 μM,实现了广谱抗菌的目的。
2.2 Ga-CMP水凝胶缓释载体模型
2.2.1 Ga-CMP水凝胶的药物缓释释放
测定水凝胶中Ga-CMP的浓度是通过测定样品的吸光度获得的:使用已知浓度的溶液进行校准以获得在任何给定条件下确定浓度的最佳拟合方程吸光度,即之前所做的Ga-CMP的标准曲线。使药物的释放速率可以被量化。为了产生所需的缓释动力学,通过研究不同Ga-CMP含量对释放率的影响。Ga-CMP在pHEMA和pCB的含量为:0、250、500 μg/mL。使用式(2)计算Ga-CMP聚合物基质中的释放率。以时间为横坐标,药物释放速率为纵坐标做出图3。结果显示,包埋不同浓度Ga-CMP的水凝胶在1~30天的测试区间内能够持续释放卟啉镓,负载500 μg/mL的Ga-CMP-pCB样品具有最高的持续释放率,最大累积释放百分比为6.23%。不含Ga-CMP的基质均表现出Ga-CMP的释放速率明显缓慢。
如图3所示,1~3天0 μg/mL和250 μg/mL Ga-CMP-pHEMA的释放速率无显著性差异。3~10天中从250 μg/mL,500 μg/mL Ga-CMP-pHEMA水凝胶中累计释放速度明显加快,500 μg/mL Ga-CMP-pHEMA水凝胶释放的浓度达到13 μg/mL,已经超过所需的最小抑菌浓度,且释放百分比达到了2.12%,是最大积累释放量的39.3%。在10天之后,从0 μg/mL和250 μg/mL Ga-CMP-pHEMA水凝胶中累计释放的浓度较低,曲线呈平缓状。500 μg/mL Ga-CMP-pHEMA水凝胶中Ga-CMP的释放速率仍在逐渐增加。到第30天,从500 μg/mL水凝胶中总累计释放的Ga-CMP浓度达到396 μg/mL。
pCB在第1天的释放动力学与pHEMA没有显著差异。相比之下,pCB(500 μg/mL)在30天内释放了约96%的总载药量。图3中数据表明,在3~10天内3种水凝胶的释放速度都明显加快,这也与之前对缓释释放的规律研究所一致。10~30天中,Ga-CMP的含量越多释放的越快。到第30天时,500 μg/mL Ga-CMP-pCB水凝胶的释放量为30 μg/mL,总积累量达到了480 μg/mL,是pHEMA水凝胶总积累量的1.2倍。
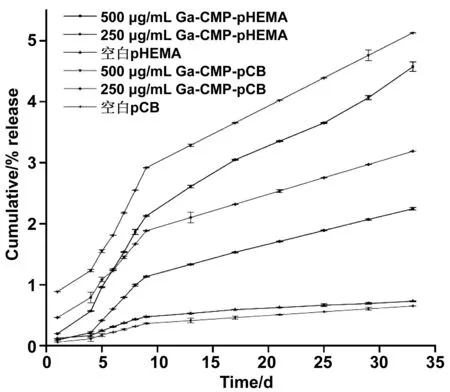
图3 载有Ga-CMP的不同水凝胶缓释释放曲线Fig.3 Sustained release curves of different hydrogels loaded with GA-CMP
这样恒定、缓慢、持续的药物释放方式抑制了细菌在液相中的悬浮生长,并且可长效利用。在基于生物材料释放的抗菌保护方面,聚合物中的镓复合物提供了优于常规抗生素的几个优点。首先,Ga-CMP的极低MIC值非常适合作为持续给药载体,以防止体内生物膜的形成,这降低了分配生物材料所需的释放速率[17]。第二,任何分配的生物材料最终都会到达使用寿命,这时大多数装载的药物会消失并且药物浓度下降到有效水平以下。相比之下,低于抑制浓度的常规抗生素不但不会影响浮游生物的生长,实际上会加剧生物膜的形成[18]。
2.2.2 载有Ga-CMP水凝胶的固相表面抗菌效果
在预实验中,两种水凝胶在液相中均显示出了很好的抗菌效果,为进一步探究两种水凝胶对表面生物膜的抗菌性能,分别在水凝胶形成后的8 h、12 h、24 h在水凝胶的表面进行抗菌实验。在点样时,将每个平板分成3部分,分别代表的是空白水凝胶、250 μg/mL Ga-CMP的水凝胶,500 μg/mL Ga-CMP的水凝胶;每部分的上面是稀释度为103倍,下面是稀释度为104倍。对于金黄色葡萄球菌,如图4(a)、(b)所示,在这3个时间点,空白pHEMA点样后形成的菌落数从6.0×106CFU/cm2降低至2.1×106CFU/cm2,变化差异并不明显。而250 μg/mL pHEMA-Ga-CMP在8 h和12 h显示出了与空白对照相似的结果,直到24 h从4.7×106CFU/cm2降低至0,将金黄色葡萄球菌完全抑制。500 μg/mL pHEMA-Ga-CMP在12 h显示出对金黄色葡萄球菌良好的抗菌性,从1.3×106CFU/cm2降低至0。
图4(c)、(d)为pHEMA对大肠杆菌的抑菌效果。在8 h时250 μg/mL pHEMA-Ga-CMP和500 μg/mL pHEMA-Ga-CMP对大肠杆菌就出现了较为明显的抑制性。由此可以说明,pHEMA-Ga-CMP对大肠杆菌的敏感性高于对金黄色葡萄球菌。
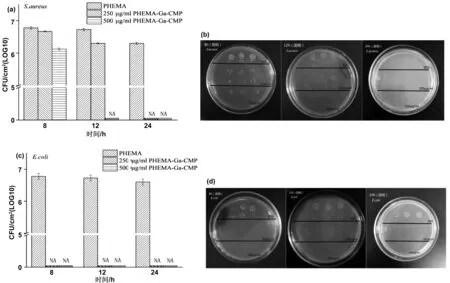
图4 不同pHEMA-Ga-CMP水凝胶表面对细菌的抗菌性能:(a)pHEMA-Ga-CMP对金黄色葡萄球菌的抗菌效果;(b)对应的菌落平板;(c)pHEMA-Ga-CMP对大肠杆菌的抗菌效果;(d)对应的菌落平板Fig.4 Antibacterial properties of different Phema-Ga-CMP hydrogels against bacteria:(a)antibacterial effect of Phema-Ga-CMP on S. aureus;(b)corresponding colony plate;(c)antibacterial effect of Phema-Ga-CMP on E. coli;(d)corresponding colony plate
图5(a)、(b)为pCB-Ga-CMP对金黄色葡萄球菌的抑菌效果,其中空白pCB与空白pHEMA结果相似。对于250 μg/mL pCB-Ga-CMP在8 h、12 h较空白pCB变化差异不大,24 h从6.1×106CFU/cm2降低至0。对于500 μg/mL pCB-Ga-CMP,在12 h较空白pCB从2.0×106CFU/cm2降低至6.6×105CFU/cm2,降低了1个数量级。在24 h较空白pCB显示出了对金黄色葡萄球菌完全的抑制。

图5 不同pCB-Ga-CMP水凝胶表面对细菌的抗菌性能:(a)pCB-Ga-CMP对金黄色葡萄球菌的抗菌效果;(b)对应的菌落平板;(c)pCB-Ga-CMP对大肠杆菌的抗菌效果;(d)对应的菌落平板Fig.5 Antibacterial properties of different PCB-Ga-CMP hydrogels against bacteria:(a)antibacterial effect of PCB-Ga-CMP on S. aureus;(b)corresponding colony plate;(c)antibacterial effect of PCB-Ga-CMP on E. coli;(d)corresponding colony plate
图5(c)、(d)为pCB-Ga-CMP对大肠杆菌的抑菌效果,与金黄色葡萄球菌相似,在8 h和12 h,250 μg/mL和500 μg/mL pCB-Ga-CMP较空白pCB变化差异不大,24 h时250 μg/mL pCB-Ga-CMP从6.0×106CFU/cm2降低至0;500 μg/mL pCB-Ga-CMP从2.0×106CFU/cm2降低至0,此时大肠杆菌完全被抑制。
并且开发这种以Ga-CMP作为抗菌剂加载,以实现连续的药物控释系统比传统的植入式药物传递装置具有一些优势。其一这种水凝胶可持续释放抗菌药物1个月。相比之下,传统抗生素封装的药物递送膜在一周内释放几乎100%的药物[19]。从膜中持续释放的药物并没有杀死浮游阶段的细菌,但确实阻止了它们在表面的定殖。第二,pHEMA聚合物和pCB均为无毒生物材料,前者被FDA批准用于制备隐形眼镜,而pCB为两性离子材料,具有良好的生物相容性。第三,细菌持续暴露在致死或亚致死剂量下会导致耐药菌株的增加,本文利用的Ga-CMP的发挥出镓抗菌机制,切断细菌输入铁的路径。
3 结 论
研究对阳离子改性卟啉镓(Ga-CMP)进行了最低抑菌浓度(MIC)的测定。成功制备了两性离子水凝胶(pCB)和非离子水凝胶材料(pHEMA),对其负载Ga-CMP药物后的释放能力和抗菌能力进行了考察。结果表明,Ga-CMP对金黄色葡萄球菌的MIC为4 μmol/L,对大肠杆菌的MIC为10 μmol/L。在持续30天内两种水凝胶材料都表现除了持续缓释释放,载有Ga-CMP的pCB材料释放与积累的百分比高于pHEMA,且释放量超过Ga-CMP的最低抑菌浓度。对于金黄色葡萄球菌,500 μg/mL pHEMA-Ga-CMP在12 h时的抑菌率可达到100%;而500 μg/mL pCB-Ga-CMP在24 h时的抑菌率为100%。对于大肠杆菌,500 μg/mL pHEMA-Ga-CMP在8 h时的抑菌率为100%;而500 μg/mL pCB-Ga-CMP在24 h时的抑菌率达到100%。因此可得出结论,负载Ga-CMP的两种水凝胶在24 h对两种细菌生物膜都有良好的清除效果。

