术前白蛋白与碱性磷酸酶比值对局限性阴茎癌术后复发的影响
宋 振,欧阳骏,周 奇,张卫杰,张江磊,张志昱
(苏州大学附属第一医院:1.泌尿外科;2.生殖中心,江苏苏州 215000)
阴茎癌是一种罕见的疾病,全球每年估计约26 000例阴茎癌病例,占男性新诊断癌症的不到1%,在我国的发病率约为0.6/10万[1-2]。大多数阴茎癌(95%)起源于腺体和包皮的鳞状细胞,是阴茎鳞状细胞癌。目前,阴茎部分切除术仍然是局限性阴茎鳞癌(T1~3N0M0)最常见的治疗方法。同时对于未触及腹股沟肿大淋巴结的患者由于淋巴结转移风险较高,均加做预防性腹股沟淋巴结清扫术[3]。然而,术后仍有患者不可避免地遭受局部或远处转移,致使预后急剧恶化[4]。因此,越来越多的研究人员注意寻找有效的术前和术后预测指标,以便更早地对预后较差的患者进行区分并在合理的临床周转时间内定制强化治疗策略。白蛋白与碱性磷酸酶比值(albumin-to-alkaline phosphatase ratio,AAPR)是一种新的血液生物标志物,最近已被证实与乳腺癌、肝细胞癌、肾癌和膀胱癌等肿瘤的预后相关[5-8],然而,目前尚鲜见与阴茎癌患者预后的相关性研究。因此,这项研究的目的是探讨AAPR与局限性阴茎癌患者术后发生复发的关系。
1 资料与方法
1.1 临床资料回顾性分析2012年1月1日-2017年1月1日在苏州大学附属第一医院接受治疗的93例局限性阴茎癌患者的临床资料,包括年龄、体质指数(body mass index,BMI)、AAPR、高血压及糖尿病病史、肿瘤直径、WHO/国际泌尿外科病理学学会(International Society of Urdogical Pathology,ISUP)病理分级、病理分期及术后是否复发等信息。根据术后随访的CT及胸部X线结果划分为复发组和非复发组。复发被定义为初次外科肿瘤治疗后复发,分为局部、区域或远处复发:阴茎原发肿瘤复发称为局部复发,腹股沟和/或盆腔淋巴结转移称为区域复发,远处淋巴转移或血行转移称为远处复发。阴茎癌患者的分期参照2017年美国癌症联合委员会(American joint com-mittee oncancer,AJCC)阴茎癌TNM分期,组织学分级参照2016年WHO/ISUP的三级分级系统。
1.2 纳入和排除标准纳入标准:①初治阴茎癌患者;②术前未接受新辅助放化疗;③术前体格检查及影像学检查(腹股沟B超及胸腹盆CT)排除远处转移;④行阴茎部分切除术和腹腔镜下双侧改良腹股沟淋巴结清扫术,术后病理确诊为阴茎鳞癌,且病理分期为T1~3N0M0;⑤有完整的临床病理特征和随访资料。排除标准:①患有艾滋病或合并其他肿瘤者;②患有炎症性疾病、肝病及血液系统疾病;③患者或家属拒绝参与该研究。
1.3 随访随访方案:前2年每3个月随访1次,第3~5年每年随访1次,以门诊、电话随访相结合。随访内容主要以视诊和体格检查为基础,结合CT扫描及胸部X线来鉴别是否有盆腔淋巴结转移和远处转移。随访从患者出院2周开始,终点为局部复发、区域复发及远处复发。随访截止时间为2022年3月1日。
2 结 果
2.1 术后复发组与无复发组的临床病理资料比较本次研究共纳入93例患者,19例发生术后复发,其中局部复发6例、区域复发5例、远处复发8例。患者年龄为29~91岁,平均(62.33±12.14)岁;BMI为16.56~38.16,平均24.22±3.54;肿瘤直径为5~80 mm,平均(30.84±15.85)mm;AAPR为0.24~1.07,平均0.57±0.16。随访时间3~117月,平均(41.99±31.02)月。另外高血压30例,糖尿病10例。根据局限性阴茎癌术后有无发生复发将患者分为复发组和无复发组。两组间年龄、BMI、高血压、糖尿病等方面无统计学差异(P>0.05),而AAPR(P=0.001)、WHO /ISUP病理分级(P=0.018)、病理分期(P=0.012)差异有统计学意义(表1)。
2.2 局限性阴茎癌术后发生复发的危险因素单因素分析结果显示,无糖尿病(P=0.044)、无高血压(P=0.043)、AAPR(P=0.002)、T3期(P=0.005)及WHO/ISUP3级(P=0.037)为影响患者术后复发的重要因素,而多因素Cox回归分析结果显示AAPR为术后复发的独立危险因素(P=0.041,表2)。
2.3 分层分析AARP在无进展间隔期的差异取AAPR的中值0.57划分为低AAPR组和高AAPR组,绘制的生存曲线见图1。Cox-rank检验结果(HR=0.32,P=0.028)表明AAPR的水平分组与是否发生复发成反向关系:即AAPR水平越低,术后复发越容易发生;而AAPR水平越高,则复发越延迟发生。
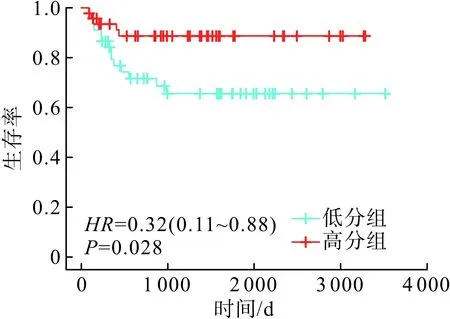
图1 低AAPR组和高AAPR组在无进展间隔期的比较

表1 非复发组与复发组的临床资料比较
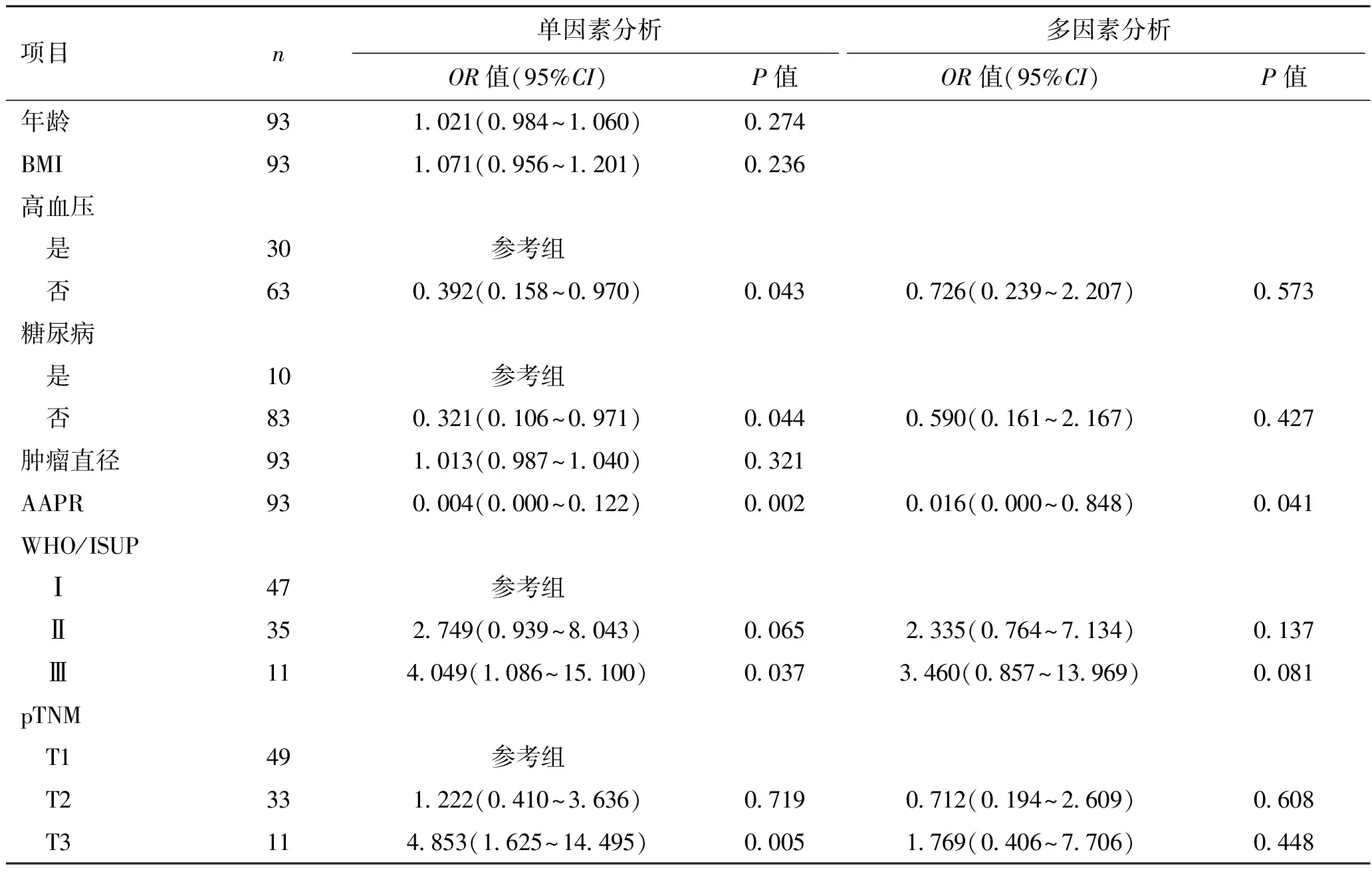
表2 Cox回归分析无进展间隔与临床病理学特征之间的关联
3 讨 论
阴茎癌确切的肿瘤发生机制尚不清楚,目前认为与包茎、慢性炎症、阴茎卫生差、吸烟、免疫抑制和感染人类乳头瘤病毒(human papitlomavirus,HPV)等高危因素有关[9]。阴茎癌多表现为皮肤异常或阴茎上无痛性可触及的病变,多数发生在龟头(35%~48%)或包皮内侧(13%~21%),少部分位于角化的阴茎干(2%)[10]。阴茎癌的初步诊断主要依赖于组织活检,并以此评估病变深度、血管是否受到侵犯及进行病理学分级。外科干预仍是目前治疗的主要方式。阴茎癌的预后与腹股沟淋巴结转移存在明确的相关性,因此预防性清扫是改善阴茎癌预后的重要手术方式[11]。临床上局限性阴茎癌患者约40%术后预后较好,5年总存活率达到90%,但仍有部分患者存在着复发和转移的风险,导致预后不良[4,12]。目前对局限性阴茎癌术后预后情况的研究较少见,也缺乏有效的术前预测指标指导术后治疗和随访。
研究发现,肿瘤细胞发生发展离不开促癌微环境,而人体自身炎症反应、较差的营养状况及免疫缺陷均是促癌微环境的主要诱因[13]。白蛋白是肝脏合成的特异性蛋白,参与全身炎症反应和自身免疫的调节,并对致癌物起到抗氧化作用[14]。作为一种常见的标志物,它已被证明与肝癌、食道癌、结肠癌等肿瘤的预后有关[15-18]。碱性磷酸酶是一种水解酶,具有抗炎作用,还与机体的营养状态有关[19]。其水平升高多与肝细胞癌、肾病和骨转移相关[20]。多项研究表明,碱性磷酸酶与食道癌、结直肠癌、鼻咽癌和肾癌的预后有关[7,21]。因此,AAPR作为白蛋白与碱性磷酸酶的比值,其降低往往预示着肿瘤更具侵略性,导致体液免疫反应和细胞免疫功能低下,术后复发转移概率相对较高,预后较差。
AAPR最早被发现是肝细胞癌术后无病生存期的独立预后指标[20]。近年来,AAPR被发现与肾癌、膀胱癌及尿路上皮癌等泌尿系统肿瘤的预后相关[6,22]。考虑到它对癌症预后的准确预测以及缺乏评估局限性阴茎癌患者预后作用的研究,我们进行了这项研究,并发现了与先前相似的结果。首先,通过对两组临床病理特征的分析,我们发现其与AAPR、WHO /ISUP病理分级、病理分期差异有关,而与年龄、BMI及高血压、糖尿病病史等方面无明显关联。然后,通过Cox单因素分析发现,糖尿病病史、高血压病史、AAPR低、T3期及WHO/ISUP3级可能为影响患者术后复发的重要因素,这与以往研究结果较为一致[23-24]。Cox回归分析结果仅显示AAPR为局限性阴茎癌术后复发的独立危险因素而不包括组织学分级,这可能与我们研究对象较少以及回顾性分析具有一定的偏倚所造成的。最后,绘制的生存曲线表明AAPR的水平分组与是否发生复发成反向关系:即AAPR越低,术后越容易复发。然而,AAPR与局限性阴茎癌术后复发的潜在机制尚不清楚,需要进一步的基础研究。
本研究的一些局限性:①本研究为单中心研究,存在选择偏倚,还需多中心大样本的进一步验证;②AAPR的预后价值有待于进一步的前瞻性研究进行评价。
综上所述,术前AAPR是局限性阴茎癌术后复发的独立危险因素,且与未发生复发时间相关,随着AAPR的升高,复发发生率下降,无进展生存时间延长。

