PBRM1缺失通过TNF-α/exosome信号轴促进肾癌细胞PD-L1分泌
谢宏俊,谷孝云,王 轲,简琰琳,李 磊,贺大林,徐 珊
(1.西安交通大学第一附属医院泌尿外科;2.环境和疾病相关基因教育部重点实验室肿瘤研究室;3.陕西省肿瘤精准医学重点实验室,陕西西安 710061;4.陕西省卫生健康信息中心,陕西西安 710002)
肾细胞癌(renal cell carcinoma,RCC),简称肾癌,是起源于泌尿小管上皮的肾实质恶性肿瘤。世界卫生组织2020年发布癌症数据,亚洲新增肾癌患者和死亡病例分别占36.9%和45.2%[1-2],我国近年来肾癌发病率以2%~4%的速度呈逐年上升趋势[3-4]。
PBRM1位于3p21染色体上,是肾透明细胞癌中的第2大突变基因[5]。VARELA等[6]证实PBRM1蛋白是SWI/SNF染色质重塑复合物蛋白之一,参与基因表达调控。在肾透明细胞癌中,PBRM1蛋白丢失与肿瘤的分级分期及患者生存期相关[7-8]。HAKIMI等[9]研究结论认为PBRM1突变(PBRM1突变主要导致PBRM1蛋白表达丢失)并不影响存活率。LIU等[10]临床研究报告显示,700多例PBRM1突变患者免疫治疗反应不良,但MIAO等[11]结合100例肾透明细胞癌患者RNA-seq和临床免疫治疗结果分析得出,PBRM1突变患者拥有较好的免疫临床治疗效果。PBRM1突变是否与免疫检查点抑制剂治疗响应相关,还有待进一步研究。
程序性死亡配体-1(programmed death-ligand1,PD-L1)是免疫治疗临床检测指标,虽然不是精准的检测指标,但临床免疫治疗获益的主要人群还是PD-L1高表达患者。本研究拟明确PBRM1和PD-L1在肾癌肿瘤组织中的表达相关性,探讨相关分子机制,为肾癌临床免疫治疗提供实验数据。
1 材料与方法
1.1 实验材料HK-2、786-O、Caki-1和769-P细胞系(美国典型培养物保藏中心);肾癌肿瘤组织芯片(上海芯超);胎牛血清(南美胎牛血清);RPMI1640培养基(Sigma公司);胰酶和PBS缓冲液(赛维尔);PBRM1单克隆抗体(Abcam 生物技术公司)、PD-L1单克隆抗体(Cell Signaling Technology)、β-actin单克隆抗体(爱必信上海生物科技)、CD9单克隆抗体(Cell Signaling Technology)、CD63多克隆抗体(上海Abcam 生物技术公司);exoEasy Maxi Kit,货号#76064。
1.2 方 法
1.2.1免疫组织化学染色的结果判定和分析方法
本研究中对90例肾透明细胞癌和90例配对癌旁组织进行免疫组化染色,PBRM1细胞核染色棕黄色为免疫组化染色阳性,细胞核着色数目百分比<25%时获得1分,25%~<50%之间获得2分,50%~<75%之间获得3分,75%~100%之间(包含75%)获得4分。细胞核着色强度执行标准为:0表示无染色,1表示弱阳性,2表示中度染色,3表示强阳性染色。
PD-L1免疫组化染色阳性判定:细胞质和细胞膜呈现棕黄色。使用3D扫描仪配套的分析软件对阳性深浅和多少进行打分。用组织化学评分(H-SCORE)处理免疫组化结果,将每张切片内阳性的细胞数量及其染色强度转化为相应的数值,达到对组织染色半定量的目的。H-SCORE=弱阳性细胞百分比×1+中阳性百分比×2+强阳性百分比×3。
1.2.2TCGA数据库数据提取、分析及富集分析
The Cancer Genome Atlas(TCGA,https://www.cancer.gov/tcga)数据库,对1 744例患者进行PBRM1基因突变数据分析。下载611例肾透明细胞癌患者的突变数据、转录组数据和临床数据,患者分为野生型PBRM1(PBRM1WT)和突变型PBRM1(PBRM1MT)两组。使用生存及survminer软件包进行两组患者生存分析。使用edgeR和clusterProfiler软件包进行基因集富集分析,明确肾癌患者PBRM1WT和PBRM1MT两组之间通路的改变。
1.2.3细胞培养 HK-2、786-O、Caki-1和769-P使用体积分数为10%的胎牛血清于RPMI 1640培养基培养,细胞置于37 ℃,体积分数为5% CO2培养箱内培养。
1.2.4外泌体提取和鉴定 收集细胞培养基,培养基经0.8 μm无菌滤器过滤,按照体积比1∶1添加XBP缓冲液。取16 mL样品混合物加入到exoEasy内置柱,500 g(离心力)离心1 min。丢弃废液,将内置柱重新放回收集管中。加入10 mL XWP缓冲液,5 000 g离心5 min,丢弃废液和收集管。将内置柱转移到新的无菌收集管中。加入400 μL Buffer XE,孵育1 min。500 g离心5 min,收集洗脱液。外泌体稀释1 000倍之后用Zeta view 仪器对浓度、大小以及粒径分布进行检测,用免疫印迹法检测外泌体生物标志物CD63和CD9的表达,并用透射电子显微镜对外泌体形态进行检测。
1.2.5免疫印迹 RIPA裂解液裂解细胞获取总蛋白[12],30 μg/孔上样,体积分数为12.5%的SDS-PAGE 90-120V电泳、110 V电压转膜,20 g/L脱脂牛奶室温封闭1 h。一抗PBRM1抗体(1∶1 000)、PD-L1抗体(1∶1 000)、β-actin抗体(1∶1 000)、CD9抗体(1∶1 000)、CD63抗体(1∶1 000)孵育,4 ℃过夜。TBST漂洗10 min,共3次。二抗辣根过氧化酶标记的羊抗兔(1∶1 000)或羊抗鼠(1∶1 000),室温孵育1 h。TBST漂洗10 min,共3次,配制赛默飞显色工作液,化学发光仪ChemiDoc XRS 显色系统扫描显色。
1.3 统计学分析实验结果经Graph Pad Prism软件,Student’sttext检验对两组间差异进行统计学分析,P<0.05为差异有统计学意义。
2 结 果
2.1 肾透明细胞癌组织PBRM1蛋白表达低于癌旁组织,与患者预后负相关90例(90例患者肾癌组织和对应癌旁组织)肾透明细胞癌组织芯片PBRM1免疫组织化学染色结果显示:PBRM1在细胞核表达(图1A)。与癌旁组织相比,患者肿瘤组织PBRM1蛋白表达显著低于癌旁组织(P<0.001),PBRM1表达缺失率在肿瘤组织中为76.4%。患者生存分析结果显示,PBRM1低表达患者总生存期短,但不具有统计学意义。对TCGA官网530例肾透明细胞癌患者(611例患者中剔除了差异性较大的患者数据)的RNA-seq数据进行分析,生存数据显示,PBRM1低表达肾透明细胞癌患者预后差,差异具有统计学意义(P<0.001,图1B)。
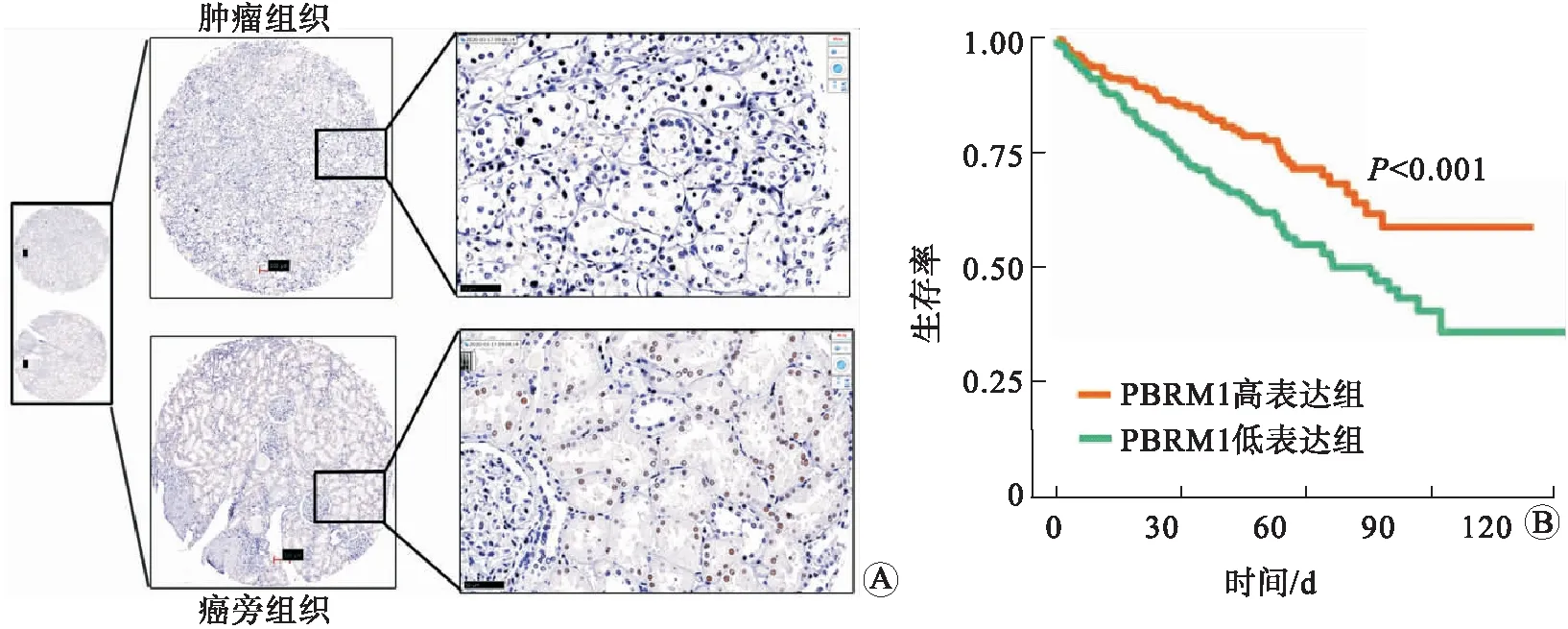
A:在肾透明细胞癌患者肿瘤组织和癌旁组织中PBRM1的表达代表图;B:TCGA数据库530例肾透明细胞癌患者的生存分析。
2.2 PD-L1在肾透明细胞癌中的病理学特征肾透明细胞癌组织芯片PD-L1免疫组织化学染色结果显示:PD-L1表达在肿瘤组织中显著升高(图2A、B,P=0.000 1),PD-L1在细胞膜和细胞质中均可见着色(图2A)。在IHC染色过程中10块组织块部分(或完全)丢失不能纳入进一步的数据分析之中,以免疫组化平均值为分隔值,分为PD-L1低表达组(28例)和高表达组(52例)。患者生存分析显示,PD-L1高表达组患者总生存期短,具有统计学差异(P=0.003 4,图2C)。
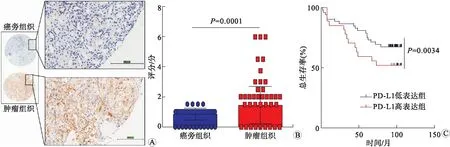
A:PD-L1在肾透明细胞癌患者肿瘤组织中的表达代表图;B:PD-L1在肾透明细胞癌患者癌旁组织和肿瘤组织表达;C:PD-L1表达高低对肾透明细胞癌患者总生存期的影响。
2.3 肾透明细胞癌PBRM1与PD-L1表达无相关性
对组织芯片中90例肾透明细胞癌患者PD-L1和PBRM1免疫组化染色评分相关性分析发现,PBRM1和PD-L1的蛋白表达无相关性。如图3A、B所示,以组织芯片编号F01A0200-B30-C1患者为例,PBRM1肿瘤组织染色无着色,PBRM1在癌旁组织着色清晰可见(图3A);同时PD-L1肿瘤组织有着色,而PD-L1在癌旁组织着色细胞较少(图3B)。
2.4 肾透明细胞癌PBRM1突变激活肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等炎症信号通路分析TCGA数据库中1 744例肾透明细胞癌患者突变数据和转录组数据,用以评估肾透明细胞癌患者组织中PBRM1基因的突变率,数据库分析结果显示:PBRM1 突变率高达33%(图4A)。GSEA hallmarks分析结果提示:肾透明细胞癌患者PBRM1突变后,肿瘤细胞炎症通路被激活,如:转化生长因子-β(transforming growth factor-β,TGF-β)信号通路和TNF-α-NF κB信号通路(图4B)。
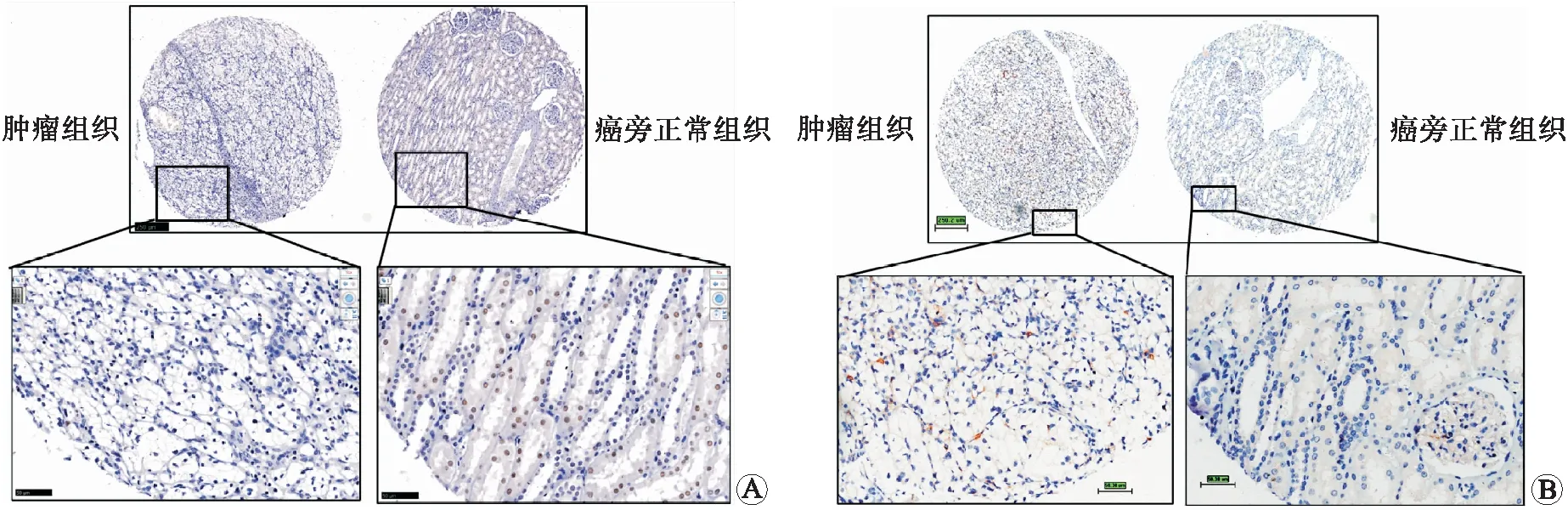
A:F01A0200-B30-C1肾透明细胞癌患者肿瘤组织和癌旁组织PBRM1免疫组化染色结果代表图;B:F01A0200-B30-C1肾透明细胞癌患者肿瘤组织和癌旁组织PD-L1免疫组化染色结果代表图。
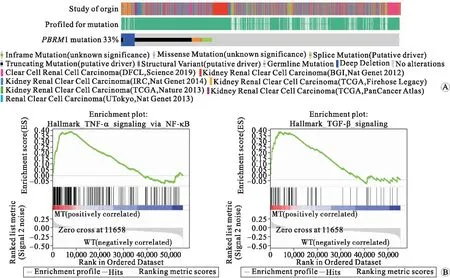
A:肾透明细胞癌患者PBRM1基因突变分析;B:肾透明细胞癌PBRM1突变患者激活肿瘤细胞炎症相关信号通路。
2.5 TNF-α诱导肾癌细胞外泌体包被PD-L1提取HK-2、786-O、Caki-1和769-P细胞培养基中的外泌体,免疫印迹均可检测到外泌体生物标志物CD63和CD9的表达(图5A)。透射电子显微镜可检测到786-O和769-P细胞培养基中外泌体的双层囊膜结构(图5B)。用纳米颗粒跟踪分析仪ZetaView对外泌体浓度和大小进行进一步鉴定,786-O和769-P细胞培养基外泌体平均直径分别为197 nm和210 nm,浓度分别为:1.9×1010个/mL和1.8×1010个/mL(图5C)。ZetaView仪器是单个粒子跟踪功能的激光散射视频显微镜,因视频结果无法展示,故对786-O和769-P细胞培养基外泌体检测结果视频截图进行展示(图5C)。免疫印迹实验结果发现,干扰素-γ(interferon-γ,IFN-γ)和TNF-α均可以诱导PD-L1蛋白表达升高(图5D)。在外泌体包载蛋白检测中,我们也发现外泌体PD-L1含量升高,其中TNF-α诱导PD-L1在外泌体中包载最多(图5D)。图5E免疫印迹结果显示,抑制剂GW4869可以阻断TNF-α诱导性的PD-L1外泌体分泌。
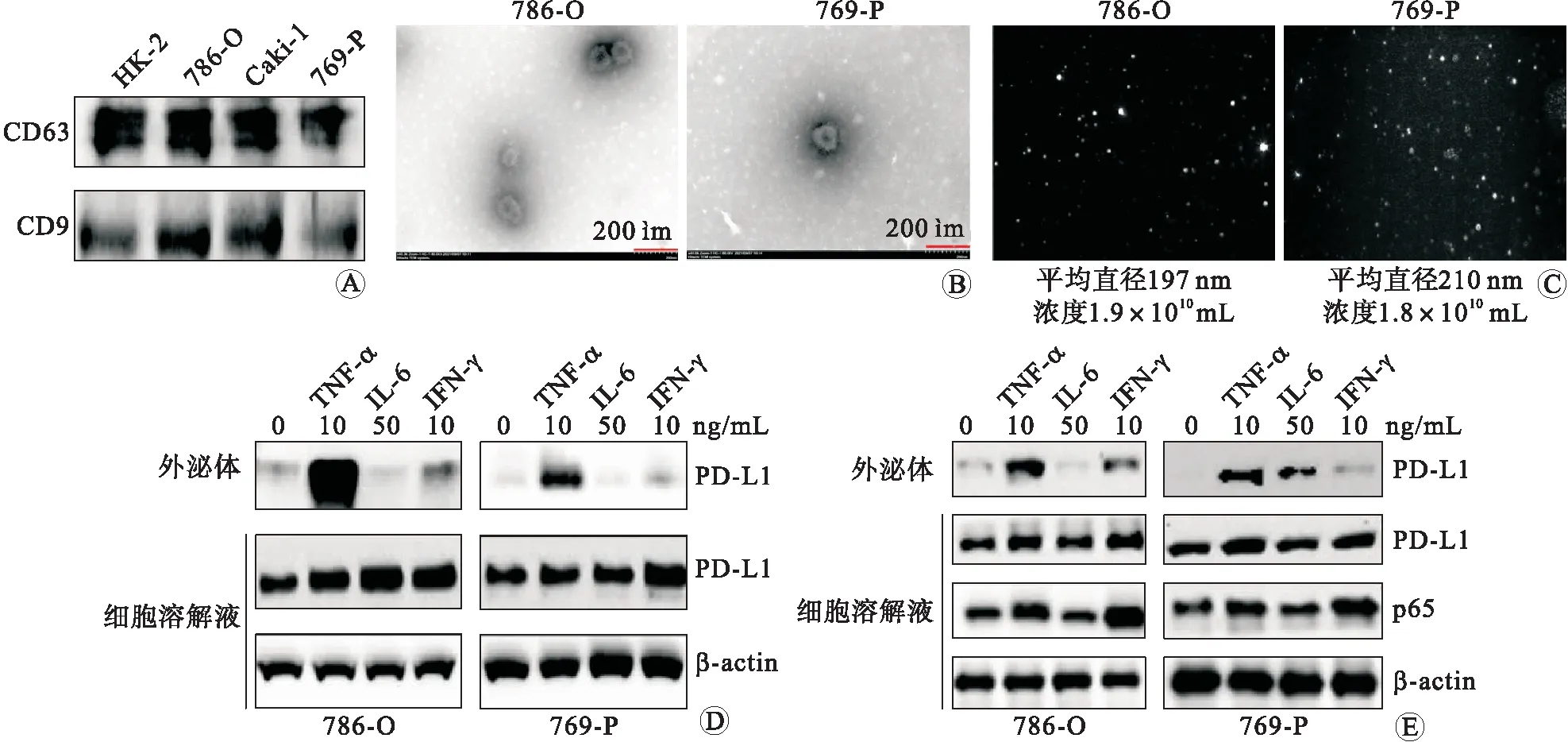
A:提取HK-2、786-O、Caki-1和769-P外泌体,免疫印迹检测CD9和CD63的表达;B:透射电子显微镜观察外泌体786-O和769-P的形态特征;C:786-O和769-P细胞外泌体浓度检测;D:786-O和769-P细胞外泌体和细胞总蛋白PD-L1检测;E:外泌体分泌抑制剂对PD-L1细胞外分泌的影响。TNF-α:肿瘤坏死因子;IL-6:白介素-6;IFN-γ:干扰素-γ。
3 讨 论
PD-L1表达是患者免疫治疗的必检项目[13],回顾PD-1/PD-L1药物的临床试验,几乎所有的PD-1/PD-L1药物的临床试验都纳入PD-L1表达检测[14]。黑色素瘤、尿路上皮癌和头颈鳞癌临床研究结果显示PD-L1表达与客观缓解率或生存时间呈正相关[15-16]。随着数据的不断积累,临床数据证实PD-L1并不是一个完美的标志物,主要存在2方面的缺陷:①在某些癌种中,PD-L1的表达与临床获益无关。肾细胞癌的二线治疗研究中,无论PD-L1表达是否大于1%都能从纳武单抗的治疗中获得中位总生存期的有效延长[17]。②在同一癌种中,PD-L1表达作为诊断标志物的预测性能仍然欠佳,主要表现为一部分PD-L1阴性的患者能够从PD-1/L1药物中获益,而另一部分PD-L1阳性患者却不能获益[18]。PD-L1表达与患者免疫治疗临床获益并不直接相关,为了明确矛盾产生的原因,我们分析PD-L1免疫检测技术发现,PD-L1表达检测存在4方面的技术缺陷:①不同的检测抗体,如帕姆单抗选择22C3,纳武单抗选择28-8;②不同药物/不同癌种对PD-L1纳入免疫治疗的阈值不一致;③染色系统不同,目前选择的全自动免疫组化系统分为Dako/罗氏两大厂家,使得染色系统难以达成一致;④除检测肿瘤细胞的PD-L1表达,肿瘤微环境中免疫细胞的PD-L1表达也与疗效相关[15,19-20]。以上研究报道提示:PD-L1表达虽然不能精准预测患者是否临床获益,但考虑其对免疫治疗疗效预测的重要性,为了达到疗效的精准预测,PD-L1表达结果最好与其他指标进行联合,才能提高癌症患者免疫治疗预测的精准性。
MIAO等[4]的研究结果显示:PBRM1突变后引起IL-6-JAK-STAT3、TNF-α和IFN-γ途径被激活,IFN-γ信号通路的上调增加了PD-L1表达,同时这些炎症信号通路激活会引起炎症因子表达,从而提高PBRM1突变肾透明细胞癌患者对PD-1/PD-L1免疫检查点抑制剂的临床响应[11]。我们的实验结果发现,PBRM1突变肾透明细胞癌患者生存期短,该结果也进一步在肾透明细胞癌组织芯片中得到验证。分析公共TCGA肾透明细胞癌数据库发现,PBRM1突变患者和野生型患者PD-L1 mRNA表达差异并无统计学意义。在90例肾透明细胞癌患者组织阵列样本中,IHC结果同样显示PBRM1阴性和阳性样本之间的PD-L1表达没有统计学差异。这些结果提示:PBRM1可能并非通过影响肿瘤细胞PD-L1表达而实现肾透明细胞癌患者免疫治疗临床响应率的改变。
但是,关于PBRM1突变后引起IL-6-JAK-STAT3、TNF-α和IFN-γ信号通路被激活,我们和MIAO等[4]的研究结果一致。我们在体外细胞系实验中证实IL-6、TNF-α和IFN-γ中TNF-α可显著增强PD-L1的表达,并且PD-L1被外泌体包载分泌到肿瘤细胞外。结果提示:PBRM1突变后导致患者肿瘤组织PBRM1蛋白染色缺失,并且在患者肿瘤组织中PBRM1与PD-L1表达无相关性,是因为PBRM1突变激活炎症因子信号通路,PD-L1表达上升,但被包载于外泌体中同时分泌到细胞外。与2018年《Naure》期刊报道在黑色素瘤患者外周血外泌体中检测到PD-L1的结果一致[21]。综上所述,PBRM1基因突变可作为肾癌患者临床免疫治疗的检测参考指标,但PBRM1影响免疫治疗的分子机制还不明晰,有待进一步深入研究。

