基于UPLC-Q-Orbitrap MS/MS技术研究膝痹宁对KOA模型大鼠的软骨保护效应
张力,刘子修,廖太阳,吴鹏,李晓辰,梅伟,茆军,王培民,张立
(南京中医药大学附属医院,江苏 南京 210029)
膝骨关节炎(Knee osteoarthritis,KOA)是累及膝关节所有构成组织的退行性破坏,以滑膜炎症、软骨降解、软骨下骨的结构破坏为主要病理特征,祖国医学称之为“骨痹”[1-2]。在长期的临床实践中,本课题组初步观察到以“温经活血”立法研发的中药复方膝痹宁(原名膝宁方,因申请专利更名膝痹宁,专利号:CN201010514325)对KOA有良好治疗效果,不仅能有效控制疼痛,也可缓解KOA关节僵硬、活动欠利、上下楼困难的临床症状[3-6],预示着膝痹宁可能对KOA存在软骨保护效应,但膝痹宁发挥疗效的药物活性成分及效应机制仍有待阐明。
代谢紊乱作为KOA高危风险因素之一,对KOA的发生发展具有多方面的影响,不仅体现在糖脂代谢异常诱发膝关节局部的慢性低度炎症[7],也体现在软骨组织自身的代谢平衡对KOA的病程进展至关重要[8-9]。研究表明,以基质金属蛋白酶(Matrix metalloproteinase,MMP)3、MMP13为代表的胶原水解酶,负责软骨胶原合成与降解,动态维持软骨胶原平衡,对关节软骨有破坏作用[9];另一方面,过氧化物酶体增殖物激活受体(Peroxisome proliferator-activated receptor-gamma,PPARγ)、PPARγ共激活因子(PPARγ coactivator-1α,PGC1α)调控能量代谢、脂肪酸代谢、脂质代谢,对KOA具有软骨保护效应[10]。据此,阐明KOA中的代谢紊乱对病理机制的解析、药效靶点的筛选,均具有重要意义。
超高效液相色谱-四极杆-静电场轨道阱串联质谱(Ultra-performance liquid chromatography-quadrupole-orbitrap mass spectrometry,UPLC-Q-Orbitrap MS/MS) 融合了四级杆质量分析器的母离子选择性和轨道阱质量分析器的精确质量检测功能,对于中药复杂体系的快速分析和成分识别以及代谢组学的研究具有优势[11-12]。立足于此,本研究运用该技术,不仅对膝痹宁的活性成分展开鉴定,还检测了实验动物的血清代谢物,通过差异代谢物的比较,筛选KOA的代谢标志物和膝痹宁的作用靶点,初步探讨了膝痹宁对KOA模型大鼠软骨保护效应的作用机制,为中医药治疗KOA 的机制研究提供新思路。
1 材料与方法
1.1 实验动物
选取3月龄SPF级雌性SD大鼠18只,体质量240~280 g(南京市青龙山动物繁殖场)。动物分笼饲养,自由进食饮水。动物房保持室温(25±2) ℃,相对湿度(60±5)%,12 h光/暗方案。动物实验规程经南京中医药大学实验动物伦理委员会批准(ACU210101),在国家卫生研究所关于保护和使用实验动物的指导方针下进行。
1.2 试剂与仪器
MMP3、MMP13、PPARγ、GAPDH抗体(货号:17873-1-AP、18165-1-AP、15540-1-AP、60004-1-Ig,美国Proteintech公司),PGC1α抗体(货号:AF5395,美国Affinity公司),RNA快速提取试剂盒(货号:RN001,上海奕杉生物科技有限公司),逆转录及PCR试剂(货号:R222-01、Q331-02,南京诺唯赞生物公司)。
BioPhotometer plus核酸蛋白检测仪、逆转录PCR仪(德国Eppendorf公司),7500实时荧光定量PCR仪(美国Applied Biosystems公司),UltiMate 3000超高效液相色谱串联Thermo Q FOCUS Orbitrap质谱仪,配备有加热电喷雾离子源、高压二元泵、自动进样器、在线脱气机、X Calibur 2.0软件(美国Thermo Fisher Scientific公司),KQ-300 GDV 温控超声仪(中国昆山超声仪器有限公司)。
1.3 实验方法
1.3.1 膝痹宁药液的制备 依据膝痹宁临床使用剂量[3](每日1帖):淡附片10 g,制狗脊10 g,紫河车10 g,山萸肉10 g,川桂枝10 g,巴戟天10 g,生薏仁15 g,制首乌15 g,川牛膝10 g,生甘草10 g,炒白芍10 g,由南京中医药大学附属医院制剂部提供,加水400 mL后武火煎煮沸腾,以文火浓缩药液至100 mL,则每1 mL相当于含生药1.2 g。
用于动物实验的药液根据大鼠与成人每千克体质量折算系数1∶6.25,旋蒸仪浓缩药液,冰箱4 ℃ 保存备用。用于活性成分鉴定的药液则进一步冷冻干燥制备冻干粉,称取膝痹宁冻干粉0.2 g,锥形瓶中加入甲醇25 mL后称定质量,超声(功率250 W,频率50 kHz)处理30 min,再次称定质量并用甲醇补足损失质量,随后0.22 μm过滤后上机检测。
1.3.2 活性成分鉴定的色谱和质谱条件 色谱柱为Waters ACQUITY UPLC HSS T3(2.1 mm×100 mm, 1.8 μm);流动相A为0.1%甲酸水溶液,流动相B为乙腈;洗脱梯度:0~3 min,5%~35%B;3~6 min,35%~55%B;6~8 min,55%~75%B;8~11.5 min,75%~95%B;11.5~12 min,95%~5%B;流速0.5 mL·min-1;柱温40 ℃;进样量3 μL。
质谱采用加热电喷雾离子源,正、负离子模式检测,鞘气流速45 L·min-1,辅气流速10 L·min-1,喷雾电压分别为3.5、2.5 kV,毛细管温度325 ℃。扫描模式为Full MS/dd-MS2,扫描范围m/z81~1 000,碰撞能量20、40、60 eV。
1.3.3 实验动物分组、造模、干预及取材 由SPSS软件生成随机数,随机均分为空白组、KOA(模型)组、膝痹宁组,每组6只。
动物适应性饲养1周,取KOA组、膝痹宁组共12只大鼠,3%戊巴比妥钠腹腔注射麻醉,双侧膝关节备皮,常规75%乙醇消毒。采用前交叉韧带离断术构建KOA模型,纵向切口开放膝关节腔,髌骨脱位后手术刀离断前交叉韧带,前抽屉试验检验手术结果,逐层缝合。术后青霉素钠连续注射3 d预防感染。空白组仅切开皮肤而不开放膝关节腔,形成假手术对照。
造模14 d后,膝痹宁组大鼠每日按照10 mL·kg-1剂量予膝痹宁药液灌胃治疗,空白组和KOA组予等量生理盐水灌胃,每日1次,连续8周。8周后麻醉状态下腹主动脉采血,4 ℃、3 000 r·min-1离心15 min后,取上层血清,-80 ℃冻存备用;脱颈法处死大鼠,开放膝关节腔,摘取软骨组织,保存于4%多聚甲醛溶液或-80 ℃超低温冰箱。
1.3.4 血清样本的处理及代谢组学检测的色谱质谱条件 从解冻离心后的大鼠血清样本各取30 μL,转移置放在冰上的EP管。随后加入200 μL含2×10-6%氯丙苯氨酸的乙腈-甲醇混合溶液(1∶1,v/v)。涡旋震荡10 s,超声5 min,-20 ℃静置30 min,随后14 000 r·min-1离心10 min,取上清液100 μL加入检测瓶中,待测。另从每个待测样本各取20 μL混合成QC样本,用于质控。
代谢组学检测中,色谱柱为Waters ACQUITY UPLC HSS T3(2.1 mm×100 mm,1.8 μm);流动相A为0.1%甲酸水溶液,流动相B为0.1%甲酸乙腈溶液;洗脱梯度:0~1 min,2%B;1~8 min,2%~50%B;8~11 min,50%~98%B;11~12 min,98%B;12~15 min,98%~2%B;流速0.25 L·min-1;柱温40 ℃;进样量2 μL。
质谱条件同活性成分鉴定部分。
1.3.5 番红O-固绿染色 常规石蜡包埋、切片、梯度脱水,根据番红O-固绿软骨染色试剂盒染色说明书,染色后观察摄片。
1.3.6 qPCR检测软骨组织MMP3、MMP13、PPARγ和PGC1α mRNA表达水平 RNA提取试剂盒在无RNA酶环境下提取组织总RNA,分光光度计测定RNA浓度后计算逆转录体系。混匀离心后PCR仪扩增。检索GenBank中相应的基因序列,采用Oligo v6.6软件设计引物,上海生物工程技术服务有限公司帮助合成。目的基因序列见表1。

表1 目的基因序列Table 1 Target gene sequence
1.3.7 Western blot法检测软骨组织MMP3、MMP13、PPARγ和PGC1α的蛋白表达水平 组织称质量后匀浆,BCA试剂盒测定蛋白浓度并绘制标准曲线,蛋白煮沸变性后加样电泳,湿转法转印至PVDF膜。5%脱脂奶粉室温封闭,1∶1 000加入一抗,4 ℃摇床孵育过夜。次日洗膜后,1∶10 000加入二抗室温孵育,显色液曝光。结果根据GAPDH内参半定量计算。

2 结果
2.1 膝痹宁的活性成分鉴定
采用UPLC-Q-Orbitrap-MS对膝痹宁的活性成分进行鉴定,采集正、负离子模式下的总离子流图(图1)。通过分析离子峰、碎片离子信息,结合文献报道[13-17],共鉴别出56个活性成分,其中有机酸11种、生物碱9种、糖类6种、中长链脂肪酸7种、芳香族化合物5种,包括蒽醌、黄酮、维生素类的其他活性成分18种。详见表2。

图1 膝痹宁药液的总离子流图Fig.1 Total ion current diagram of Xibining

表2 膝痹宁的活性成分Table 2 The active ingredient of Xibining

(续表)
2.2 膝痹宁对KOA模型大鼠的软骨保护作用
观察HE切片发现,空白组大鼠软骨组织结构正常,表面完整,软骨细胞从浅层至深层数量增多;KOA模型大鼠软骨组织表面区域部分缺损,浅层软骨细胞丢失,纤维化明显;膝痹宁组软骨组织表面也存在部分区域缺损,但浅表区域软骨细胞尚有保存,纤维化程度较KOA组明显降低(图2)。番红O-固绿染色结果显示,KOA组软骨面缺损明显,钙化明显,膝痹宁组也存在软骨缺损和钙化,但程度明显较KOA组减轻(图2)。
软骨组织中MMP3、MMP13的mRNA和蛋白表达水平在KOA组均较空白组升高,差异具有统计学意义(P<0.01),而膝痹宁组则较KOA组降低(P<0.05,P<0.01),见图3。此外,KOA大鼠软骨组织中PPARγ、PGC1α的mRNA和蛋白表达均低于空白组,差异具有统计学意义(P<0.01),膝痹宁能升高PPARγ、PGC1α的表达水平(P<0.05,P<0.01),见图4。说明膝痹宁对KOA大鼠的软骨代谢存在干预作用。

图2 各组大鼠软骨组织代表性HE染色、番红O-固绿染色Fig.2 The representative HE and Safranin O-Fast Green staining on cartilage tissue of each group

注:A. MMP3、MMP13的相对mRNA表达;B. MMP3、MMP13的代表性蛋白条带;C. MMP3、MMP13的相对蛋白表达;与空白组比较,**P<0.01;与KOA组比较,图3 各组大鼠软骨组织MMP3、MMP13 mRNA和蛋白相对表达水平比较Fig.3 The relative expression levels of MMP3 and MMP13 in cartilage of rats in each group
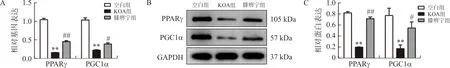
注:A. PPARγ、PGC1α的相对mRNA表达;B. PPARγ、PGC1α的代表性蛋白条带;C. PPARγ、PGC1α的相对蛋白表达;与空白组比较,**P<0.01;与KOA组比较,图4 各组大鼠软骨组织PPARγ、PGC1α mRNA和蛋白相对表达水平比较Fig.4 The relative expression levels of PPARγ and PGC1α in cartilage of rats in each group
2.3 膝痹宁对KOA模型大鼠的血清代谢组学影响
代表性大鼠血清色谱图如图5所示。将MS-DIAL 处理后得到的代谢物数据集导入Metaboanalyst进行主成分分析(PCA),结果见图6。
空白组和KOA组能明显区分,提示KOA模型大鼠的血清与空白大鼠代谢表型有一定区分。OPLS-DA得分图显示空白组和KOA组可以明显区分,Permutation test置换检验显示模型准确性较好(图7)。
进一步根据Fold Change>1.2、P<0.05筛选空白组和KOA组的差异代谢物,筛选后得到显著差异的代谢物23个。其中,KOA组较空白组明显下调的代谢物15个,包括左旋肉碱、甘油醛、谷氨酸、氨基颉草酸、脯氨酸、甘油酸、亮氨酸、异亮氨酸、鸟嘌呤、蛋氨酸、乙酰胆碱、天冬酰胺、酪氨酸、鸟氨酸、苏氨酸;上调的代谢物有8个,包括延胡索酸、半乳糖、色氨酸、丙氨酸、甲基烟酰氨、甘氨酸、缬氨酸、硬脂酸。将膝痹宁组按同样的条件纳入分析,并对比KOA组较空白组出现的差异代谢物进行筛选,膝痹宁通过上调左旋肉碱、谷氨酸、脯氨酸、亮氨酸、异亮氨酸等8种代谢物,下调半乳糖、缬氨酸、色氨酸、甲基烟酰胺、硬脂酸,发挥药效作用(表3)。

图5 代表性大鼠血清色谱图Fig.5 The representative chromatogram of rat serum
此外,将膝痹宁干预的代谢物导入Metaboanalyst进行富集分析和通路分析,代谢差异物主要富集于支链脂肪酸的氧化、脂肪酸代谢、长链脂肪酸β氧化(图8),涉及嘌呤代谢,缬氨酸、亮氨酸和异亮氨酸降解、合成,氨酰-tRNA 生物合成,甘油磷脂、甘油酯代谢等代谢通路(表4、图9)。

注:K.KOA组;N.空白组;XBN.膝痹宁组;QC.质控样本图6 各组大鼠血清的PCA分析Fig.6 PCA analysis of serum in each group

注:K.KOA组;N.空白组图7 OPLS-DA得分图和Permutation test置换检验Fig.7 OPLS-DA score map and Permutation test

表3 膝痹宁对大鼠血清代谢差异物的调节作用Table 3 Regulation of Xibining on serum metabolic differences in rats

图8 代谢差异物的富集分析Fig.8 Enrichment analysis of metabolic difference

注:A.烟酸盐和烟酰胺代谢;B.甘油酯代谢;C.乙醛酸和二羧酸的代谢;D.甘氨酸、丝氨酸和苏氨酸代谢、磷酸戊糖途径;E.甘油磷脂代谢;F.氨酰-tRNA 生物合成;G.缬氨酸、亮氨酸和异亮氨酸降解、合成;H.嘌呤代谢图9 代谢通路分析Fig.9 Metabolic pathway analysis

表4 代谢通路分析Table 4 Metabolic pathway analysis
3 讨论
膝痹宁方取淡附片、桂枝为君,益肾助阳,宣痹散寒;以紫河车、山萸肉、巴戟天、制狗脊、制首乌为臣,补益肝肾,祛风除湿;生薏仁健脾益气;牛膝补肾活血,通利关节;佐以甘草缓急止痛,调和诸药,共奏补肝肾益气血,祛寒湿通经络之功。本研究中,我们采用UPLC-Q-Orbitrap-MS对膝痹宁的活性成分进行鉴定,共鉴别出56个活性成分。膝痹宁中含有的乌头酸、水杨酸、新乌宁碱、乌头碱等成分可能与KOA疼痛的临床控制有关[18];佛手柑内酯、肉桂醛、异欧前胡素、香草酸、大黄素等物质可能与膝痹宁缓解KOA滑膜炎症的疗效有关[19];而葫芦巴碱则具有纠正代谢紊乱的药效,提示膝痹宁对代谢因素的影响[20]。
随后,我们探讨了膝痹宁对大鼠的软骨保护效应及其对代谢核心靶点的干预作用。研究表明:膝痹宁干预后,KOA大鼠的软骨缺损和钙化程度减轻,MMP3、MMP13的mRNA和蛋白表达水平降低。此外,膝痹宁升高了KOA软骨代谢信号PPARγ、PGC1α的mRNA和蛋白表达,提示膝痹宁可能对KOA软骨代谢紊乱存在干预作用。大鼠血清代谢组学研究表明:KOA组较空白组明显下调的代谢物有15个,上调的有8个;膝痹宁可能通过上调左旋肉碱、脯氨酸、甘油酸、亮氨酸、异亮氨酸、苏氨酸等8种物质和下调半乳糖、缬氨酸、硬脂酸等5种物质,发挥药效作用。代谢差异物主要富集于支链脂肪酸的氧化、脂肪酸代谢、长链脂肪酸β氧化,涉及嘌呤代谢,缬氨酸、亮氨酸和异亮氨酸降解、合成,氨酰-tRNA 生物合成,甘油磷脂、甘油酯代谢等代谢通路。脯氨酸、羟脯氨酸、亮氨酸、半乳糖代谢对于Ⅱ型胶原的生物合成是至关重要的,参与胶原侧链的组成[21-23],因此,膝痹宁对KOA软骨中脯氨酸、亮氨酸及半乳糖代谢的调节作用,可能对其软骨保护效应的发挥至关重要。
本研究结果中膝痹宁对左旋肉碱的影响与Zhang等的研究相一致[24],我们通过对代谢差异物的筛选发现了肉碱在KOA大鼠模型中表达降低,而肉碱的补充治疗,在临床和动物实验中[25-27],均证实能够有效地缓解KOA滑膜炎症,保护软骨降解破坏,尽管其中的作用机制仍是未知的。膝痹宁能提高大鼠体内左旋肉碱的含量,增加的左旋肉碱可能作为脂肪酸β氧化的重要参与者,为KOA提供更多的能量,发挥软骨保护效应。
本研究也存在些许不足。首先,受限于实验动物规模,本研究中用于代谢组学检测的实验分组动物数量相对较少,进一步扩大样本量可望对KOA代谢差异物做出更全面的筛选;其次,本研究未涉及离体实验,设计相应的细胞实验可望进一步明确膝痹宁通过影响代谢因素体现KOA软骨保护效应的因果关系。此外, 新近的报道中,PPARγ对多个脂质代谢关键酶存在明确的调节作用,如脂肪酸转位酶、肉碱酰基转移酶。膝痹宁是否对上述关键酶具有干预作用,以及是否通过干预酶活性影响脂质代谢,均具有深入研究的价值。

