基于甜味受体整合中药“效味”和“滋味”探索玉竹甘味药性物质基础
李 婷,邓碧莲,欧阳征海,柳 婷,吴 璐,杨华生
江西中医药大学药学院,江西 南昌 330004
甘味又称“甜味”,是中药五味之一。中药的甘味可能是基于“效味”,也可能是基于“滋味”。因此,确定甘味药性物质基础,可基于“效味”,也可基于“滋味”。基于“效味”确定甘味药性物质,即中药含有的成分/部位具有“甘补、甘缓、甘和”3 种效应中的1 种,即可确定该成分为“甘味”药性物质;基于“滋味”确定甘味药性物质,即中药含有的成分/部位的“滋味”是“甜”的,即可确定该成分为“甘味”药性物质。可以预见,基于“效味”和“滋味”确定的甘味药性物质可能不同;换句话说,基于“效味”确定的甘味药性物质其滋味不一定“甜”,而基于“滋味”确定的甘味药性物质其效应不一定“补”。事实上,甘味只是大脑对客观物质的一种感觉。研究表明,甜味受体介导甘味感觉的形成,因此中药的甘味可能与甜味受体有关。甜味受体主要存在于味蕾细胞[1],葡萄糖、蔗糖等与之结合后,激活甜味信号通路,向中枢传递甜味感觉,是为“滋味”。研究还发现,甜味受体在消化系统中也有表达,虽不传递甜味感觉,但能促进胰高血糖素样肽-1(glucagon-like peptide-1,GLP-1)等胃肠激素的释放,发挥药理效应[2],是为“效味”。可见,甜味受体不仅与“滋味”有关,还与“效味”也有联系。因此,可基于甜味受体整合“效味”和“滋味”,即同时关注“效味”和“滋味”,探索中药的甘味药性物质基础。
玉竹是为百合科植物玉竹Polygonatum odoratum(Mill.) Druce 的干燥根茎,主要含有多糖、皂苷、黄酮等成分。玉竹属于典型的补阴药,主要用于治疗“阴虚”证。研究表明,阴虚可出现体质量下降、体温升高、少食、多饮、大便干结、皮肤干燥等症状[3];同时,针对阴虚“阳亢内热”“阴液亏损”的病机,现代也从Na+,K+-ATP 酶等能量代谢酶、调节水液代谢的水通道蛋白(aquaporins,AQPs)等方面来研究阴虚[4]。因此,本研究以玉竹为研究对象,首先采用阴虚动物模型,研究玉竹多糖、皂苷、黄酮对阴虚小鼠体质量、体温、摄食量、摄水量、粪便含水率、皮肤含水率及Na+,K+-ATP酶、Ca2+,Mg2+-ATP 酶活性和AQP1、AQP3mRNA表达量的影响,从“效味”的角度探索玉竹的甘味药性物质;再利用电子舌识别玉竹多糖、皂苷、黄酮的“滋味”,从“滋味”的角度探索玉竹的甘味药性物质;最后,选择基于“效味”和“滋味”相同的甘味药性物质,确定为玉竹甘味药性物质。在此基础上,采用整体动物考察确定的甘味药性物质对GLP-1 分泌的影响,分子对接考察确定的甘味药性物质与甜味受体的结合性,以此揭示效味、滋味与甜味受体的关联性。
1 仪器与材料
1.1 仪器
SmarTongue 型电子舌(上海瑞玢国际贸易有限公司);A100 PCR 基因扩增仪(杭州朗基科学仪器有限公司);Agilent 1260 型高效液相色谱仪(美国Agilent 公司);ELSD 6000 检测器(美国Alltech公司);全波长扫描式多功能读数仪(美国Thermo公司);核酸蛋白测定仪、伯乐PCR 仪(美国赛默飞公司);752 紫外可见分光光度计(上海欣茂仪器有限公司);红外额式体温计(昆山热映光电有限公司)。
1.2 试剂与药材
小鼠GLP-1 试剂盒(批号H2106Y28)购自上海恒远生物科技有限公司;Na+,K+-ATP 酶(批号20221208)、Ca2+,Mg2+-ATP 酶试剂盒(批号20221208)购自南京建成生物公司;总RNA 提取试剂盒(批号20220424)购自北京索莱宝科技有限公司;M5 First Strand cDNA Synthesis Kit(批号22CB2308)、2X M5 UltraSYBR Mixture(批号21HA0201)购自北京聚合美生物科技有限公司;无水葡萄糖(批号130407)、芦丁(批号wkq21020402)、重楼皂苷(批号wkq21031603)对照品均购自四川省维克奇生物科技有限公司,质量分数均为98%;葡萄糖(批号120926)、酒石酸(批号151008)购自西陇化工股份有限公司;氯化钾(批号20140108)购自天津市福晨化学试剂厂;谷氨酸钠(批号20210711)购自江西省祥橱实业有限公司;蔗糖(批号D1527058)购自上海阿拉丁生化科技股份有限公司;盐酸小檗碱片(批号2200127)购自东北制药集团沈阳第一制药有限公司;玉竹药材(批号200901)购自安徽道源堂中药饮片有限公司,附子(批号20180405)、肉桂(批号20180521)、干姜(批号20180301)药材购自江西吁江生态科技有限公司,甘草、党参、黄芪、黄连、黄芩、大黄、白芷、川芎、山楂、乌梅、山茱萸、芒硝、玄明粉等药材均购自南昌市北京同仁堂药店,经江西中医药大学付小梅教授鉴定,分别为百合科植物玉竹P.odoratum(Mill.) Druce 的干燥根茎、毛茛科植物乌头Aconitum carmichaeliiDebx.的干燥子根、樟科植物肉桂Cinnamomum cassiaPresl 的干燥树皮及姜科植物姜Zingiber officinaleRosc.的干燥根茎、豆科植物甘草Glycyrrhiza uralensisFisch.的干燥根茎、桔梗科植物党参Codonopsis pilosula(Franch.) Nannf.的干燥根茎、豆科植物黄芪Astragalus membranaceus(Fisch.)Bunge 的干燥根茎、毛茛科植物黄连Coptis chinensisFranch.的干燥根茎、唇形科植物黄芩Scutellaria baicalensisGeorgi的干燥根茎、蓼科植物大黄Rheum palmatumL.的干燥根茎、伞形科植物白芷Angelica dahurica(Fisch.ex Hoffm.) Benth.et Hook.f.的干燥根茎、伞形科植物川芎Ligusticum chuanxiongHort.的干燥根茎、蔷薇科植物山楂Crataegus pinnatifidaBunge 的干燥成熟果实、蔷薇科植物梅Prunus mume(Sieh.) Sieb.et Zucc.的干燥成熟果实、山茱萸科植物山茱萸Cornus officinalisSieb.et Zucc.的干燥成熟果实、硫酸盐类矿物芒硝Natrii Sulfas经加工精制而成的结晶体、硫酸盐类矿物芒硝Natrii Sulfas风化干燥的产物。
1.3 动物
雄性昆明种小鼠,30 只,清洁级,6~7 周龄,体质量(24±2)g,由江西中医药大学实验动物中心提供,许可证号SCXK(赣)2018-0003。动物饲养于温度为22~25 ℃,相对湿度为40%~60%,12 h 明暗交替的环境中。所有实验操作均符合实验动物使用指导原则,实验方案取得江西中医药大学伦理委员会审核批准(批准号 JZSYDWLL-20201215)。
2 方法
2.1 玉竹有效部位的制备及表征[5]
取玉竹药材适量,粉碎,用水提取3 次,每次2 h,合并提取液,浓缩蒸干,得到总提取物;总提取物水溶、醇沉,得醇沉物及上清液;将醇沉物透析,即得玉竹多糖(9.8%)。将上清液浓缩蒸干,即得醇溶物;将醇溶物水溶,用醋酸乙酯萃取,收集醋酸乙酯层蒸干,用水溶解,上AB-8 大孔树脂柱;过夜吸附后,依次用水、10%乙醇除杂,再用40%乙醇、60%乙醇洗脱;40%乙醇洗脱液蒸干后水溶,用乙醚按1∶1 比例萃取,收集乙醚层,蒸干,即得玉竹黄酮(0.06%)。收集60%乙醇洗脱液,蒸干,得玉竹皂苷(0.1%)。利用紫外分光光度计及高效液相色谱对玉竹多糖、皂苷、黄酮质量分数及游离糖成分进行检测[6-8]。
2.2 基于“效味”探索玉竹甘味药性物质
2.2.1 阴虚模型建立、分组及给药 小鼠适应性饲养7 d 后,随机分为5 组,即正常组、模型组、多糖组、皂苷组、黄酮组,每组6 只。除正常组外,其余各组小鼠ig 给予等比例的附子、肉桂、干姜热性中药提取物(取附子适量,用水提取1 h,再加入肉桂、干姜提取1 h,滤过,药渣再提取1 h,合并2 次提取液,浓缩至生药质量浓度1 g/mL,即得热性中药提取液,4 ℃储存),持续给药28 d,制备阴虚小鼠模型[9]。第29 天开始,各给药组小鼠分别ig给予玉竹多糖(1784 mg/kg)、皂苷(18.2 mg/kg)、黄酮(10.9 mg/kg),其剂量均相当于人临床等效剂量的10 倍;正常组、模型组给予等体积蒸馏水,持续28 d。
2.2.2 “阴虚”指标的测定及玉竹“甘味”药性物质的初步确定 给药期间,每7 天测量1 次体质量、心前区温度,用代谢笼测定24 h 摄食量、24 h 摄水量,收集24 h 粪便,精密称定湿质量,放烘箱105 ℃烘干24 h,称干质量,计算粪便含水率[粪便含水率=(湿质量-干质量)/湿质量]。末次给药后,动物麻醉,取背部皮肤及肺、胃、肝、肾等组织,保存于-80 ℃备用;取皮肤适量,精密称定,再放入烘箱中于80 ℃烘干12 h,称干质量,计算皮肤含水率[皮肤含水率=(湿质量-干质量)/湿质量]。按照试剂盒说明书测定肝、肾、胃组织中Na+,K+-ATP酶、Ca2+,Mg2+-ATP 酶活力;采用qRT-PCR 法测定肺、胃、肾组织AQP1、AQP3mRNA 表达量,引物序列:β-actin上游5’-CTGTGCCCATCTACGAGGGCTAT-3’,下游5’-TTTGATGTCACGCACGATTTCC-3’;AQP1上游5’-ACATCATCGCCCAGTGTG-3’,下游5’-CTGCAGAGTGCCAATGATCTC-3’;AQP3上游5’-GCCAAGGTAGGATAGCAAATAA-3’,下游5’-TTGAAAACTTGGTCCCTTGC-3’。扩增程序为95 ℃预变性45 s,95 ℃变性15 s,60 ℃退火15 s,72 ℃延伸45 s,45 个循环。分析玉竹多糖、皂苷、黄酮对上述指标的回调作用,即补阴作用,具有补阴作用的物质即可初步认定为玉竹“甘味”药性物质。
2.3 基于“滋味”探索玉竹甘味药性物质
2.3.1 电子舌识别“滋味”的可靠性考察 参考电子舌说明书,以葡萄糖、盐酸小檗碱、酒石酸、氯化钾、谷氨酸钠5 种化合物为甘、苦、酸、咸、辛“五味”标准品,以蔗糖为受试品。将“五味”标准品及蔗糖受试品配制成质量浓度为1.0 mg/mL 的溶液,利用电子舌的6 个电极在1、10、100 Hz 的频率段下采集信号数据。将“五味”标准品及蔗糖受试品的数据进行传感器优化,选择区分指数(discrimination index,DI)值最大的电极及频率段组合,进行主成分分析(principal component analysis,PCA),基于PCA 计算“五味”标准品与蔗糖之间的欧式距离[10],如葡萄糖与蔗糖之间的距离最近,则认为基于PCA 的欧式距离可准确识别“滋味”。去除蔗糖受试品,将“五味”标准品数据进行传感器优化,选择最大DI 值的电极及频率段组合,在 PCA 的基础上,利用判别因子分析(discriminant factor analysis,DFA)建立“五味”分区模型;再将蔗糖数据投射入模型中,如蔗糖投射于葡萄糖区域,则认为基于PCA 的DFA 可准确识别“滋味”。
2.3.2 “滋味”的测定及玉竹“甘味”药性物质的初步确定 以甘草、党参、黄芪为“甘味”基准,黄连、黄芩、大黄为“苦味”基准,干姜、白芷、川芎为“辛味”基准,山楂、乌梅、山茱萸为“酸味”基准,芒硝、玄明粉、食盐为“咸味”基准,建立甘、苦、辛、酸、咸的中药“五味”标准,以玉竹多糖、皂苷、黄酮为检测样品,利用电子舌采集信号数据。按“2.3.1”项下方法进行分析,计算甘、苦、辛、酸、咸味中药与玉竹多糖、皂苷、黄酮样品之间的欧式距离,分析玉竹多糖、皂苷、黄酮在中药五味分区模型上所投射的区域。最后综合分析欧式距离以及样品投射的区域,初步确定玉竹“甘味”药性物质。
2.4 玉竹“甘味”药性物质与甜味受体的关联性
2.4.1 “甘味”药性物质对GLP-1 分泌的影响 “甘味”药性物质结合并激动甜味受体,启动甜味信号通路,促进GLP-1 的分泌。可见,GLP-1 在一定程度上可表征甜味物质与甜味受体之间的结合。因此,采用整体动物实验考察“甘味”药性物质与甜味受体的结合性。阴虚模型建立、分组及给药同“2.2.1”项,末次给药后1 h,将小鼠麻醉,摘眼球取血,血液静置2 h 后,4 ℃,3500 r/min 离心10 min,分离血清,用ELISA 法检测血清GLP-1 含量。
2.4.2 “甘味”药性物质与甜味受体结合性研究 分子对接是研究分子与蛋白之间结合性的常用方法。小鼠、人甜味受体的三级结构不明确,因此本研究首先以青鳉鱼甜味受体的三级结构5X2M_B 为模板[11],以小鼠、人甜味受体的一级序列为基础,利用SWISS-MODELL 构建小鼠(mT1R2/mT1R3)及人(hT1R2/hT1R3)甜味受体三级结构,并利用在线同源模型评估软件 ERRAT、VERIFY3D 和PROCHECK 对其进行评估;如评估结果显示所构建的甜味受体结构合理,则可用于分子对接分析。然后在 TCMSP 上下载玉竹皂苷分子(MOL010393),分子及甜味蛋白用AutoDockTools-1.5.6进行处理,用AutoDock Vina 进行分子对接,再利用PyMOL 生成分子与蛋白结合的文件,利用Discovery Studio 4.5 Client 绘制对接结合图。
2.5 统计学分析
3 结果
3.1 玉竹有效部位表征分析
玉竹经提取、纯化后,得玉竹多糖、皂苷、黄酮,其质量分数分别为85.1%、63.5%、51.0%;同时,经ELSD-HPLC 分析(图1),玉竹总提取物、醇沉物、醇溶物等粗提取物中含有木糖、果糖、蔗糖等糖成分,而分离纯化后的多糖、皂苷、黄酮中均不含玉竹中常见的鼠李糖、木糖、果糖、葡萄糖、蔗糖,这也消除了多糖、皂苷、黄酮含有的小分子糖类成分对实验结果的干扰。
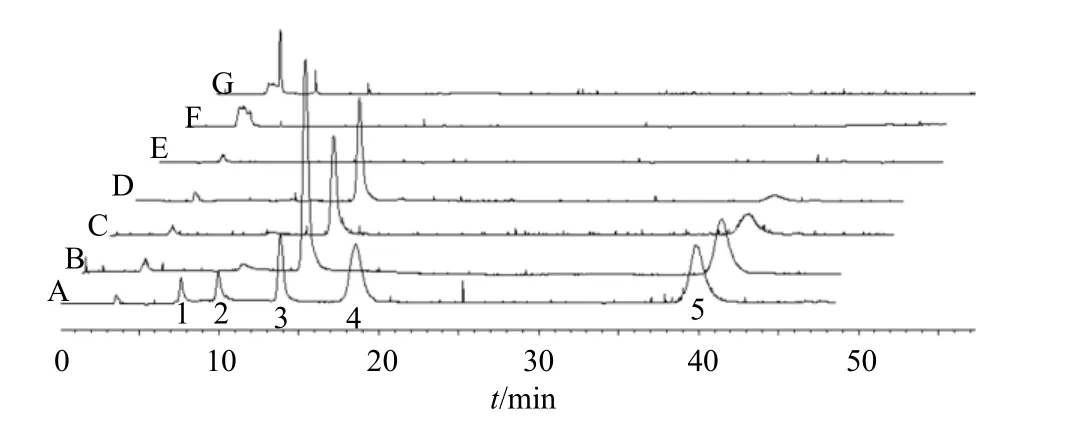
图1 玉竹提取物中小分子糖类成分分析Fig.1 Analysis of small molecular sugars in extracts of P.odoratum
3.2 基于“效味”的玉竹甘味药性物质的初步确定
3.2.1 玉竹对阴虚模型小鼠体质量、体温、摄食量、摄水量、粪便含水率、皮肤含水率的影响 玉竹对阴虚模型小鼠体质量的影响见图2-A。结果显示,与正常组相比,模型组小鼠体质量明显下降(P<0.05);给药21 d 后,与模型组相比,皂苷组小鼠体质量显著增加(P<0.05);给药28 d 后,与模型组相比,多糖组和皂苷组小鼠体质量显著增加(P<0.05);在整个治疗期间,与模型组比较,黄酮组小鼠体质量未见明显差异。玉竹对小鼠体温的影响见图2-B。结果显示,在造模及治疗期间,小鼠体温未见明显差异。玉竹对阴虚小鼠摄食量的影响见图2-C。与正常组相比,模型组小鼠摄食量明显降低(P<0.05);给药21 d 后,与模型组相比,皂苷组小鼠摄食量明显增加(P<0.05);给药28 d 后,与模型组相比,多糖组和皂苷组小鼠摄食量明显增加(P<0.05)。玉竹对阴虚小鼠摄水量的影响见图2-D。结果显示,与正常组相比,模型组小鼠摄水量明显升高(P<0.05);给药21、28 d 后,与模型组相比,多糖组和皂苷组小鼠摄水量显著下降(P<0.05)。玉竹对阴虚小鼠粪便含水率的影响见图2-E。结果显示,与正常组相比,模型组小鼠粪便含水率明显降低(P<0.05);给药28 d 后,多糖、皂苷组小鼠粪便含水率显著升高(P<0.05)。玉竹对阴虚小鼠皮肤含水率的影响见图2-F。与正常组相比,模型组小鼠皮肤含水率显著下降(P<0.05);与模型组相比,多糖组及皂苷组小鼠皮肤含水率显著增高(P<0.05)。
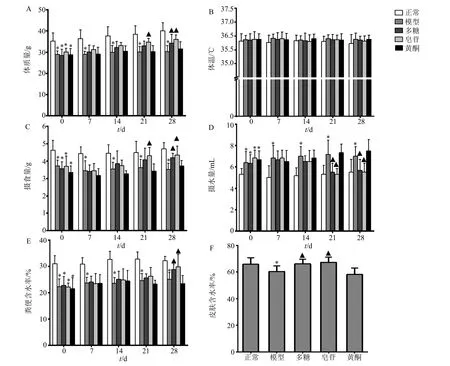
图2 玉竹对阴虚小鼠体质量 (A)、体温 (B)、摄食量 (C)、摄水量 (D)、粪便含水率 (E)、皮肤含水率 (F) 的影响 (,n=6)Fig.2 Effects of P.odoratum on body weight (A),body temperature (B),food intake (C),water intake (D),fecal moisture content (E),and skin moisture content (F) of mice with yin deficiency (,n=6)
3.2.2 玉竹对Na+,K+-ATP 酶、Ca2+,Mg2+-ATP 酶活性的影响 玉竹对Na+,K+-ATP 酶、Ca2+,Mg2+-ATP 酶活性的影响见图3。结果显示,与正常组相比,模型组小鼠胃、肝、肾组织Na+,K+-ATP 酶、Ca2+,Mg2+-ATP 酶活性显著升高(P<0.05);与模型组相比,多糖组和皂苷组小鼠胃、肝、肾组织中的Na+,K+-ATP 酶、Ca2+,Mg2+-ATP 酶活性显著下降(P<0.05)。黄酮组小鼠胃、肝、肾组织Na+,K+-ATP酶、Ca2+,Mg2+-ATP 酶活性未见明显变化。
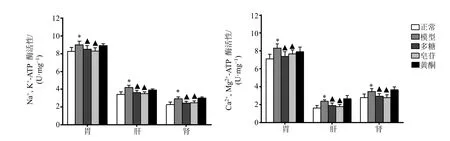
图3 玉竹对阴虚小鼠Na+,K+-ATP 酶、Ca2+,Mg2+-ATP 酶活性的影响 (,n=6)Fig.3 Effects of P.odoratum on Na+,K+-ATPase and Ca2+,Mg2+-ATPase activity of mice with yin deficiency (,n=6)
3.2.3 玉竹对AQP1、AQP3mRNA 表达的影响 玉竹对AQP1、AQP3mRNA 表达的影响见图4。与正常组比较,模型组小鼠肺、胃、肾AQP1、AQP3mRNA 表达显著降低(P<0.05);与模型组比较,多糖组和皂苷组小鼠肺、胃、肾AQP1、AQP3mRNA表达显著升高(P<0.05),黄酮组小鼠肺、胃、肾AQP1、AQP3mRNA 表达未见明显变化。

图4 玉竹对阴虚小鼠AQP1、AQP3 mRNA 表达的影响 (,n=6)Fig.4 Effects of P.odoratum on expression of AQP1 and AQP3 mRNA of mice with yin deficiency (,n=6)
3.2.4 基于“效味”的玉竹甘味药性物质的初步确定 综合分析玉竹多糖、皂苷、黄酮对阴虚小鼠体质量、摄食量、摄水量、粪便含水率、皮肤含水率,Na+,K+-ATP 酶、Ca2+,Mg2+-ATP 酶活性及AQP1、AQP3mRNA 表达的影响,其中,玉竹多糖、皂苷对以上指标有显著的回调作用,表明玉竹多糖、皂苷对阴虚小鼠有治疗作用。因此,基于“效味”,可初步确定玉竹的甘味药性物质为多糖、皂苷类成分。
3.3 基于“滋味”的玉竹甘味药性物质的初步确定
3.3.1 电子舌识别“滋味”的可靠性分析 葡萄糖、盐酸小檗碱、酒石酸、氯化钾、谷氨酸钠五味标准品及蔗糖受试品的PCA 结果见图5-A,五味标准品与蔗糖的欧式距离见图5-B。可以看出,葡萄糖与蔗糖距离最近,说明葡萄糖与蔗糖“滋味”相近或相同,即均为甘味。去除蔗糖受试品,葡萄糖、盐酸小檗碱、酒石酸、氯化钾、谷氨酸钠五味标准品的PCA 结果见图5-C,蔗糖在“五味”分区模型上的投射见图5-D。结果显示,蔗糖归属葡萄糖区域。以上结果表明,电子舌可准确识别物质“滋味”。

图5 电子舌识别滋味可靠性分析Fig.5 Reliability analysis of taste recognition by electronic tongue
3.3.2 基于“滋味”的玉竹甘味药性物质的初步确定 中药“五味”标准品与玉竹多糖、皂苷、黄酮样品的PCA 结果见图6-A,欧式距离见图6-B。可以看出,玉竹皂苷与甘味中药距离最近;多糖与甘味、辛味中药的距离均较近;黄酮与苦味中药距离最近。除去样品,中药“五味”标准品PCA 结果见图6-C,玉竹多糖、皂苷、黄酮在“五味”分区模型上的投射见图6-D。结果显示,皂苷投射于甘味中药区域,多糖投射于辛味、甘味中药2 个区域,黄酮则投射于苦味中药区域。因此,基于“滋味”,可初步确定玉竹的甘味药性物质为皂苷。
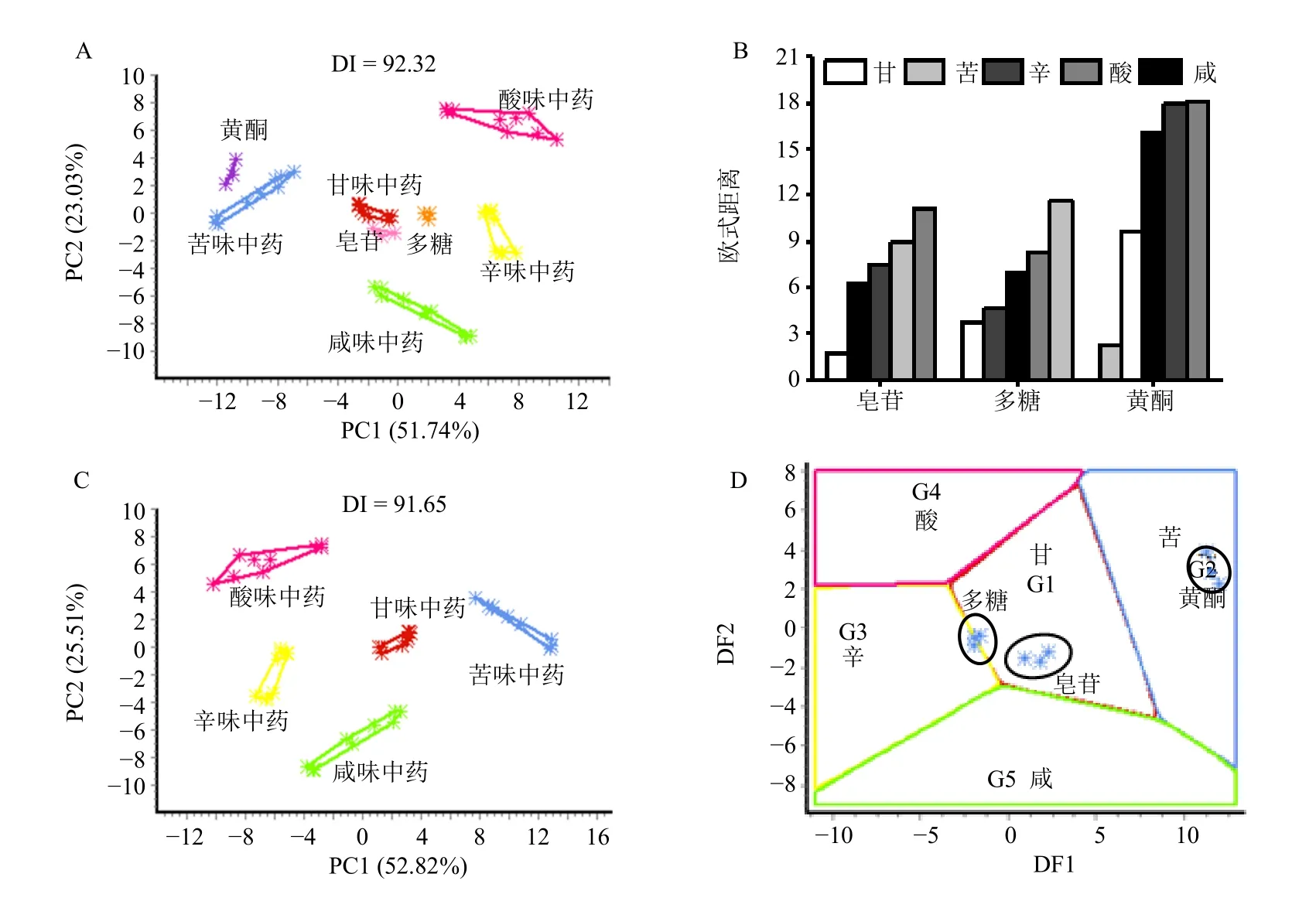
图6 玉竹味“甘”药性物质分析Fig.6 Analysis of material basis of “sweet” medicinal properties of P.odoratum
3.4 玉竹“甘味”药性物质与甜味受体的关联性分析
以上结果表明,基于“效味”,玉竹的甘味药性物质为多糖、皂苷,而基于“滋味”,玉竹的甘味药性物质为皂苷。综合基于“效味”和“滋味”的结果,最终确定皂苷为玉竹甘味药性物质。接下来采用整体动物考察玉竹皂苷对GLP-1 的分泌的影响,并与玉竹多糖、黄酮对比;采用分子对接考察玉竹皂苷与甜味受体的结合性,从以上2 个方面揭示效味、滋味与甜味受体的关联性。
3.4.1 玉竹皂苷对GLP-1 分泌的影响 结果见图7。结果显示,与正常组相比,模型组小鼠血清GLP-1 含量显著下降(P<0.05);与模型组相比,皂苷组和多糖组小鼠血清GLP-1 含量显著增加(P<0.05),而黄酮组小鼠血清GLP-1 含量无明显变化。
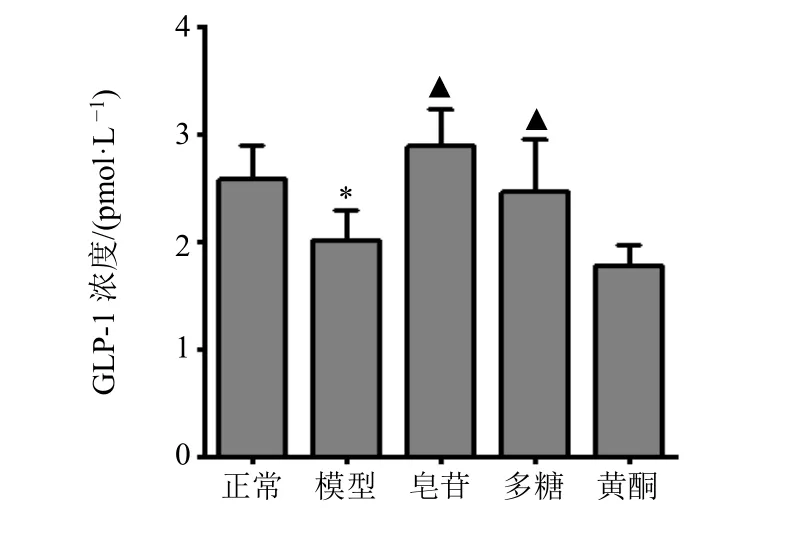
图7 “甘味”药性物质对GLP-1 分泌的影响 (,n=6)Fig.7 Effects of material basis of “sweet” medicinal properties on secretion of GLP-1 (,n=6)
3.4.2 玉竹皂苷与甜味受体结合性分析 “甘味”药性物质玉竹皂苷分别与鼠源甜味受体mT1R2、mT1R3 及人源甜味受体hT1R2、hT1R3 对接结合,见图8。结果显示,皂苷分子可与甜味受体多个氨基酸残基形成结合键;玉竹皂苷分子与mT1R2、mT1R3之间的结合能分别为-39.3、-31.8 kJ/mol;与hT1R2、hT1R3 之间的结合能分别为-40.6、-42.3 kJ/mol。可以看出,玉竹皂苷与甜味受体有较好的结合性。
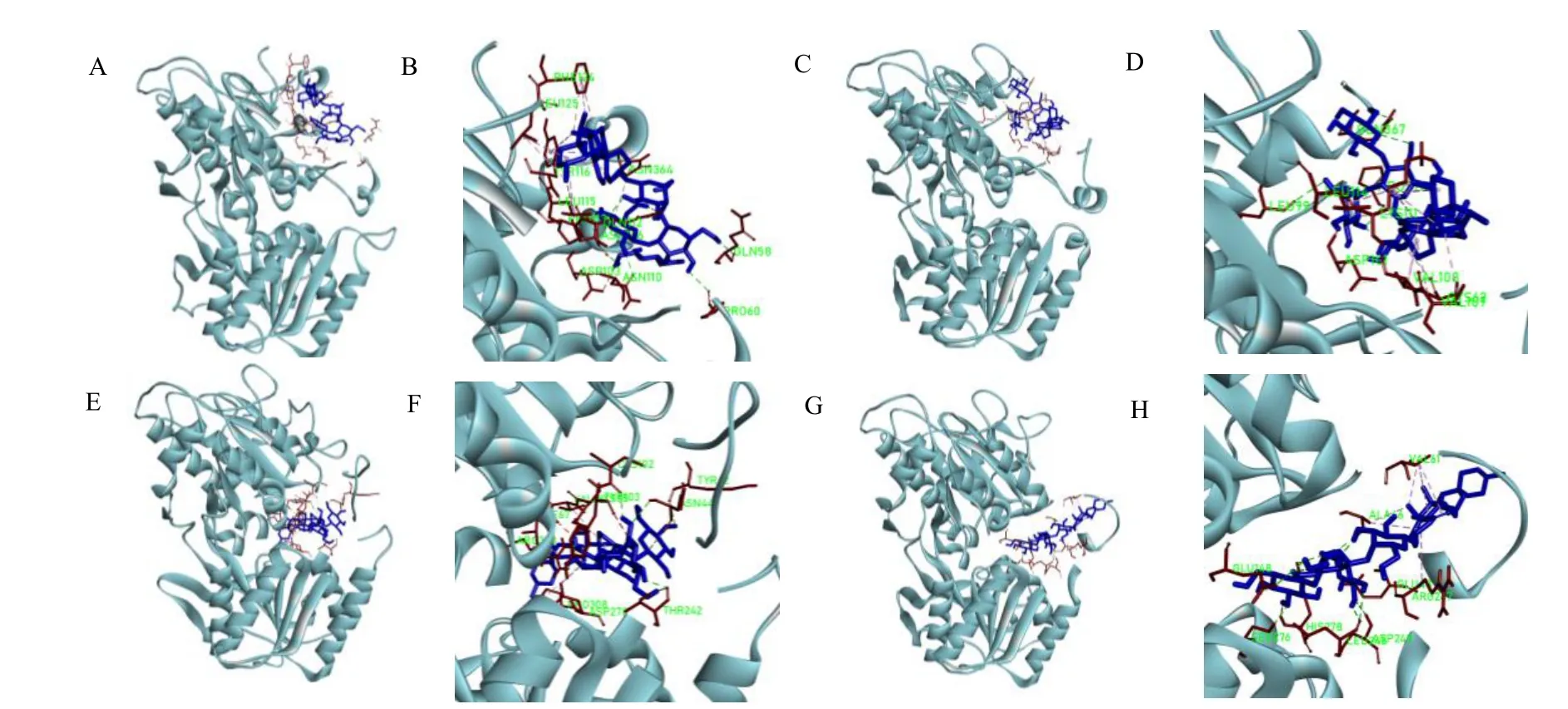
图8 玉竹皂苷与甜味受体分子对接图Fig.8 Docking diagrams of saponin of P.odoratum and sweet receptors
4 讨论
研究表明,电子舌可模拟人类味觉感受机制,根据传感器响应信号来识别不同味道的物质,结构相似的样品有相近的传感器响应特征[12]。本研究以甘草、党参、黄芪为标准甘味中药,结果显示皂苷与标准甘味中药距离最近,且能投射于标准甘味中药区域,因此皂苷与标准甘味中药含有的成分具有“相似性”;采用分子对接分析还发现,玉竹皂苷与甜味受体有较好的结合性,表明玉竹皂苷可能是甜味受体的激动剂,而葡萄糖、蔗糖是甜味受体的典型激动剂,因此基于“配体-受体”的相关性质,玉竹皂苷与葡萄糖在结构上也应具有一定“相似性”。基于以上分析,甘味中药可能含有结构“相似”的成分,通过激活舌头味蕾细胞上的甜味受体,传递甜味感觉。这不仅在一定程度上揭示了“滋味”与甜味受体之间存在关联的分子机制,还阐明了甘味中药滋味为“甘”的生物学基础,即从“滋味”的角度,能激活舌头味蕾细胞上的甜味受体的成分,均可确定为甘味药性物质。
本研究采用阴虚小鼠模型研究发现,玉竹皂苷可促进GLP-1 的分泌。GLP-1 可促进胰岛素的分泌,而胰岛素可改变葡萄糖在细胞内外的分布从而改善阴虚证(症状);同时研究表明,甜味信号通路中的环磷酸腺苷(cyclic adenosine monophosphate,cAMP)、蛋白激酶A(protein kinase A,PKA)、Ca2+等信号分子与AQPs 均存在密切联系[13],且Ca2+还能调节Na+,K+-ATP 酶的活性[14]。可见,甜味受体还可通过甜味通路上的信号分子作用AQPs、Na+,K+-ATP 酶,发挥抗“阴虚”作用。这不仅在一定程度上揭示了“效味”与甜味受体之间存在关联的分子机制,还阐明了甘味中药效应为“补”的生物学基础,即从“效味”的角度,能激活胃肠组织上的甜味受体的成分,均可确定为甘味药性物质。需要指出的是,玉竹多糖也可促进GLP-1 的分泌,结合分子对接结果分析,玉竹多糖可能并不是通过激动甜味受体来促进GLP-1的分泌,可能存在其他机制。
玉竹功能养阴润燥、生津止渴,临床主要用于胃阴虚、肺阴虚。阴虚证临床证候表现多样,但基于阴虚“阴液亏损”“阳亢内热”的病机,水液代谢、能量代谢是阴虚重点关注的2 个方面。一般而言,水液代谢与AQPs 有关,而能量代谢与Na+,K+-ATP酶、Ca2+,Mg2+-ATP 酶有密切关联。有研究表明,阴虚可导致AQPs 表达下调[15],Na+,K+-ATP 酶、Ca2+,Mg2+-ATP 酶活性升高[16]。水液代谢紊乱进一步导致大便干燥、皮肤干涩、口干咽燥、多饮的症状[17],而能量代谢紊乱则可导致体温升高[18]。但也有研究表明,阴虚动物体温与正常动物无明显差异[19]。本研究发现玉竹多糖、皂苷对阴虚小鼠的体质量、摄食量、摄水量、大便含水率、皮肤含水率,Na+,K+-ATP酶、Ca2+,Mg2+-ATP 酶活性及AQP1、AQP3mRNA的表达均有明显的回调作用,而玉竹黄酮的回调作用不明显,据此初步确定玉竹的甘味药性物质为多糖、皂苷。需要指出的是,阴虚证临床证候表现多样,因此评价药物的“抗阴虚”作用也有Na+,K+-ATP 酶、Ca2+,Mg2+-ATP 酶活性,AQP1、AQP3mRNA,饮水量、大便含水量、皮肤含水量等多个指标,因此基于各指标的权重构建一个综合指标评价药物的“抗阴虚”作用可能更合理。
目前,基于效味探索五味药性物质是药性物质研究的一种主要方法,其可概括为“有效物质即为药性物质”。可以看出,这种研究方法与现代药理学研究方法类似。然而,中药不能简单看成是有效物质与无效物质的集合体,因为“有效”与“无效”并不能截然分开,有时“有效”与“无效”之间还能相互转化。因此,仅仅基于“效味”探索五味药性物质,可能还存在一定的局限性。事实上,中药“味”的确定最初是依据药物的真实“滋味”。《黄帝内经·素问》记载:“五气入鼻、五味入口”[20]。因此,中药五味药性物质基础研究,不仅要关注“效味”,还要关注“滋味”。本研究以玉竹为研究对象,基于甜味受体整合中药“效味”和“滋味”挖掘玉竹甘味药性物质,研究结果为中药五味药性物质的研究提供了新视角,同时研究结果对玉竹药材的质量评价也提供了实验依据。
利益冲突所有作者均声明不存在利益冲突

