早产儿生后3天内血小板相关参数对其动脉导管关闭影响因素的分析
尤净叶,应 倩,程元辉,石礼锋
(复旦大学附属妇产科医院新生儿科,上海 200090)
动脉导管未闭(patent ductus arteriosus,PDA)是新生儿出生后动脉导管未能闭合而持续开放的病理状态,在早产儿中比较常见,尤其在小于28周早产儿中的发病率可高达60%[1],且伴有血流动力学改变的PDA可引起一系列的并发症,如肺水肿、肾衰竭、小肠肠炎坏死等。尽管心脏超声是诊断PDA及随访的常用方法,但临床上仍在致力于寻求能够早期预测、诊断或治疗PDA的替代方法。近年越来越多的研究揭示了血小板与PDA之间存在某种联系[2-3]。对于足月新生儿,分娩后动脉导管收缩减少了静脉腔内和血管内的血流,导致静脉壁缺氧关闭动脉导管,此时血小板在动脉导管中聚集发挥的作用微乎其微,而早产儿的动脉导管壁较薄且血管较少,动脉导管的收缩不能达到足够的狭窄和缺氧的效果,需要血小板聚集才可能完全闭合。有研究认为血小板通过内皮细胞的交互作用可能在PDA的关闭中起重要作用[4],血小板减少可造成动脉导管持续开放。除血小板计数(platelet,PLT)外,血小板的其他相关参数,如平均血小板体积、压积、分布宽度等在激活血小板促进动脉导管关闭中是否也发挥积极作用有待进一步探究。基于上述情况,本文主要针对早产儿生后3天内血小板及其相关参数进行分析,探讨相关因素是否对早产儿有血流动力学意义的动脉导管关闭存在影响,以及对促进早产儿动脉导管闭合的治疗是否有临床指导意义。
1研究对象与方法
1.1研究对象
选取2019年1月至2020年6月期间在复旦大学附属妇产科医院新生儿科重症监护病房住院的低出生体重早产儿92例。
纳入标准:①生后立即入院;②胎龄<37周且出生体重<2 500g;③分别于生后1天、2天、3天完善血常规检查,1周内完善心脏超声检查。排除标准:①生后未立即入院或体重≥2 500g的早产儿;②有先天性遗传代谢病;③合并其他心脏病,如完全大动脉转位、肺动脉异位引流等。
根据心脏超声结果将符合纳入标准的早产儿分为PDA组57例与无PDA(no-patent ductus arteriosus,nPDA)组35例,其中PDA组为心脏超声检查有动脉导管未关闭,以左向右分流为主,且PDA直径≥1.5mm。在PDA组中,根据临床血流动力学改变情况筛选出有血流动力学改变的PDA(hemodynamic significant patent ductus arteriosus,hsPDA)组17例。
hsPDA组为:除心脏超声检查有动脉导管未关闭、以左向右分流为主、PDA直径≥1.5mm外,还有以下临床表现之一,①胸骨左侧可闻及连续性杂音;②心前区搏动增强;③安静情况下心率>180次/min;④不明原因的呼吸情况恶化;⑤胸片见心影增大或肺血管影增多,脉压差>25mmHg[5]。
1.2研究方法
收集患儿的一般资料,包括性别、胎龄、出生体重、产前糖皮质激素的使用、发生呼吸窘迫综合征(respiratory distress syndrome,RDS)、生后3天内血常规检查情况[大血小板比率(platelet-large cell ratio,P-LCR)、血小板体积(mean platelet volume,MPV)、PLT、血小板压积(plateletcrit,PCT)、血小板分布宽度(platelet distribution width,PDW)]。收集母亲的一般资料,包括合并妊娠期糖尿病及妊娠期高血压疾病情况。
除非有任何禁忌症,给予hsPDA组患儿布洛芬混悬滴剂口服(国药准字:H19991012)治疗关闭动脉导管,首次10mg/kg,间隔24h后给予5mg/kg,再次间隔24h后予5mg/kg,3天为1个疗程,共给药3次;若PLT<50×109/L,则停止治疗(本资料病程观察中未见患儿血小板低于此标准);在服药24h后,复查心脏超声,评估早产儿动脉导管闭合情况,若动脉导管闭合1mm以上或关闭,视为有效,若无上述情况,则视为无效,72h后重复心脏超声。
1.3统计学方法

2结果
2.1 PDA组与nPDA组相关资料的比较
在一般临床特征方面,PDA组与nPDA组早产儿的胎龄、出生体重,以及足量产前激素的使用、发生RDS的比例比较差异均有统计学意义(P<0.05);PDA组与nPDA组早产儿的性别、分娩方式、支气管肺发育不良、喂养不耐受的比例,以及P-LCR、MPV、PLT、PCT、PDW比较差异均无统计学意义(P>0.05);PDA组与nPDA组早产儿母亲合并妊娠期糖尿病、妊娠期高血压疾病的比例比较差异均无统计学意义(P>0.05),见表1。
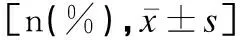
表1 PDA组与nPDA组早产儿基本情况及生后3天内血小板相关参数的比较Table 1 Comparison of the basic information and platelet related parameters within 3 days after birth between the PDA group and the nPDA
2.2 hsPDA组与nPDA组相关资料的比较
在一般临床特征方面,hsPDA组与nPDA组早产儿的胎龄、出生体重,以及足量产前激素的使用、发生RDS、喂养不耐受的比例比较差异均有统计学意义(P<0.05);hsPDA组与nPDA组早产儿的P-LCR、PLT、PCT比较差异均有统计学意义(P<0.05);hsPDA组与nPDA组早产儿的性别、分娩方式、支气管肺发育不良的比例,以及MPV、PDW比较差异均无统计学意义(P>0.05);hsPDA组与nPDA组早产儿母亲合并妊娠期糖尿病、妊娠期高血压疾病的比例比较差异均无统计学意义(P>0.05),见表2。
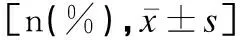
表2 hsPDA组与nPDA组早产儿基本情况及生后3天内血小板相关参数比较Table 2 Comparison of the basic information and platelet related parameters within 3 days after birth between the hsPDA group and the nPDA
2.3早产儿发生hsPDA的多因素Logistic回归分析情况
将hsPDA组与nPDA组比较中差异有统计学意义的自变量(胎龄、出生体重、足量产前激素、发生RDS、喂养不耐受、P-LCR、PLT、PCT)代入多因素Logistic回归分析发现:胎龄、足量产前激素、喂养不耐受、PLT均与早产儿发生hsPDA无明显关联(P>0.05),而出生体重、发生RDS、P-LCR、PCT均与早产儿发生hsPDA存在独立相关性(P<0.05),其中发生RDS、P-LCR、低PCT均是早产儿发生hsPDA的独立危险因素(P<0.05),但出生体重是早产儿发生hsPDA的独立保护因素(P<0.05),见表3。
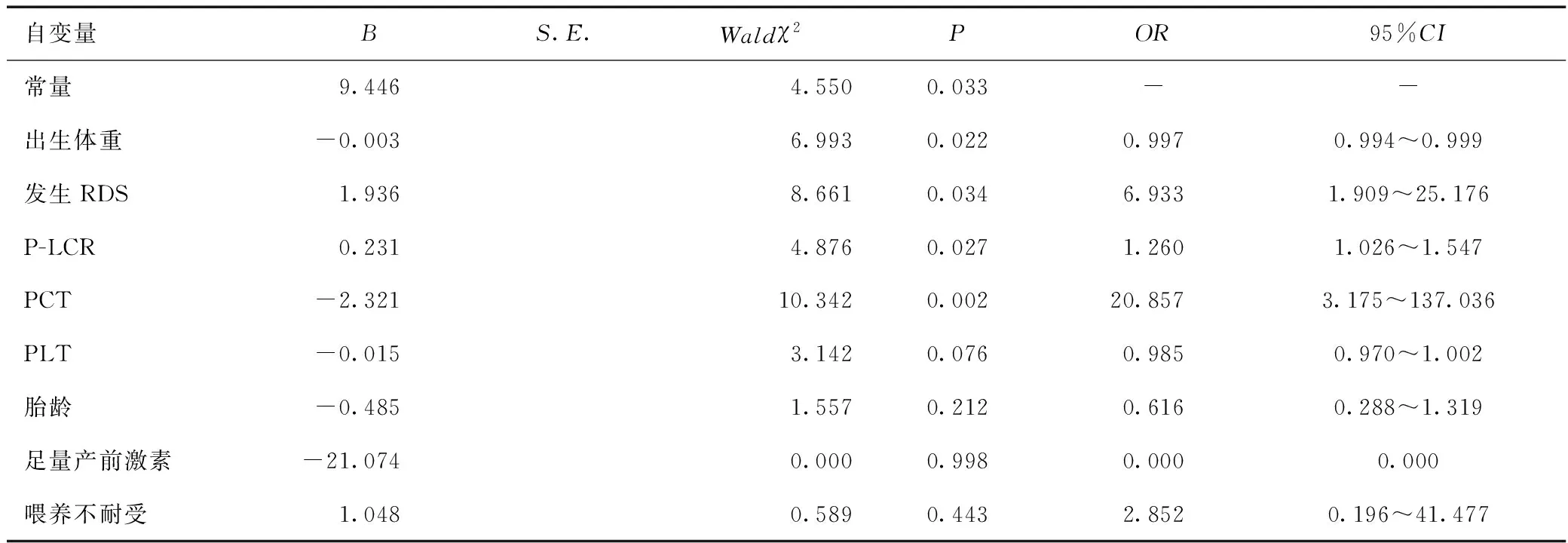
表3 早产儿发生hsPDA的多因素Logistic回归分析Table 3 Multivariate Logistic regression analysis of influencing factors of hsPDA in preterm infants
3讨论
3.1 PDA与一般临床特征及血液学指标的关系
新生儿生后随氧分压升高且前列腺素[如前列腺素E2(prostaglandin E2,PGE2)等)]下降使动脉导管的平滑肌收缩,导致其功能上的关闭,而之后残留的间隙则通过缺氧诱导血小板形成血栓将其填充,达到动脉导管解剖上的彻底关闭。PDA左向右分流越大、时间越久、代偿能力越差,其并发症越严重。因此早期识别PDA并积极干预对早产儿预后至关重要。
新生儿生后若动脉导管持续开放3天以上为PDA。早产儿因动脉导管平滑肌发育不佳且生后呼吸功能不良等造成动脉导管大多不能闭合[6],其发生率与早产儿的胎龄、出生体重成反比。本研究显示,PDA组的早产儿较nPDA组胎龄小、出生体重低,而足量产前激素的使用,发生RDS的比例较高(分别为87.72%、57.89%)。胎龄越小、出生体重越低的胎儿在宫内既已存在肺部发育不良,为了改善其肺部发育状况,产前激素的使用率增高,并且生后肺泡少,肺部血管少且横截面积小,气体有效交换差,更易发生早产儿RDS。但是,PDA组与nPDA组的血小板及相关参数比较并未发现明显差异(P>0.05)。Sallmon等[7]对1 350例早产儿研究发现,生后24h的血小板及相关参数与其动脉导管的关闭无关。这与本研究结果基本一致。有研究显示,与nPDA组比较,PDA组的PDW较低,因此认为其对PDA的早期预测有一定的临床价值,但该研究主要针对极低出生体重儿,多数胎龄<28周,其中60%~70%的早产儿PDA伴有临床血流动力学改变,需要药物或手术治疗[8]。
3.2 hsPDA与一般临床特征及血液学指标的关系
本研究显示,与nPDA组相比,hsPDA组的胎龄、出生体重均更低,hsPDA组早产儿的胎龄约在30周以内,出生体重<1 500g,足量产前激素的使用、发生RDS的比例均更高(分别为100.00% vs.20.00%,70.59% vs.31.43%),且喂养不耐受的比例高于nPDA组(41.18% vs.11.43%),这可能也与早产儿肠道黏膜细胞连接完整性低、胃肠蠕动差有关。当早产儿发生hsPDA时,肠黏膜血流明显减少,引起肠黏膜应激反应,且早产儿本身的免疫、屏障受损等导致了喂养不耐受及新生儿坏死性小肠结肠炎(necrotizing enterocolitis,NEC)的发生[9]。
本研究显示,hsPDA组与nPDA组早产儿的P-LCR、PLT、PCT比较差异均有统计学意义(P<0.05)。Alyamac Dizdar等[10]研究了361例胎龄为26~29周、出生体重在892~1 250g的早产儿,评估hsPDA与血小板之间的相关性,发现PLT减少对hsPDA有着微小但重要的影响,既PLT减少与早产儿发生hsPDA之间有关联。有研究显示,口服对乙酰氨基酚与输注含血小板血浆对促进早产儿动脉导管闭合的疗效相似,当发生hsPDA的早产儿有对乙酰氨基酚禁忌症或药物干预失败时,输注含血小板血浆(platelet-rich plasma,PRP)可作为备选治疗措施之一,以促进早产儿动脉导管闭合[2]。这表明血小板对早产儿hsPDA是有影响的。但也有研究发现,PLT减少或增多对早产儿hsPDA的发生无明显影响[7-8]。这可能是因为新生儿生后PLT随着日龄不同而有所变化,只观察生后24h血小板易受母体因素影响,如子痫、HELLP等。因此,本研究分析了早产儿生后3天内血小板及相关参数,同时进行了多因素Logistic回归分析,结果显示,未见PLT对早产儿发生hsPDA有明显影响。相比PLT,血小板功能可能在动脉导管的关闭中起着更重要的作用,如MPV、PDW等影响血小板反应的活性,是临床状态下血小板活化的指标,并且MPV、PDW与一些炎症反应过程相关。本研究显示,hsPDA组与nPDA组的MPV、PDW比较差异均无统计学意义(P>0.05),提示MPV和PDW不会增加早产儿发生hsPDA的风险,也有可能与收集病例中炎症感染病例较少有关。
3.3早产儿发生hsPDA的影响因素分析
本研究显示,在多因素Logistic回归分析中发现低P-LCR、低PCT均是早产儿发生hsPDA的独立危险因素(OR>1,P<0.05)。有研究显示,在纳入的760例小于34周早产儿中,PCT越低发生PDA且持续开放程度越高,生后低PCT是早产儿发生hsPDA的独立危险因素[3]。这与本研究结果相符。PCT是表示血小板质量的一个指标,优于PLT,代表血小板总质量,在成人中PCT与心血管疾病相关,临床上PCT可被应用于指导血小板的输注[11],推测低PCT可能提示血小板消耗的增加和导管关闭中血小板的作用缺陷阻碍了PDA的关闭。有研究回顾性分析了115例hsPDA早产儿和120例nPDA早产儿的PLT、PCT,仅PCT被确定为早产儿发生hsPDA的独立危险因素,并认为PCT是促进早产儿hsPDA关闭中重要指标[12]。因此有理由相信是PCT而不是PLT对促进早产儿hsPDA的闭合有更密切的影响。生后低P-LCR,增加了早产儿hsPDA的几率,因大血小板较小血小板质量更好,相比小血小板,大血小板在酶促的作用下会变得更活跃,可通过激活凝血系统促进微循环中纤维蛋白的沉积,形成一个更加有效的血小板栓子,并且大的血栓含有更多的凝血原物质,如血栓烷A2、血栓烷B2等[13]。其表明P-LCR在早产儿动脉导管关闭的作用中具有临床意义。本研究显示,发生RDS也是早产儿发生hsPDA的独立危险因素(P<0.05),这可能与早产儿发生RDS造成肺损伤破坏了血小板的产生及功能血小板本身的消耗有关,进而增加了早产儿发生hsPDA的风险。有研究显示,血小板及相关参数参与了肺泡及肺血管的发育和修复[14],其也进一步证实了本研究的结果。本研究显示,出生体重是早产儿发生hsPDA的独立保护性因素(OR<1,P<0.05)。随着胎龄、出生体重的增加,早产儿并发症也会减少,发生hsPDA的可能性就减少。在小儿外科临床中,常以PDA直径/体重评估hsPDA与手术结扎相关的指标,生后48h内的PDA直径/体重>1.5mm/kg联合FiO2>0.3可作为手术结扎的预测指标[15]。由此显示出生体重对指导干预早产儿hsPDA的重要价值。早产儿出生体重越低,心肌纤维发育不成熟,出生后体循环阻力升高,生理性肺动脉压力下降延迟,极易造成早产儿PDA的持续开放,很容易出现血流动力学紊乱,这也表明出生体重在早产儿发生hsPDA中具有临床意义。
综上所述,发生RDS、低P-LCR、低PCT、出生体重均为早产儿发生hsPDA的影响因素,并且发生RDS、低P-LCR、低PCT是早产儿发生hsPDA的危险因素,而出生体重为其保护因素。P-LCR和PCT可作为评价早产儿发生hsPDA的临床指标。未来可能需要更大范围多中心资料做进一步的研究验证。

