肝硬化食管胃静脉曲张出血患者内镜治疗后再出血的危险因素分析
何青莲 余保平 肖勇
作者单位:430060 武汉大学人民医院消化内科
随着肝硬化的发展,在1年、3年和10年时腹水、肝性脑病及食管胃静脉曲张破裂出血(EGVB)的发生率分别为17%、23%和52%[1]。EGVB作为导致肝硬化患者死亡的主要危险因素,6周内病死率高达20%。尽管通过内镜下静脉曲张套扎治疗及组织胶注射可迅速控制出血,但仍有部分患者经内镜治疗后因再发出血需二次治疗。CTP评分是评估肝硬化预后的工具之一,但因受到主观因素影响如腹水和肝性脑病而具有一定的局限性[2]。梅奥诊所开发的MELD评分主要预测选择性TIPS后的早期病死率[3],但因肌酐在性别之间具有差异以及不同实验室所测得的INR水平不同使得该项评分存在不足,且未考虑与肝硬化患者短期预后不良相关的一些因素,如血清钠,骨骼肌减少症等[4]。Kim等[5]认为MELD-Na评分系统能更好的预测有待肝移植患者的死亡风险,而在MELD的衍生模型中,iMELD预测3个月及6个月生存率的能力优于MELD、MELD-Na、终末期肝病钠指数模型(MESO)[6]。此外Bai等[7]提出的CAGIB评分优于CTP与MELD评分,而VOCAL-Penn模型则极大程度提高了肝硬化患者的术后病死率预测性能[8]。目前对于肝硬化EGVB的评分系统尚未形成共识,因此,探究肝硬化EGVB患者内镜治疗后再出血的危险因素非常重要。
资料与方法
一、纳入标准
回顾性分析2019年11月1日至2021年11月31日于湖北省人民医院就诊的肝硬化出血患者的临床资料。纳入标准:①诊断标准符合《肝硬化门静脉高压食管胃静脉曲张出血的防治指南》[9],并行内镜治疗;②年龄≥18岁。排除标准:①非静脉曲张出血患者;②住院期间行保守治疗或TIPS手术治疗或外科手术治疗患者;③孕妇;④恶性肿瘤或合并心、肺、脑等重要脏器严重疾病者。
二、资料收集
收集一般资料(年龄、性别、肝硬化病因等)、入院情况(是否合并肝性脑病、感染、腹水、糖尿病等)、临床指标(血常规、凝血功能、总胆红素、尿素、肌酐、血钠、血氯、高密度脂蛋白、载脂蛋白A1等)、检查资料(门静脉主干直径、门脉血栓、腹水程度、静脉曲张团最大直径等)。以患者入院时间作为临床观察起点,以180 d内再发食管胃静脉曲张出血/死亡/肝移植/TIPS治疗/最后一次随访为观察终点。本研究经武汉大学人民医院伦理委员会批准通过,所有患者均签署知情同意书。
三、相关评分
①CTP评分包括肝性脑病、腹水、白蛋白、总胆红素、国际标准化比值(international normalized ratio, INR),其中5~6分为A级,7~9分为B级,10~15分为C级;②MELD评分=9.57×ln(肌酐[mg/dL])+3.78×ln(胆红素[mg/dL])+11.2×ln(INR)+6.43×(肝硬化病因:酒精性胆汁淤积性为0,其余为1);③MELD-Na评分=MELD+1.59×(135-Na+),当血清Na+水平>135 mmol/L时按135 mmol/L计算,当<120 mmol/L时按120 mmol/L计算,当血清Na+水平在120~135 mmol/L时按具体数值计算;④iMELD=MELD+0.3×年龄-0.7×血钠+100;⑤CAGIB评分=糖尿病(是=1,否=0)×1.040+肝细胞癌(是=1,否=0)×0.974+总胆红素(μmol/L)×0.005-血清白蛋白(g/L)×0.091+谷丙转氨酶(U/L)×0.001+血清肌酐(μmol/L)×0.012+3.964。
四、统计方法
结 果
一、研究对象一般资料
共纳入患者142例,随访期间再出血组61例,无出血组81例。
180 d内死亡11例(7.7%),再出血组死亡10例(16.4%),无出血组死亡1例(1.2%)。其中因消化道大出血3例,多器官功能衰竭7例,死因不详1例。两组患者基线特征见表1。
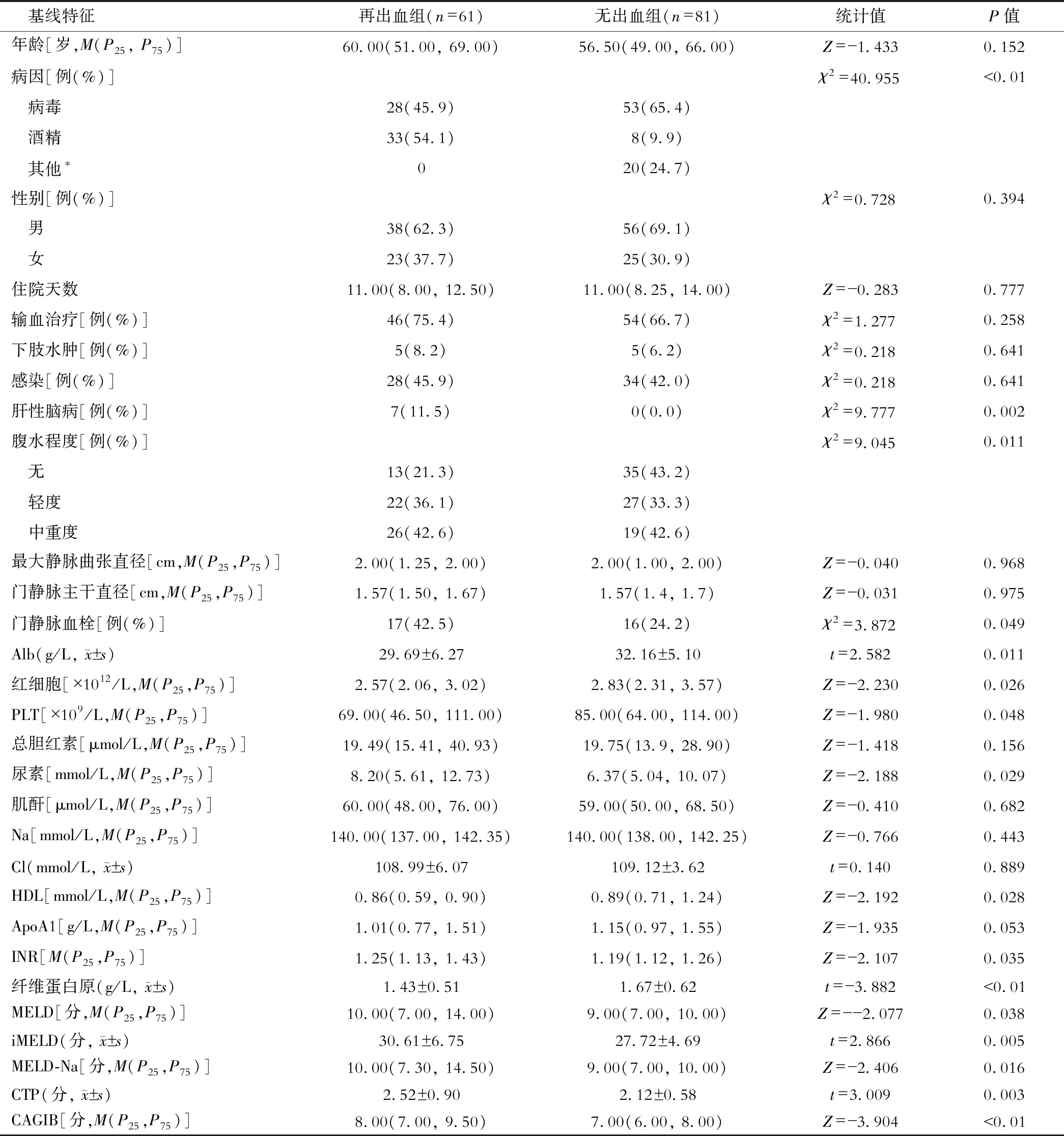
表1 再出血组与无出血组患者的基线特征
二、再出血危险因素分析
以基线特征为自变量,肝硬化静脉曲张治疗术后再出血及随访天数为因变量,进行单因素及多因素Cox比例风险回归,所有变量均符合比例风险假定。单因素分析结果显示,病因、肝性脑病、腹水程度、门静脉血栓、血小板、尿素、肌酐、ApoA1、INR、纤维蛋白原与肝硬化静脉曲张患者内镜治疗术后再出血高度相关(均P<0.05),因MELD、MELD-Na及CTP等评分多由临床显著变量组成的复杂变量,为避免多重共线性遂不将其纳入多因素分析。多因素分析结果显示,病因、门静脉血栓、ApoA1、纤维蛋白原为再出血的独立危险因素(均P<0.05),见表2。整体模型χ2值为35.324,P<0.01。
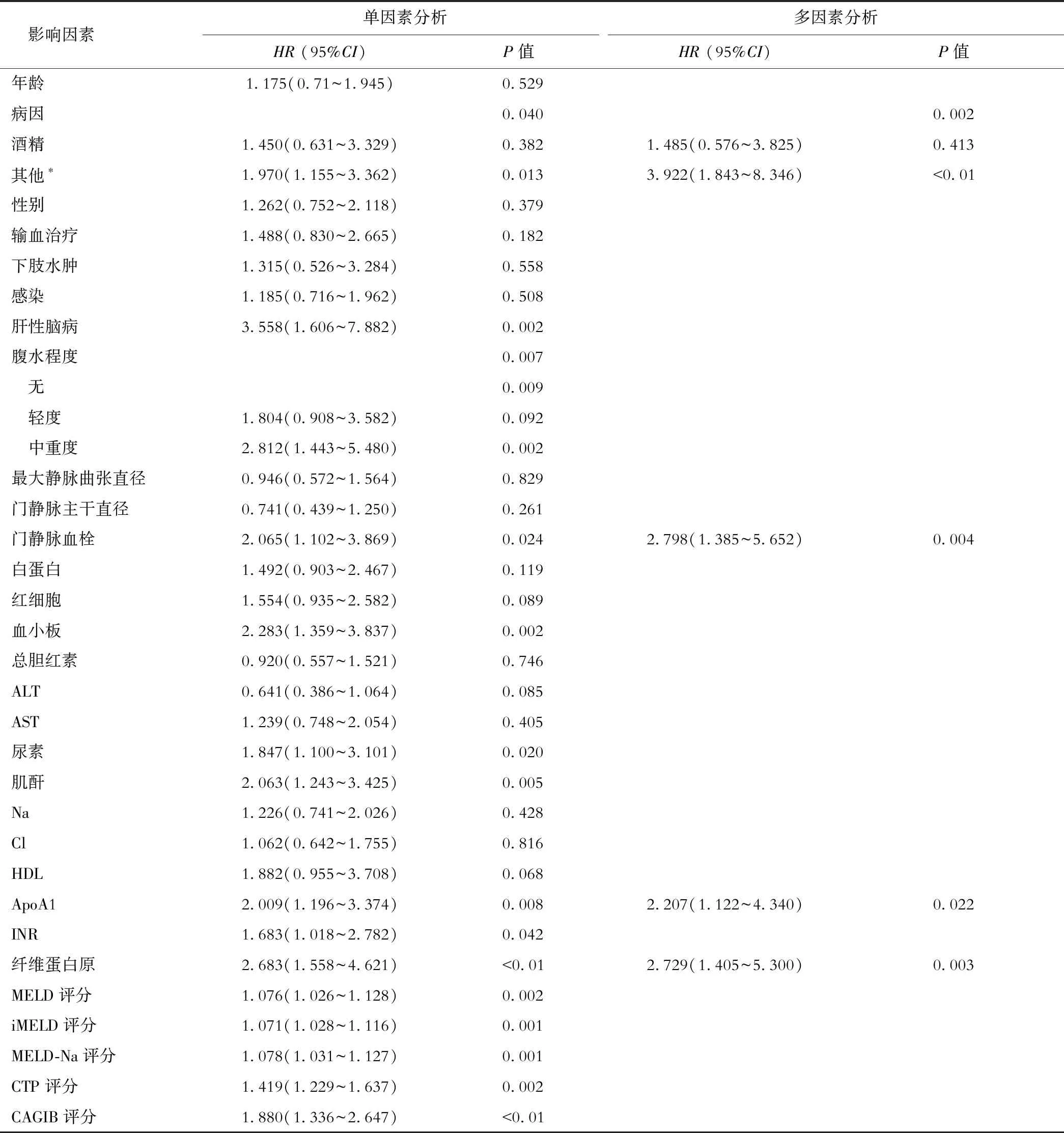
表2 COX回归分析肝硬化静脉曲张再出血的危险因素
三、ROC曲线分析
应用ROC曲线进行肝硬化静脉曲张再出血的预测性能,结果显示将纤维蛋白原与MELD、MELD-Na、iMELD、CTP及CAGIB评分联合后,诊断效率均高于单项评分,且将多因素回归分析中的独立危险因素病因、ApoA1、纤维蛋白原及门静脉血栓作为混合模型与纤维蛋白原联合各项评分比较,其AUROC 0.773预测性能最高,取最佳截断值0.44,灵敏度为0.575,特异度为0.742。见图1。单项评分(CTP、MELD、MELD-Na、iMELD及CAGIB)之间的AUROC比较均差异无统计学意义(P>0.05),但混合模型(病因、门静脉血栓、ApoA1、纤维蛋白原)与单项评分的预测价值存在的差异均有统计学意义(P<0.05),混合模型的预测价值比各单项评分高。
四、Kaplan-Meier曲线分析
多因素回归分析表明纤维蛋白原为再出血的显著预测因子,且通过纤维蛋白原的ROC曲线分析得出最佳截断值为1.5 g/L。根据最佳截断值(1.5 g/L)将纤维蛋白原进行分层并绘制Kaplan-Meier曲线,分析其对再出血时间的影响。结果显示,较低纤维蛋白原组(<1.5 g/L)的再出血风险明显高于较高组(≥1.5 g/L),可用于预测180 d再出血率,见图2。
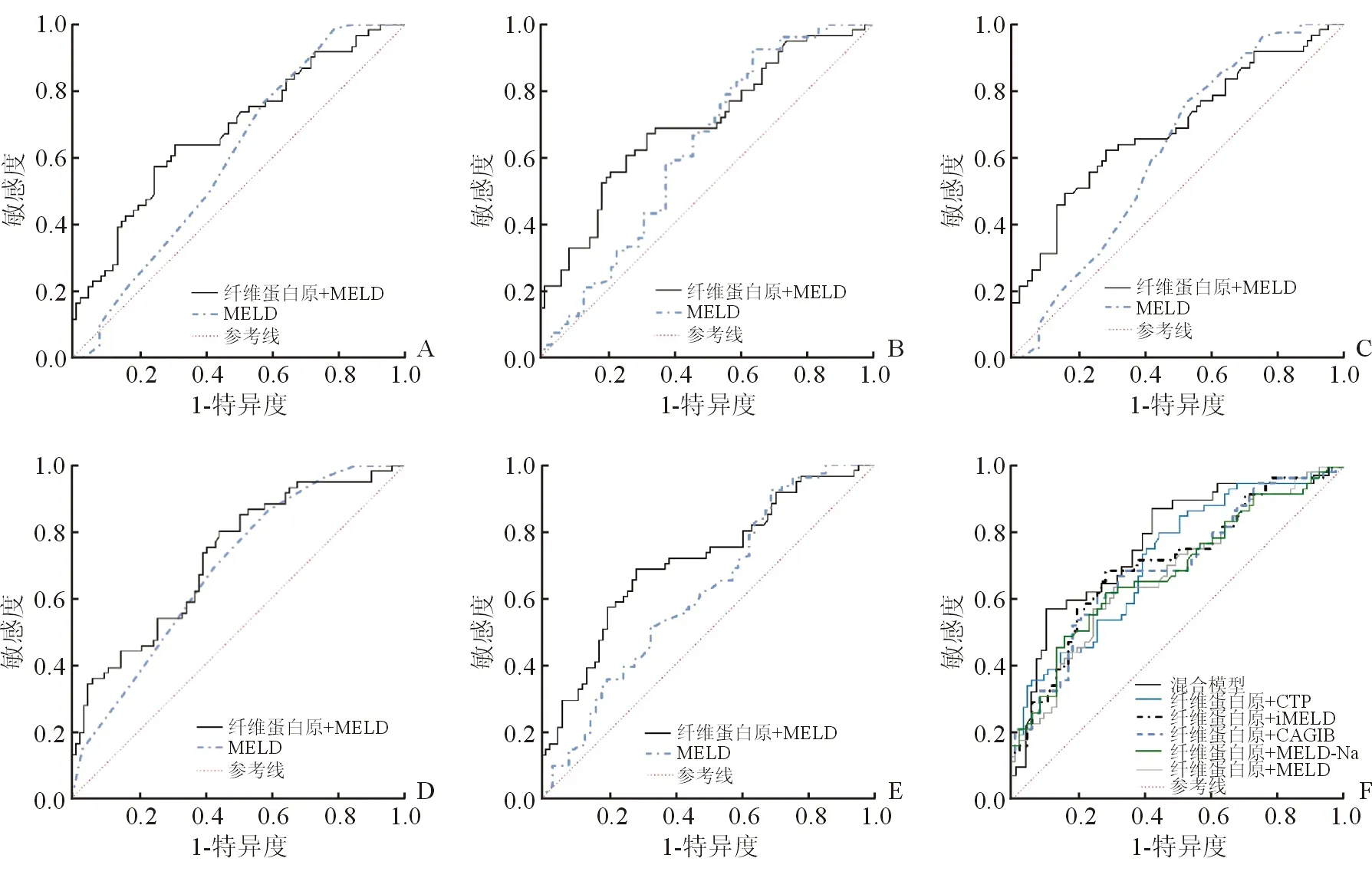
图1 ROC曲线分析
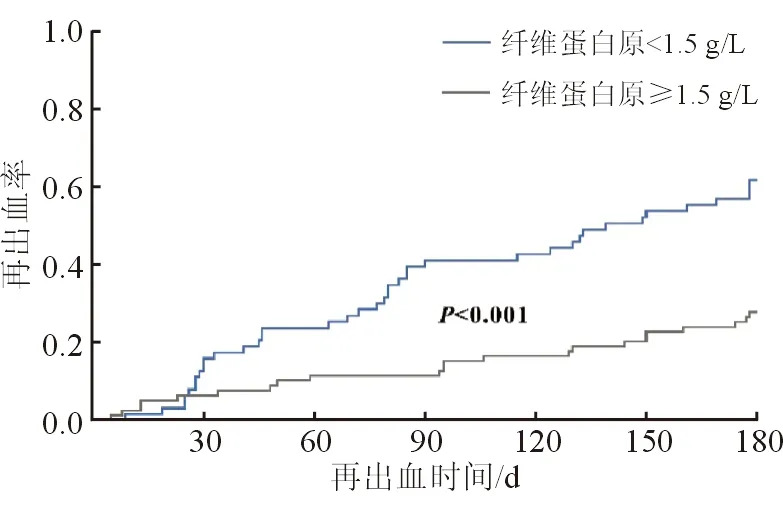
图2 肝硬化静脉曲张患者再出血风险
讨 论
本研究发现肝硬化病因、门静脉血栓、ApoA1及纤维蛋白原是肝硬化静脉曲张再出血的预测因子。此外,自身免疫性、胆汁型、血吸虫性等相较病毒性肝硬化,发生再出血的风险更高。一项多中心研究表明,急性失代偿期的肝硬化患者门静脉血栓的患病率高于非急性失代偿期的肝硬化患者(9.36%比5.24%)[10]。本研究合并门静脉血栓的患者发生再出血的风险比无门静脉血栓人群高2.798倍,提示在控制出血后,应及早对伴有门静脉血栓的EGVB患者行抗凝治疗以降低再出血的风险,这与我国肝硬化门静脉血栓管理指南一致[11]。HDL、LDL及ApoA1血清水平下降与肝硬化有关,并可随肝病进展进一步降低[12-14]。Trieb等[15]指出,无论有无慢加急性肝衰竭,HDL和ApoA1都是肝硬化失代偿患者90 d死亡的独立预测因子,而在本研究中,只有ApoA1在单因素及多因素分析中与再出血独立相关。此外,纤维蛋白原与再出血的相关性优于MELD评分中的INR,并能较好的提高当前单项评分的预测效能,Kaplan-Meier曲线也表明较低的纤维蛋白原血症患者再出血风险越高。近来有研究指出,在接受预防性内镜静脉曲张结扎术的患者中,术后30 d内出血组的纤维蛋白原水平更低,但与未出血组差异无统计学意义[16]。欧洲肝病协会也提示纤维蛋白原水平与食管静脉曲张结扎术后出血风险增加的相关性尚不确定[17]。文献报道,低纤维蛋白原水平与急慢性肝功能衰竭患者穿刺术后出血风险增加有关,且纤维蛋白原水平<60 mg/dl是1493例危重肝硬化患者新发大出血的独立预测因子[18,19]。
有研究指出血清氯水平是肝硬化患者短期病死率的独立负相关指标,并认为其预后价值可能会被纳入未来的肝硬化预后评分[20]。为此,本研究将血清氯水平纳入单因素回归评估其与肝硬化出血患者180 d内再出血的相关性,但未发现两者之间存在相关性。
综上所述,病因、门静脉血栓、ApoA1及纤维蛋白原是肝硬化静脉曲张出血患者180 d内再出血的独立危险因素,其联合的混合模型优于本研究中的MELD、MELD-Na、iMELD、CTP及CAGIB评分,且纤维蛋白原水平能提高其他评分的预测性能。为此,及早针对危险因素采取相关诊疗措施,有助于预防再出血的发生,但本研究样本量较少,还需在大样本、多中心的前瞻性的研究中进行验证。
利益冲突声明:所有作者均声明不存在利益冲突。

