乙型肝炎病毒相关肝细胞癌抗病毒治疗中国专家共识(2023年版)
国际肝胆胰协会中国分会中国抗癌协会肝癌专业委员会 中国研究型医院肝胆外科专业委员会 中国研究型医院病毒与肿瘤专业委员会
肝细胞癌(hepatocellular carcinoma,HCC)下文简称肝癌,是严重威胁人类健康的高发肿瘤,据WHO统计,肝癌是世界第5大常见癌症,也是导致癌症相关死亡的第2大原因[1]。肝癌高发是我国面临的严重公共卫生问题,每年全球新发肝癌病例中>50%来自我国[2]。 目前肝癌是我国第 4 位常见恶性肿瘤及第 2 位肿瘤致死病因[3-5]。尽管肝癌的诊断与治疗水平进步明显,但近20年肝癌死亡率并未明显降低。肝癌手术切除后 5 年肿瘤复发转移率高达 40%~70%。肿瘤复发、进展、转移,以及治疗过程中的肝衰竭是导致患者死亡的主要原因。
HBV感染是导致肝癌的最主要危险因素[6]。在非洲和东亚,60%的肝癌由HBV感染引起[1],而我国84%的肝癌由HBV感染导致[7]。多项研究证实抗病毒治疗可以明显降低乙型肝炎患者肝纤维化进展和肝癌发生率[8-12]。近年来的研究结果显示,对于已经发生HBV相关肝癌的患者,积极有效的抗病毒治疗可以改善肝功能,预防病毒再激活,降低肝癌根治性治疗后的复发率,从而显著改善HBV相关肝癌患者预后[13-19]。《慢性乙型肝炎防治指南(2019年版)》指出:HBV DNA阳性的肝癌患者接受抗HBV治疗可减少肝癌术后复发,HBsAg阳性而HBV DNA阴性肝癌患者接受抗癌治疗时则可能出现HBV再激活[20]。《原发性肝癌诊疗规范(2019年版)》中提到:抗病毒治疗可以有效减少HBV相关肝癌抗癌治疗后的肿瘤复发,改善患者预后[21]。《HBV相关肝细胞癌抗病毒治疗专家共识》将在此基础上,针对肿瘤不同分期、不同抗癌方案进一步总结国内外最新临床研究证据,帮助临床医师做出合理决策。
在总结国内外相关研究和充分体现多学科合作的基础上,提出HBV相关原发性肝癌诊断与治疗过程中的抗病毒治疗专家共识。依据国内外相关研究的进展,将不断修订和完善这一共识,以期更好地为HBV相关肝癌患者服务。
证据评价与推荐意见分级、制定和评价 (grading of recommendations, assessment, development and evaluation,GRADE)方法学是目前使用最广泛的证据评价和推荐意见分级系统[22]。GRADE分级系统包括两部分:第一部分为证据评价,根据证据体的偏倚风险、不一致性、间接性、不精确性和发表偏倚,将证据质量分为高、中、低和极低4种水平[23];第二部分为推荐意见分级,GRADE分级系统考虑医学干预的利弊平衡、证据质量、价值观念与偏好、以及成本与资源耗费等因素来制定推荐意见,并且将推荐意见分为强推荐和弱推荐(有条件推荐)2种[24]。医学干预的利弊差别越大,证据质量越高、价值观念与偏好越清晰越趋同、成本与资源耗费越小,则越应该考虑强推荐。反之,则应考虑弱推荐(有条件推荐)。本规范中的循证医学证据等级评估参照了上述GRADE分级系统的指导原则,采用了《牛津循证医学中心分级2011版》(OCEBM Levels of Evidence)作为辅助工具具体执行证据分级。 在从证据转换成推荐意见的方法上编写委员会主要参考了上述的GRADE分级系统对推荐意见分级的指导原则,但是同时结合了美国临床肿瘤协会(ASCO)指南的分级方案对推荐意见分级做了相应改编[25]。最终将推荐强度分为2个等级,分别是强推荐、弱推荐。 强推荐代表编写委员会对该推荐意见反映了最佳临床实践有很高的信心,绝大多数甚至所有的目标用户均应采纳该推荐意见。弱推荐代表编写委员会对该推荐意见反映了最佳临床实践有一定信心,但是应该有条件地应用于目标群体,强调医患共同决策(见表1)。
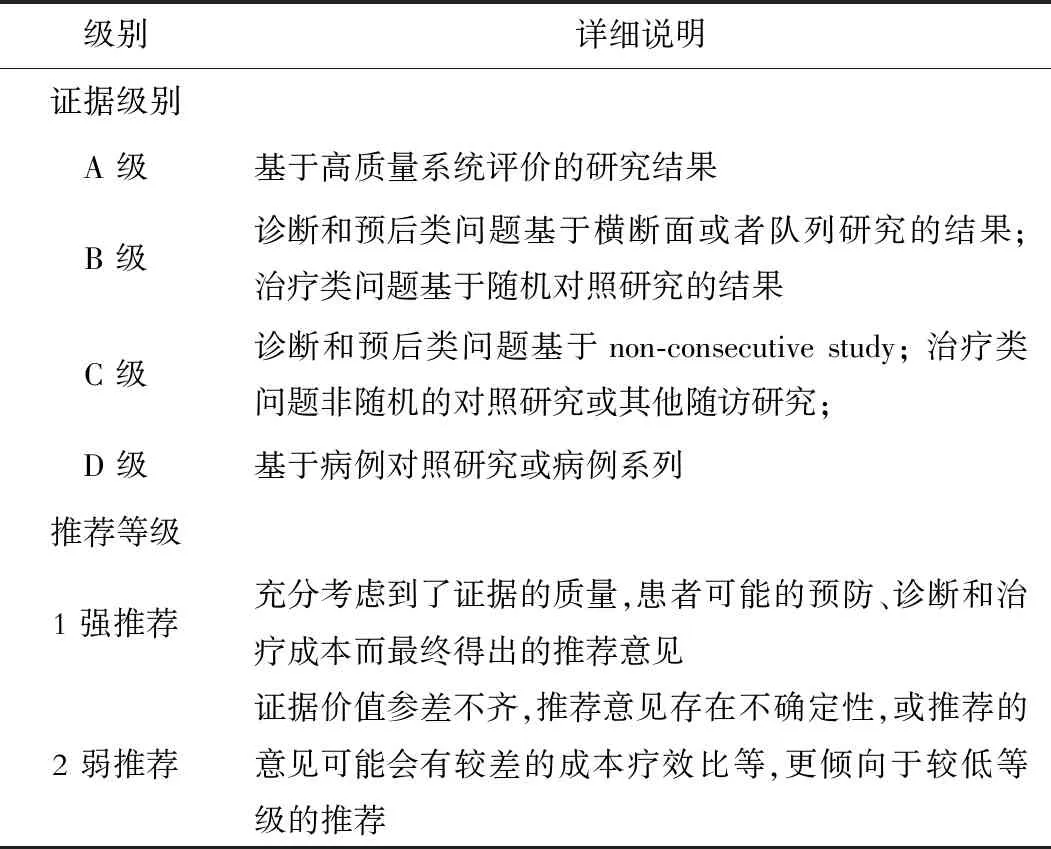
表1 推荐意见的证据等级和推荐等级
一、HBV相关肝癌患者抗病毒治疗目标
HBV相关肝癌患者抗病毒治疗目标:在针对肝癌的综合治疗基础上,最大限度长期抑制HBV DNA复制,减少HBV引起的肝脏损伤并阻止疾病进展,提供良好的肝功能基础,降低肝癌抗癌治疗后肿瘤复发风险,延长患者生存。
我国的肝癌患者中>80%为HBV相关肝癌。 HBV相关肝癌患者相较于非HBV相关肝癌患者,发生肝功能失代偿比例更高[26]。HBV DNA水平与抗癌治疗后短期及长期预后密切相关[27-30]。多项研究结果已证实,术前HBV DNA高水平是肿瘤复发和(或)肝衰竭的显著危险因素,而低病毒血症亦会对术后生存率造成不良影响,抗病毒治疗可以有效改善患者预后,预防HBV再激活、降低术后肿瘤复发、提高患者生存率[16,27, 31-32]。此外,HBsAg也是HBV感染的主要标志物之一,术前HBsAg高水平与肿瘤复发显著相关[33-34]。因此,早期筛查HBsAg发现HBV感染患者,采用高灵敏试剂检测HBV DNA水平,及时启动抗病毒治疗并根据疗效调整治疗方案,对患者预后具有重要意义。
二、抗病毒治疗适应证
HBsAg阳性的肝癌患者应立即启动抗病毒治疗。HBsAg阳性的肝癌患者未接受抗病毒治疗,在抗癌治疗过程中发生病毒再激活[35-36]。《慢性乙型肝炎防治指南(2019年版)》亦明确推荐HBsAg阳性的肝癌患者应当在开始抗癌治疗前预防性使用抗病毒药物治疗[20]。
对于既往HBV 感染患者,即抗-HBc阳性、HBsAg阴性的患者是否需要给予抗病毒治疗,目前仍存在争议。已有少数文献报道仅抗-HBc阳性的患者接受抗癌治疗后亦会出现HBV再激活,可引起伴或不伴肝损伤的HBV载量上升,甚至在某些情况下危及生命。抗病毒治疗可以有效抑制病毒复制,预防相关并发症的发生[37-39]。因此,对于这部分患者,抗肿瘤治疗前及治疗过程中应密切监测HBsAg、HBV DNA、ALT等指标变化。有关此类患者启用抗病毒药物治疗的最佳时机,目前还需进一步高质量的文献证据予以支持。
推荐意见1:对于所有确诊肝癌患者,应常规筛查HBsAg、抗-HBs和抗-HBc。对于HBsAg阳性或anti-HBc阳性患者,应进一步行血清HBV DNA定量检测(强推荐,证据级别A)。
推荐意见2:HBsAg阳性的肝癌患者,无论HBV DNA水平,建议立即启动抗病毒治疗(强推荐,证据级别A)。
推荐意见3:对既往HBV 感染,即抗-HBc阳性、HBsAg阴性的肝癌患者,应密切监测HBsAg、HBV DNA、ALT等指标变化(弱推荐,证据级别B)
三、HBV相关肝癌患者抗病毒治疗方案
(一)核苷(酸)类似物(nucleoside/nucleoside analogue,NAs)治疗 NAs主要通过阻断逆转录的过程抑制HBV DNA复制,与干扰素比较,NAs类药物总体抑制病毒能力强,安全性及耐受性好。已有大样本随机对照研究结果显示,NAs抗病毒治疗可显著改善HBV相关肝癌患者抗癌治疗后的无病生存期(disease-free survival,DFS)和总生存期(overall survival,OS)[15,18]。其机制可能是NAs通过抑制肝脏炎症活动及剩余肝脏的慢性炎症,从而降低再次发生肝癌风险。同时,肝功能的改善也提高了患者对于抗肿瘤治疗的耐受性[15]。NAs类药物可以根据抗病毒效能和耐药屏障进一步区分,目前一线抗病毒药物包括恩替卡韦(Entecavir, ETV)、富马酸替诺福韦酯(tenofovir disoproxil fumarate,TDF)、富马酸丙酚替诺福韦(Tenofovir alafenamide, TAF)、艾米替诺福韦(tenofovir amibufenamide,TMF);非一线药物包括拉米夫定(lamivudine,LAM)、阿德福韦(adefovir,ADV)和替比夫定(telbivudine,LdT)等。
已有研究结果显示,更快的病毒抑制可以改善肝癌患者远期预后[40]。因此,对于抗病毒初治患者,首选强效高耐药屏障药物。推荐采用一线抗病毒药物如ETV、TDF、TAF、TMF。
ETV: ETV可以强效抑制病毒复制,改善肝功能且有较高的安全性[11,41]。对于初治患者,ETV具有高耐药屏障,5年累积耐药发生率为1.2%,对于LAM经治患者,5年累积耐药率上升至51%[42]。曾有研究报道肝硬化患者使用ETV出现乳酸酸中毒,受损的肝脏与肾脏功能可能导致用药期间乳酸酸中毒风险显著增加[43]。
TDF:TDF可以强效抑制病毒复制,长期治疗有效抑制肝纤维化进展并可出现肝纤维化/肝硬化逆转[10]。一项长达10年的临床研究未发现TDF相关耐药产生[44]。然而,有报道TDF在治疗的人群中出现如急性肾衰竭或低磷血症等肾脏事件[45-47]。因此在接受TDF治疗之前及之后定期评估血清肌酐、磷、尿糖和尿蛋白等肾功能指标。
TAF:TAF与TDF均为TFV前体。全球III期临床试验结果显示,TAF同样具有强效抑制病毒的能力,且可显著改善肝脏功能(如ALT复常率更高)并且具有较好的骨肾安全性。尚未发现TAF相关耐药产生[48-49]。
TMF:TMF是第二代的替诺福韦前体药,采用ProTide技术对替诺福韦分子进行了磷酰胺酯化修饰。与第一代药物TDF比较,血浆半衰期更长,细胞内药物递送效率更高。在中国的49家研究中心开展了一项随机、双盲、非劣效性研究结果显示,TMF抗HBV的有效性不劣于TDF,ALT复常比例较高,并显示出更好的骨和肾脏安全性。尚未发现TMF相关耐药产生[50]。
对于存在骨肾疾病风险的患者(如年龄>60岁、长期使用类固醇药物、合并慢性肾脏疾病等),推荐首选ETV、TAF或TMF治疗,而非TDF。根据目前已上市的NAs药物说明书信息,TAF可用于除肌酐清除率(creatinine clearance ,CrCl)<15 mL/min且正在接受血液透析的不同程度肾损伤患者,并且无需调整药物使用剂量;而其他NAs药物在CrCl<50 mL/min时均需减量使用。
近期有研究结果显示,TDF较ETV可更有效地预防肝癌发生[51-52]。与接受ETV治疗的患者比较,接受TDF抗病毒治疗的肝癌患者术后肿瘤复发率更低、总生存率更高[53-55]。Zhang等[54]收集并观察233例伴肝硬化背景并行肝切除术的HBV相关肝癌患者,其中107例接受TDF治疗,126例接受ETV治疗;随访期间,174例(74.68%)患者发生肝癌复发,47例患者死亡。TDF组和ETV组中位DFS分别为33个月和24个月(P<0.05),多因素分析发现,接受TDF治疗与更低的肝癌复发率显著相关(HR为0.35,95%CI为0.33~0.84)。Choi等[53]收集1 695例巴塞罗那肝癌临床分级为0或A级并行肝切除术的HBV相关肝癌患者,术后分别接受ETV(813例)或TDF(882例)治疗,经过倾向性评分匹配配对后进行多因素分析。其结果显示,TDF组较ETV组有更低的肝癌复发率(HR=0.82, 95%CI为0.68~0.98,P=0.03)和病死/肝移植率(HR=0.62, 95%CI为0.44~0.88,P=0.01);TDF是HBV相关肝癌早期(<2年,HR=0.79,P=0.03)或晚期(≥2年,HR为0.68,P=0.03)复发的独立保护因素。TMF、TAF与TDF均为TFV的前体药物,有关TFV在改善HBV相关肝癌患者抗癌治疗预后方面是否优于ETV,仍然需要更高等级临床研究进一步论证。
对于已接受非一线抗病毒药物治疗的肝癌患者,建议换用一线抗病毒药物(ETV、TDF、TAF、TMF)治疗:(1)ADV单药治疗的患者,随着用药时间延长,发生骨肾损伤风险增大,建议调整为ETV、TAF或TMF治疗。(2) LAM或LdT单药治疗的患者,长期用药存在耐药风险,尤其是治疗后仍处于低病毒血症的患者,建议换用TDF、TAF或TMF治疗。(3)LAM应答不佳联合ADV治疗的患者,随着治疗时间延长耐药风险增加,建议调整为TDF、TAF或TMF治疗。若患者同时合并骨肾损伤风险,建议换用TAF或TMF治疗。(4)ADV应答不佳联合LAM治疗的患者,由于存在较高的骨肾损伤风险,建议换用ETV、TAF或TMF治疗。(5)LdT联合ADV治疗的患者,随着治疗时间延长耐药风险增加,建议调整为TDF、TAF或TMF治疗。若患者同时合并骨肾损伤风险,建议换用TAF或TMF治疗。(6)ETV联合ADV治疗的患者,若仍处于低病毒血症或应答不佳,建议调整为TDF、TAF或TMF治疗。若患者同时合并骨肾损伤风险,建议换用TAF或TMF治疗[20,56]。
推荐意见4:HBV相关肝癌患者推荐使用一线抗病毒药物ETV、TDF、TAF或TMF(强推荐,证据级别A)。
推荐意见5:对于既往或目前接受非一线抗病毒药物治疗的肝癌患者,建议换用一线抗病毒药物降低耐药风险和(或)骨肾损伤风险。 含LAM或LdT治疗方案的患者建议换用TDF、TAF或TMF治疗;含ADV治疗方案的患者建议换用ETV、TAF或TMF治疗(强推荐,证据级别B)。
(二)干扰素治疗 干扰素治疗主要包括普通干扰素(IFN-α-2b)和聚乙二醇干扰素(Peg-IFN-α-2a),均为较强的免疫调节剂。干扰素可促进宿主免疫细胞的活性并诱导干扰素刺激基因的产生,后者直接编码抗病毒效应蛋白[57]。既往研究结果显示,与未治疗比较,干扰素治疗可显著降低肝癌发生率[58-59]。然而,干扰素治疗对HBV相关肝癌患者抗癌治疗后预后的影响目前结论尚不一致[60-63]。
Xu等[64]的Meta分析结果显示,并非所有HBV相关肝癌患者可从干扰素治疗中获益,只有病灶长径<3 cm的患者接受干扰素治疗后肿瘤复发率降低(RR=0.50, 95%CI为0.35~0.72,P<0.01)。Yang等[65]系统性回顾分析结果显示,干扰素联合TACE治疗可使患者明显获益,但对于行肝切除术的患者应用干扰素并未明显降低复发率或病死率。Zuo等[66]回顾性收集228例行肝切除术的HBV相关肝癌患者的临床资料,术后126例接受TACE治疗,102例接受TACE联合干扰素治疗。其结果显示,TACE联合干扰素治疗患者OS明显长于TACE治疗(24.5个月比36.3个月,P<0.05)。此外,TACE联合干扰素治疗患者3年和5年复发率亦显著降低(P<0.05)。Qi等[67]进行了一项前瞻性随机对照研究,探讨干扰素联合ETV治疗对DFS和OS的影响。其结果显示,切除和(或)RFA术后立即应用干扰素联合ETV治疗较1年后再进行干扰素联合ETV治疗或单用ETV治疗具有更好的疗效;术后早期联合治疗患者术后2年和8年的DFS更长,8年的总生存率更高(P<0.05);术后早期联合治疗患者HBsAg如在第48周时较基线下降>1 500 IU/mL,则预示着更低的复发率和病死率。
干扰素应用前必须掌握药物的绝对和(或)相对禁忌证,干扰素治疗过程中需密切监测药物相关不良事件的发生。考虑干扰素治疗前应仔细评估患者的HBV感染状态、肝硬化程度及全身情况,对于治疗前HBsAg低水平(<1 500 IU/mL)的患者,建议使用干扰素治疗,对伴有肝硬化患者不建议使用干扰素治疗[68-71]。单独使用干扰素抗病毒治疗,或与NAs联合应用改善HBV相关肝癌患者预后的疗效,仍需要更多更高等级临床研究进一步证实。
推荐意见6:对于HBV相关肝癌患者,若无Peg-IFN 应用禁忌证,且HBsAg<1 500 IU/mL的患者,可应用Peg-IFN 或Peg-IFN 联合NAs治疗(弱推荐,证据级别A);Peg-IFN 联合高效高耐药屏障NAs治疗可延长OS(弱推荐,证据级别B)。
四、不同抗癌治疗方案中HBV相关肝癌患者的抗病毒治疗策略
根据国内外肝癌诊断与治疗规范,肝癌患者基于其肿瘤大小、有无血管侵犯、肝内外转移情况及肝功能等,分为早、中、晚期及终末期。各期患者依据指南推荐选择合理的抗癌治疗方案。抗病毒治疗作为HBV相关肝癌综合治疗方案的重要组成部分,其治疗应贯穿于抗癌治疗的各个时期。
(一)接受肝切除术的HBV相关肝癌患者抗病毒治疗策略 对于早期肝癌患者,肝切除术是最主要的根治性治疗手段。有研究结果显示,肝切除术后5年总生存率可达60%[72-73]。术后肝功能恢复障碍以及肿瘤复发仍是导致围手术期及远期患者死亡的最重要原因。对于HBV相关肝癌患者,术前HBV感染状态与术后肿瘤复发密切相关:术前HBsAg阳性、HBV DNA高水平或HBsAg高水平均显著增加术后肿瘤复发风险,降低远期生存率[33-34]。肝切除手术可导致HBV再激活,从而增加术后肝衰竭发生风险。而术前积极抗病毒治疗可以有效预防HBV再激活,保护患者肝功能,降低术后肝衰竭发生率[36]。
2项前瞻性RCT证实,对于接受肝切除术的HBV相关肝癌患者,无论术前HBV DNA处于高水平抑或是低水平,及时和长期的NAs抗病毒治疗均可有效预防HBV再激活、降低术后肿瘤复发风险,改善患者的远期生存且耐受良好[15-16]。相关meta分析也发现,NAs抗病毒治疗可以减少HBV相关肝癌术后复发,改善预后[74-78]。Yuan等[77]的荟萃分析纳入15项研究,收集8 060例患者的临床资料。其结果显示,与未抗病毒治疗组比较,术后NAs抗病毒治疗组可显著降低肿瘤复发率(1年:RR=0.41,P<0.000 01; 3年:RR=0.63,P=0.001)并提高1、3、5年总生存率及无病生存率。一项meta分析收集9 009例HBV相关肝癌患者(2 546例接受抗病毒治疗、6 463 例未接受抗病毒治疗)的临床资料。其结果显示,抗病毒治疗可显著提高患者OS(HR=0.58,95%CI为0.51~0.67,P=0.000 01)和DFS(HR=0.68,95%CI为0.63~0.74,P<0.000 01);亚组分析结果显示,抗病毒治疗可显著延长基线HBV DNA高载量(>20 000 IU/mL)患者术后OS(HR=0.69,95%CI为0.52~0.92,P=0.01)和DFS[78]。
接受肝切除术治疗的HBV相关肝癌患者当检测发现HBsAg阳性时立即启动抗病毒治疗。肝癌术前90 d甚至更早开始抗病毒治疗有利于降低肿瘤微血管侵犯,改善预后[79]。此外,对于HBV感染导致肝功能异常患者,抗病毒治疗亦可改善患者肝功能状态,使患者尽早符合择期手术治疗要求。对于肝功能失代偿患者(Child-Pugh B/C级),应待肝功能恢复至Child-Pugh A再行手术治疗,避免由于肝脏炎症导致的术中出血增加及术后肝功能恢复障碍[21]。对于伴有肝功能异常(ALT>2 ULN)的患者,应尽快给予抗病毒治疗的同时给予保肝治疗以最大限度避免术后病毒再激活及肝衰竭[36]。
推荐意见7:HBsAg阳性肝癌患者接受肝切除术前,应尽早启动ETV、TDF、TAF或TMF抗病毒治疗。术前肝功能失代偿患者,可在抗病毒治疗基础上给予保肝等对症支持治疗,待肝功能好转后择期手术治疗。(强推荐,证据级别B)
(二)接受TACE治疗的HBV相关肝癌患者抗病毒治疗策略 TACE是肝癌非手术治疗中常用方法之一。然而,TACE治疗也可导致HBV再激活以及肝脏炎症暴发。一项纳入11项研究的荟萃分析结果显示,无论是HBeAg阳性还是阴性患者,TACE 治疗均可显著增加HBV相关肝癌患者HBV再激活(OR=3.70,95%CI为1.45~9.42,P<0.01)以及肝脏炎症暴发(OR=4.30; 95%CI为2.28~8.13,P<0.01)风险[80]。即使是在HBsAg阴性的患者中,TACE治疗亦可重新激活HBV复制,并且治疗强度与病毒重新激活之间存在剂量-风险关系。一项纳入109例HBsAg阴性肝癌患者的回顾性研究结果显示,高强度TACE治疗(如多药联合TACE、多药联合TACE+放疗)相较于低强度TACE治疗(单药TACE)显著增加HBV再激活风险(37.8%、44.3% 比6.2%,aHRs 为4.63、10.91比1)。此外,该研究还发现既往确诊过慢性乙型肝炎患者接受TACE治疗后,相较于既往未确诊过慢性乙型肝炎患者HBV再激活风险增加[81]。
TACE治疗前HBV DNA高水平与治疗引起的病毒再激活密切相关,预防性抗病毒治疗可以有效降低再激活风险,显著改善患者预后[80,82-84]。一项回顾性研究结果显示,108例HBV相关肝癌患者经TACE治疗后,42例(38.9%)出现HBV再激活。基线HBV DNA≥104拷贝/mL组的患者HBV再激活率为65.8%(25/38),显著高于基线HBV DNA<104拷贝/mL组的24.3%(17/70)[84]。一项前瞻性研究纳入98例HBV DNA阴性的HBV相关肝癌患者分为抗病毒治疗组和未抗病毒治疗组,其结果显示,抗病毒治疗组5.9% (3/51)发生HBV再激活,显著低于未接受抗病毒治疗组23.4%(11/47)(P<0.05)[85]。
推荐意见8:HBsAg阳性肝癌患者,接受TACE治疗时应尽早启动抗病毒治疗,推荐使用一线抗病毒药物ETV、TDF、TAF或TMF(强推荐,证据级别B)。HBsAg 阴性、抗-HBc阳性的肝癌患者,接受高强度TACE治疗(如多药联合TACE、多药联合TACE+放疗),建议启动ETV、TDF、TAF或TMF抗病毒治疗。(弱推荐,证据级别C)
(三)接受肝动脉灌注化疗(hepatic arterial infusion chemotherapy,HAIC)治疗的HBV相关肝癌患者抗病毒治疗策略 HAIC是广泛应用于中晚期肝癌的治疗方法之一。采用FOLFOX 方案(奥沙利铂+亚叶酸钙+氟尿嘧啶)的HAIC治疗是晚期肝癌患者的一线治疗方案[86-87]。HAIC治疗可导致HBV再激活,而抗病毒治疗可以有效预防HBV再激活[87]。一项回顾性研究纳入了170例HBsAg阳性晚期肝癌患者,均采用FOLFOX方案HAIC治疗,其中137例患者同时接受预防性抗病毒治疗。最终共有25例(14.7%)患者在HAIC治疗后发生HBV再激活,预防性抗病毒治疗组HBV再激活率为11.7%(16/137)显著低于未抗病毒治疗组的27.3%(9/33),(OR=12.35, 95%CI为4.35~33.33,P<0.001)。该研究中,预防性抗病毒治疗组约有40%患者不定期服用抗病毒药物,这可能是导致该组HBV再激活发生率较高的原因。此外,预防性抗病毒组OS较未抗病毒组显著延长( 16.46个月比10.68个月,HR=0.57,95%CI为0.36~0.91,P<0.05)[87]。
推荐意见9:HBsAg阳性肝癌患者,接受HAIC治疗时应尽早启动抗病毒治疗,推荐使用一线抗病毒药物ETV、TDF、TAF或TMF治疗。(弱推荐,证据级别C)
(四)接受放射治疗的HBV相关肝癌患者抗病毒治疗策略 放射治疗也是肝癌有效的局部治疗方法,尤其是伴有门静脉、下腔静脉癌栓或肝外转移的 IIIa 期、IIIb 期肝癌患者,放射治疗有着较好的疗效。部分患者经放疗后肿瘤缩小或降期,可重获手术治疗机会。HBsAg阳性的HBV相关肝癌患者接受放射治疗,可能出现HBV再激活,且HBV DNA水平与病毒活化密切相关,预防性抗病毒治疗可以有效降低再激活风险[88-89]。HBsAg阴性、 抗-HBc阳性患者在放疗治疗过程中应当严密监测HBV DNA、HBsAg及ALT水平的变化[90]。
一项回顾性研究纳入133例接受放疗的HBsAg阳性肝癌患者,将患者分为未预防性抗病毒治疗组(27例)和抗病毒治疗组(106例)。其结果显示,17例(12.7%)患者在放疗后出现HBV再激活,抗病毒治疗组HBV再激活率显著低于未抗病毒治疗组(7.5%比 33.3%,P<0.001);抗病毒治疗组肝炎发生率也较对照组明显降低(3.8% 比14.8%,P= 0.031)[88]。
推荐意见10:HBsAg阳性肝癌患者,接受放射治疗时应尽早启动抗病毒治疗,推荐使用一线抗病毒药物ETV、TDF、TAF或TMF治疗。(弱推荐,证据级别C)
(五)接受靶向治疗的HBV相关肝癌患者抗病毒治疗策略 索拉非尼、仑伐替尼是批准用于治疗晚期肝癌的一线分子靶向药物。在接受索拉非尼治疗的晚期HBV相关肝癌患者中,基线HBV DNA高载量与病毒再激活相关,是生存的不利预后因素,而使用抗病毒治疗后患者生存率显著提高[91-93]。
一项多中心、回顾性研究纳入了130例接受索拉非尼治疗的晚期HBV相关肝癌患者。其结果显示,靶向治疗前HBV DNA≤104拷贝/mL的患者中位OS显著优于基线HBV DNA>104拷贝/mL的患者(10.4个月比6.6个月,P=0.002)。接受抗病毒治疗的患者相比未治疗的患者可获得更好OS(12.0个月比8.3个月,P=0.058)。多因素分析结果显示,HBV DNA>104拷贝/mL(HR=2.294,95%CI为1.429~3.676,P=0.001)和抗病毒治疗(HR=0.617,95%CI为0.390~0.975,P=0.038)是OS的独立预测因子[91]。在另一项回顾性研究中,索拉非尼治疗前HBV DNA高水平(HBV DNA>2 000 IU/mL)与病毒再激活、总生存率降低(HR=2.85,P=0.005)以及疾病进展(HR=87.4,P=0.008)密切相关。未接受预防性抗病毒治疗的患者较接受抗病毒治疗的患者更容易发生HBV再激活(4/38比0/40,P=0.025)[92]。NAs抗病毒治疗可以显著改善索拉非尼治疗的HBV相关肝癌患者生存率。一项回顾性研究纳入151例接受索拉非尼治疗的HBV相关肝癌患者,其结果显示,NAs治疗组(88例)较未治疗组(63例)显著延长中位OS(16.47个月比13.10个月,P=0.03)以及降低死亡风险(HR=0.67, 95%CI为0.46~0.98,P=0.04)[93]。
推荐意见11:HBsAg阳性的肝癌患者,接受靶向治疗的同时进行抗病毒治疗,推荐使用一线抗病毒药物ETV、TDF、TAF或TMF治疗。(弱推荐,证据级别C)
(六)接受免疫治疗的HBV相关肝癌患者的抗病毒治疗策略 肝癌的免疫治疗主要指免疫检查点阻断剂(immune checkpoint inhibitors,ICI)。PD-1 / PD-L1是在B细胞、T细胞、树突状细胞和自然杀伤T细胞中表达的一种免疫抑制分子,可抑制抗癌免疫,并且已被发现与肝癌的病程、HBV感染相关[94-95]。已有文献报道,接受抗PD-1/PD-L1治疗的HBV相关肝癌患者有HBV再激活风险[96]。即使低HBV DNA肝癌患者接受抗PD-1/PD-L1治疗也仍有发生HBV再激活风险[97]。预防性抗病毒治疗可显著减少HBV再激活并降低HBV相关肝炎暴发风险[98]。
一项回顾性研究纳入114例HBsAg阳性、HBV DNA阴性并接受抗PD-1/PD-L1治疗的肿瘤患者,其中85例患者在接受抗PD-1/PD-L1治疗前启动预防性抗病毒治疗[94]。其结果显示, 6例患者发生HBV再激活,其中5例未接受抗病毒治疗, 1例接受ETV预防性治疗并发生HBV再激活,考虑可能与ETV耐药有关。HBV再激活时,5例患者同时出现HBV相关性肝炎;进一步分析结果显示,未抗病毒治疗是HBV再激活的唯一显著危险因素(OR为17.50, 95%CI为1.95~157.07,P=0.004)。另一项回顾性研究中,随访了62例接受了ICIs治疗的患者,其中35例患者基线HBV DNA≤100 IU/mL并在ICI治疗同时接受NAs抗病毒治疗,该组患者未发生HBV再激活;19例患者HBV DNA>100 IU/mL并在ICI治疗同时接受NAs抗病毒治疗,研究过程中同样未发生HBV再激活;另有6例未接受NAs抗病毒治疗的患者,其中1例患者在ICI治疗后第9周出现HBV再激活[96]。值得注意的是,上述研究中,发现HBV激活可发生在免疫治疗结束后第6周,这意味着ICI作用持续可超过治疗期。目前指南建议在最后一剂免疫抑制剂或化疗结束后,抗病毒治疗持续时间≥6个月。然而对于接受ICI治疗的患者,抗病毒治疗的最佳持续时间尚不清楚。
推荐意见12:HBsAg阳性的肝癌患者,接受抗PD-1/PD-L1治疗的HBV相关肝癌患者有HBV再激活风险,预防性抗病毒治疗可显著减少HBV再激活并降低HBV相关肝炎暴发风险, 推荐使用一线抗病毒药物ETV、TDF、TAF或TMF治疗。(弱推荐,证据级别C)
(七)接受肝移植的HBV相关肝癌患者的抗病毒治疗策略 国内外指南对于慢性HBV感染的肝移植患者有较为明确的推荐意见。所有将要进行肝脏移植的HBsAg阳性患者均应启动NAs抗病毒治疗,联合或不联合乙肝免疫球蛋白;HBsAg阴性患者,接受HBsAg阴性但抗-HBc阳性移植物时,应当接受长期抗病毒治疗以预防病毒再激活。抗病毒治疗应终身使用[20-21,90,99]。
推荐意见13:所有将要进行肝移植的HBsAg阳性患者都应当启动NAs抗病毒治疗;HBsAg阴性患者,接受HBsAg阳性或HBsAg阴性但抗-HBc阳性移植物时,应当接受长期抗病毒治疗以预防病毒再激活(强推荐,证据级别A)。
五、抗病毒治疗疗程
(一) NAs治疗 对于HBsAg阳性的HBV相关肝癌患者建议长期使用NAs抗病毒治疗。由于目前已有的抗病毒药物均无法彻底清除肝细胞内HBV共价闭合环状DNA(cccDNA),而长期抗病毒治疗能够最大限度地抑制HBV DNA复制,持续控制肝脏炎症,逆转非癌组织的纤维化,改善患者长期预后[21,90,100]。伴有肝硬化的慢性乙型肝炎患者停止NAs抗病毒治疗后,43.6%的患者出现肝炎暴发,严重者甚至威胁生命[101]。由于目前尚无确切可靠的指标预测NAs停药后患者预后,因此,为了避免病毒再激活及其可能引起的肝功能失代偿,对于已经发生肝癌的患者,建议长期使用NAs抗病毒治疗。对于HBsAg阴性、抗-HBc阳性患者,预防性抗病毒治疗应在抗癌治疗结束后继续使用NAs疗≥12个月,之后再进行个体化治疗[102]。
(二)干扰素治疗 干扰素的治疗疗程在参考慢性乙型肝炎患者治疗指南的同时应充分考虑肝癌患者抗病毒治疗的特殊性,目前以推荐干扰素联合NAs抗病毒治疗为主,不建议单独应用干扰素治疗。干扰素联合NAs抗病毒治疗的疗程,目前暂时没有较好的循证医学证据,考虑不良反应和成本效益,建议疗程以48周为宜,≤96周。Peg-IFN-α-2a 治疗24周时,若HBsAg定量>2×104IU/mL且HBV DNA下降<2 lg IU/mL(HBeAg阳性)或HBsAg下降<1 lg IU/mL且HBV DNA下降<2 lg IU/mL(HBeAg阴性),建议停用Peg-IFN-α-2a[68]。
推荐意见14:HBV相关肝癌患者建议长期(终身)使用NAs抗病毒治疗(弱推荐, 证据级别B)
六、HBV相关肝癌患者抗病毒治疗随访与监测
抗癌治疗后接受NAs抗病毒治疗的患者,必须重视随访监测,每3~6个月检测病毒学、血生化等指标以及影像学检查(腹部超声、CT/MRI)[21]。未接受抗病毒治疗的患者,应定期每3~6个月检测HBV DNA、HBsAg、ALT等指标以及进行影像学检查(腹部超声、CT/MRI)[90]。病毒再激活常发生在停止抗病毒治疗后。因此,应密切监测HBV DNA及ALT水平,在停止抗病毒治疗后的前3个月至少每月监测1次,之后每3个月监测1次。定期随访监测有助于评估抗病毒治疗的疗效并及时调整治疗、有效预防病毒再激活及肝炎暴发。
一项回顾性研究纳入 565 例HBV相关肝癌患者,并根据随访期间 HBV DNA 变化分为持续病毒学抑制组(HBV DNA<9 IU/mL)和低病毒血症组,其结果显示,相较于得到持续病毒学抑制的患者,伴有低病毒血症的 HBV 相关肝癌患者在随访期间肝炎急性发作的发生率显著升高,并且与较差的总生存率相关[32]。此外,我国一项研究结果:显示,经过抗病毒治疗但HBV DNA仍处于低水平阳性的患者(多数患者 HBV DNA 水平为 20~200 IU/mL)相较于获得完全病毒学抑制(HBV DNA<20 IU/mL)的患者肝纤维化进展风险显著增高(HR=4.84, 95%CI为1.30~17.98,P=0.019)[103]。一项韩国的回顾性研究比较了低病毒血症(low level viremia LLV)与持续病毒学抑制(HBV DNA<12 IU/mL)的患者,其结果显示,LLV患者5年肝癌累积发生率显著增高(14.3% 比7.5%,P=0.015),LLV是肝癌 发生的独立预测因素 (HR=1.98, 95%CI为1.28~3.06,P=0.002)[104]。综合以上研究结果,推荐随访监测过程中使用高灵敏试剂(最低检测下限10~20 IU/mL),对于处于低病毒血症的患者,及时调整抗病毒治疗药物,最大限度抑制病毒复制。AASLD 2018建议接受ETV或TDF/TAF单药治疗的过程中,若 HBV DNA较最低点升高> 1 log,或者经治疗后达检测下限(<10 IU / mL)后,HBV DNA再次≥100 IU/mL,更换为另一种抗病毒单药治疗或增加一种抗病毒药物[90]。多项真实世界研究结果显示,>1/5一线抗病毒药物治疗的患者存在低病毒血症, ETV 经治 LLV 患者换用 TAF 后,病毒学抑制率、ALT 复常率及肝脏硬度均得到改善[103-104]。
推荐意见15:接受NAs抗病毒治疗的患者,每3~6个月检测病毒学、血生化等指标;未接受抗病毒治疗的患者,每1~3个月检测HBV DNA、HBsAg及ALT等指标(弱推荐,证据级别B)。推荐使用高灵敏血清HBV DNA检测,及时发现低病毒血症的患者,调整抗病毒药物,最大限度抑制病毒复制(弱推荐, 证据级别B)。
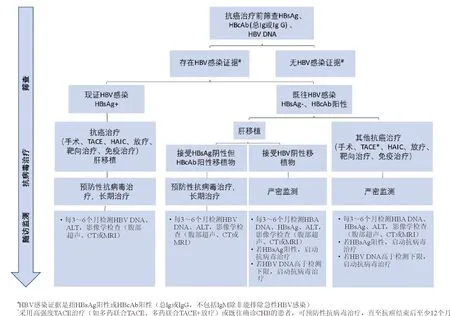
图1 HBV相关肝癌抗病毒治疗流程图
编写委员会专家(按姓氏汉语拼音排序):
陈成伟(解放军海军第905医院)
陈拥军(上海交通大学医学院附属瑞金医院)
陈孝平(华中科技大学同济医学院附属同济医院)
蔡伟(上海交通大学医学院附属瑞金医院)
董家鸿(北京清华长庚医院)
樊嘉(复旦大学附属中山医院)
傅青春(上海市公共卫生临床中心)
贺佳(海军军医大学统计学教研室)
黄罡(海军军医大学附属东方肝胆外科医院)
江建宁(广西医科大学第一附属医院)
陆伦根(上海交通大学附属第一人民医院)
李欣(南方医科大学深圳医院)
毛杰(兰州大学第二医院)
孟岩(海军军医大学附属东方肝胆外科医院)
孙剑(南方医科大学附属南方医院)
王鲁(复旦大学附属肿瘤医院)
王建华(复旦大学附属中山医院)
王俊学(海军军医大学附属长征医院)
王葵(海军军医大学附属东方肝胆外科医院)
吴志峰(复旦大学附属中山医院)
许洁(上海交通大学医学院附属第九人民医院)
徐军明(上海交通大学附属第一人民医院)
谢青(上海交通大学医学院附属瑞金医院)
杨业发(海军军医大学附属东方肝胆外科医院)
叶胜龙(海军军医大学附属东方肝胆外科医院)
袁振刚(海军军医大学附属东方肝胆外科医院)
翟博(上海交通大学医学院附属仁济医院)
周俭(复旦大学附属中山医院)
钟林(上海交通大学附属第一人民医院)
张继明(复旦大学附属华山医院)
张建军(上海交通大学医学院附属仁济医院)
周伟平(海军军医大学附属东方肝胆外科医院)
执笔:
黄罡(海军军医大学附属东方肝胆外科医院)
谢青(上海交通大学医学院附属瑞金医院)
贺佳(海军军医大学统计学教研室)
孙剑(南方医科大学附属南方医院)
利益冲突声明:所有作者均声明不存在利益冲突。

