脱酰胺马铃薯蛋白乳液的制备及其微流变特性
刘兴丽,魏莹莹,张艳艳,王宏伟,冯志强,张 华,
(1.郑州轻工业大学食品与生物工程学院,河南省冷链食品质量安全控制重点实验室,河南 郑州 450002;2.三全食品股份有限公司,河南 郑州 450000)
马铃薯是世界上仅次于小麦、水稻和玉米之后的第4大粮食作物[1]。马铃薯蛋白为完全蛋白质,由19 种氨基酸组成,其中必需氨基酸含量为20.1%,占氨基酸总量的47.9%,与鸡蛋蛋白相当,且致敏蛋白含量较少,赖氨酸比例高,是极具潜力的食品蛋白来源[2]。随着植物蛋白越来越受到重视,马铃薯蛋白作为优质的植物蛋白资源被广泛应用于食品工业。然而,作为马铃薯淀粉生产过程中的副产物,马铃薯蛋白在回收过程中易受到高强度热处理的影响而使其功能性质遭到破坏,如乳化性、溶解性、起泡性等降低[3],进而限制了其在食品行业中的进一步应用。马铃薯蛋白在液态食品的应用中易发生乳化稳定性不佳,体系失稳现象,主要表现为油水分离、脂肪球上浮与蛋白质沉淀等,严重影响食品品质。为了解决乳液的失稳问题,食品工业实际生产加工中常常通过加入乳化剂、增稠剂和品质改良剂等食品添加剂,达到控制乳制品稳定性的目的。
脱酰胺是一种常用且有效的改性方法。通过增加蛋白质表面的负电荷改善食物蛋白质的溶解度和其他功能特性[4]。脱酰胺改性主要分为物理法脱酰胺、化学法脱酰胺和酶法脱酰胺。与化学法、物理法脱酰胺相比,酶法脱酰胺具有高特异性、效率高、条件温和及安全等优点[5]。谷氨酰胺酶是一种食品级商业酶,没有谷氨酰胺转氨酶的交联作用,也没有蛋白酶的水解作用,它只作用于蛋白质和多肽中的谷氨酰胺基团[6]。谷氨酰胺酶已被用来修饰多种植物蛋白,如大米蛋白、豌豆蛋白、面筋蛋白和大豆蛋白。Liu Yongle等[7]证明谷氨酰胺酶脱酰胺能显著提高大米谷蛋白在温和酸性(pH 5)和中性缓冲液(pH 7)中的溶解度,改善乳化性、起泡性。Li Dan等[8]认为与原大豆分离蛋白相比,在pH 3~10范围内脱酰胺大豆蛋白具有更高的乳化稳定性。Xiang Huan等[9]认为谷氨酰胺酶处理1%和8%的大豆蛋白能显著提高其乳化能力和乳液稳定性。但是目前关于谷氨酰胺酶脱酰胺马铃薯蛋白乳液特性的研究鲜有报道。
本实验研究不同脱酰胺时间(0、0.5、3、6、12 h)马铃薯蛋白的乳液特性,研究不同脱酰胺时间的马铃薯蛋白对乳液的粒度分布、稳定性、微流变特性及微观结构的影响。通过对脱酰胺马铃薯蛋白乳化特性的研究,以期提高马铃薯的产品附加值和综合利用率,解决马铃薯加工厂淀粉废液直接排放的污染问题,同时为马铃薯蛋白的深入研究及产品开发提供参考,为寻找天然植物蛋白乳化剂并将其应用于食品加工中提供参考和理论依据。
1 材料与方法
1.1 材料与试剂
马铃薯蛋白(蛋白含量90.01%) 甘肃省兰州沃特莱斯生物科技有限公司;谷氨酰胺酶 天野酶制剂(江苏)有限公司上海分公司;大豆油 河南省益海嘉里(安阳)食品工业有限公司;实验用其他试剂均为分析纯。
1.2 仪器与设备
MS7-H550-Pro型磁力搅拌器 北京大龙兴创实验仪器有限公司;FE20 Plus型pH测量计 上海仪电科学仪器有限公司;LGJ-50FD型冷冻干燥机 北京松源华兴科技发展有限公司;Turbiscan Lab多重光散射仪、Rheolaser Master光学法微流变仪 法国Formulaction公司;TD5M型低速离心机 上海卢湘仪离心机仪器有限公司;SHZ-A往复型-恒温水浴振荡器 江苏省金坛市城西春兰实验仪器厂;IKA型高剪切分散乳化机德国弗鲁克流体机械制造有限公司;UV762型紫外分光光度计 上海仪电分析仪器有限公司;JY1002型电子天平上海诺科仪器仪表有限公司;MP200A型电子天平(千分位) 上海良平仪器仪表有限公司;Nano-ZS激光纳米粒度仪 英国马尔文仪器有限公司;BX53M偏光显微镜 日本Olympus公司。
1.3 方法
1.3.1 酶法脱酰胺
将马铃薯蛋白分散在pH 7.0200 mmol/L磷酸盐缓冲溶液中,形成(1±0.002)g/100 mL的分散悬浮液,磁力搅拌30 min使马铃薯蛋白分散均匀,制备马铃薯蛋白溶液。添加一定量的谷氨酰胺酶(酶底比为1∶400)进行改性反应,于50 ℃水浴摇晃0、0.5、3、6、12 h,得到不同脱酰胺时间下的马铃薯蛋白质酶解溶液(记为DPP-0 h、DPP-0.5 h、DPP-3 h、DPP-6 h和DPP-12 h)。空白组则以不加酶的相同质量浓度的马铃薯蛋白质溶液在上述相同条件下反应12 h。反应结束后迅速进行冰浴冷却以抑制谷氨酰胺酶的活性,马铃薯蛋白质酶解溶液以及空白组溶液均用去离子水透析24 h,然后将蛋白溶液真空冻干成固体粉末,在室温下保存在密封袋中,用于进一步分析。
1.3.2 脱酰胺马铃薯蛋白的乳液制备
参照仇超颖[10]的方法并修改,将一定质量的脱酰胺马铃薯蛋白质粉末溶于去离子水中,并将蛋白溶液与大豆油按1∶4(V/V)混合,于高速均质机中10000 r/min室温下均质2 min。
1.3.3 脱酰胺马铃薯蛋白乳液粒径的测定
采用LS 13320激光纳米粒度仪测定乳液的粒径。乳液的相对折射率是1.022,即马铃薯蛋白颗粒的折射率为1.360,与去离子水的折射率之比为1.330。每个样品测量3 次,取平均值。用体积平均直径(D4,3)和表面平均粒径(D3,2)表征乳液液滴粒度的大小[11]。
1.3.4 脱酰胺马铃薯蛋白乳液物理稳定性的测定
稳定性动力学指数(Turbiscan stability index,TSI)可用来评估样品稳定性。参照Santos等[12]的方法并修改。将乳液置于样品池中,以扫描模式运行,测试温度25 ℃,使用Turbiscan Lab多重光散射仪分析3 h,用TSI表征样品的乳液稳定性。
1.3.5 脱酰胺马铃薯蛋白乳液微流变特性的测定
采用扩散波谱动态光散射技术,通过Rheolaser Master光学法微流变仪分析不同脱酰胺时间下马铃薯蛋白乳液液滴的布朗运动[13]。以液滴均方根位移(mean square displacement,MSD)随时间的变化测定粒子的布朗运动。参数设定:样品体积20 mL;温度25 ℃;测量时间3 h。通过专利运算法得出粒子MSD与去相关时间的关系,获得样品的弹性因子(elasticity index,EI)、固液平衡点(solid liquid balance,SLB)、宏观黏度指数(macroscopic viscosity index,MVI)和流动性指数(fluidity index,FI)。微流变仪通过多散斑扩散波光谱学理论分析软物质的微流变特性。
1.3.6 脱酰胺马铃薯乳液微观结构测定
取不同乳液样品适当稀释后滴加到载玻片中央,盖上盖玻片,置于载物台上,用20 倍光学显微镜进行观察。
1.4 数据处理
2 结果与分析
2.1 谷氨酰胺酶对马铃薯蛋白乳液粒径的影响
乳液属于热力学不稳定体系,贮存过程中由于两相热力学不相容导致相分离趋势,主要表现为分层、沉降、絮凝、聚结、奥氏熟化和相转化等[14]。乳液粒度大小是衡量乳浊液稳定性的一个有效指标[15]。通常乳液粒径越小,乳液体系越稳定[16]。由表1可知,脱酰胺马铃薯蛋白可以制备出粒径较小且比较稳定的乳液。随着脱酰胺时间的延长,马铃薯蛋白乳液的D4,3呈现先减小后增大的趋势。脱酰胺0.5 h的马铃薯蛋白乳液的D4,3为8.17 μm,这一较小的粒径数值表明液滴表面净电荷增加,液滴在静电作用下不易聚集。蛋白具有较好的降低界面膜界面张力的能力,也可能是因为体系中马铃薯蛋白在界面发生重排进而稳定了水油两相。脱酰胺12 h的马铃薯蛋白乳液的D4,3升高至13.46 μm,这表明脱酰胺12 h时并未达到蛋白的饱和吸附浓度[17],油滴未被乳化剂完全包裹吸附,导致油滴稳定性差。这些结果表明脱酰胺后马铃薯蛋白分子结构的展开及溶解性的增加使蛋白质具有较高的界面活性,马铃薯蛋白能够在油-水界面迅速吸附,降低界面张力,形成较小的油滴。谷氨酰胺酶已经在小麦面筋蛋白、大米蛋白、玉米醇溶蛋白中应用并成功改善其溶解度、乳化性、起泡性等功能性质,但目前关于谷氨酰胺酶处理马铃薯蛋白的研究鲜有报道。Jiang Zhongqing等[18]发现酶法脱酰胺后,脱酰胺度越高的燕麦蛋白形成的乳液中大油滴比例减小、小油滴比例增大,粒径分布更均匀。谷氨酰胺酶处理过的马铃薯蛋白乳液具有类似的结果,乳液粒径显著减小(P<0.05),使乳液更均匀。非酶法脱酰胺也是一种常用的脱酰胺方法,但是非酶法脱酰胺常会引起蛋白质的水解或者产生不良风味。Wu等[19]用酸处理小麦面筋蛋白后提高了其乳化和稳定性,并指出酸处理导致蛋白质肽键的水解及较高的热处理温度导致蛋白溶解性提高,而谷氨酰胺酶可以特异性地催化蛋白质中谷氨酰胺和天冬酰胺残基的脱酰胺,只产生轻微的水解[20]。

表1 脱酰胺马铃薯蛋白乳液的粒径分布Table 1 Particle size distribution of deaminated potato protein emulsions
2.2 谷氨酰胺酶对马铃薯蛋白乳液稳定性的影响
TSI可以反映多种不稳定(如乳化、聚结和/或絮凝)变化的综合效应,与乳状液体系的稳定性相关[21]。TSI值越高,系统稳定性越差[22]。如图1所示,未进行脱酰胺处理的马铃薯蛋白乳液的TSI值较大,稳定性较低。脱酰胺处理0.5、3、6 h的马铃薯蛋白乳液的TSI值减小,说明脱酰胺处理可以提高马铃薯蛋白乳液的稳定性,可能是乳状液液滴间相互作用较弱,不会发生聚集沉淀的现象,对乳状液稳定性影响较小。脱酰胺处理12 h的马铃薯蛋白乳液的TSI值增大,乳液的稳定性降低。这可能是因为脱酰胺处理的时间较长,更多的疏水基团暴露出来,乳化稳定性降低。乳状液液滴间相互作用较强,乳液的物理稳定性被破坏。
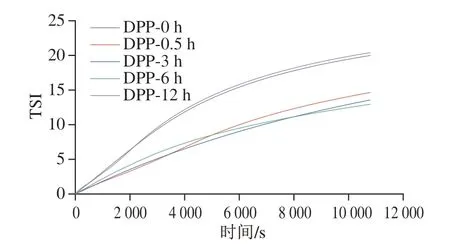
图1 不同脱酰胺时间马铃薯蛋白乳状液的TSI值Fig.1 TSI values of emulsions containing potato protein deaminated for different durations
2.3 谷氨酰胺酶对马铃薯蛋白乳液微流变特性的影响
2.3.1 脱酰胺马铃薯蛋白乳液MSD曲线
微流变可以通过跟踪粒子的布朗运动获得MSD值测量乳液样品的黏弹性特性。如图2所示,脱酰胺马铃薯蛋白乳状液的MSD曲线为线性,表明样品为纯黏性。纯黏性流体(牛顿流体)中,粒子MSD与时间呈线性增长[23]。MSD曲线首先由长位移向短位移转变,即弹性增加,颗粒间碰撞增加。去相关时间由短向长的MSD曲线变化,表明黏度增加。通过研究颗粒的运动轨迹,可以感知样品结构的变化。同时,MSD曲线可以反映样品的黏弹性与流体特征[24]。由图2可知,脱酰胺6 h的马铃薯蛋白乳液的变化最大,弹性平台的MSD值最低,说明脱酰胺6 h的马铃薯蛋白乳液的黏度最高。
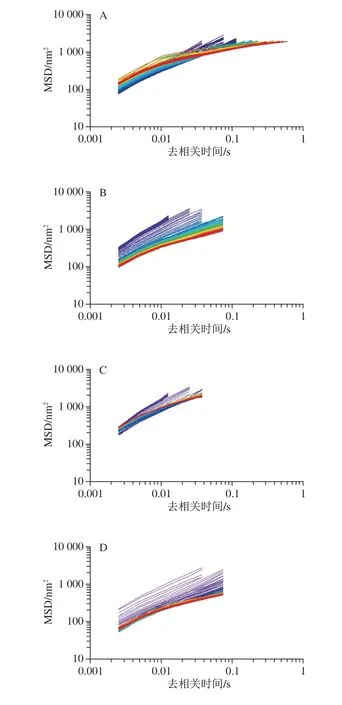
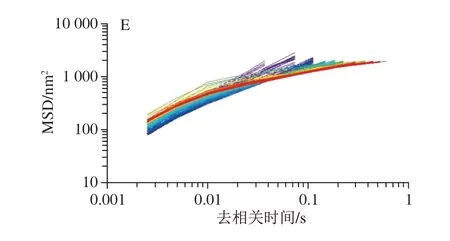
图2 不同脱酰胺时间的马铃薯蛋白乳液MSD曲线Fig.2 MSD curves of emulsions containing deaminated potato protein with different deamidation time
2.3.2 脱酰胺马铃薯蛋白乳液MSD斜率、MVI、EI、SLB和FI
MSD斜率可以提供运动类型信息,量化动力学特性。去相关时间较长的时间内,MSD斜率可以用来监测粒子的运动。MSD斜率等于1时,它提供了液滴随机运动的布朗运动,没有特定的终点和规律;MSD斜率大于1时为弹道运动,通常对应于沉降;而MSD斜率小于1时,由于样品中结构的形成,液滴运动受阻。稳定的流体系统中,质点的运动在很短时间内是弹道运动,而不稳定的系统中,运动是长时间的弹道运动[25]。如图3所示,未经过脱酰胺处理的马铃薯蛋白乳液的MSD斜率大于1,说明它的乳液体系相对不稳定。未脱酰胺和脱酰胺的马铃薯蛋白乳液刚开始时的MSD斜率大于1,说明颗粒的运动是弹道运动,而不是纯布朗运动,说明刚开始有粒子的沉降。脱酰胺3 h的马铃薯蛋白乳液在0.5 h后MSD斜率等于1,说明粒子此时的运动是布朗运动[26]。脱酰胺6 h和脱酰胺12 h的马铃薯蛋白乳液中结构形成,液滴运动受阻;这可以解释为蛋白质的氧化降低了表面的疏水性,促进了类似液滴的形成,这些液滴容易聚集形成网络,导致运动受阻。
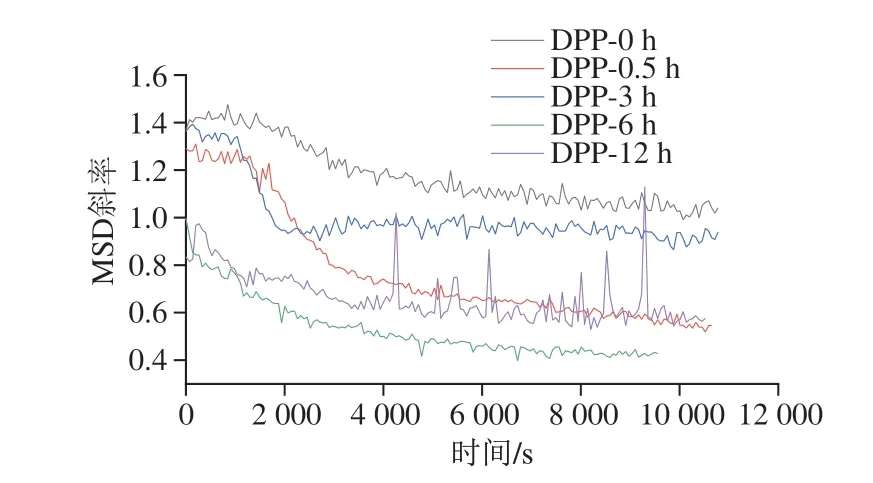
图3 不同脱酰胺时间的马铃薯蛋白乳液MSD斜率Fig.3 MSD slopes of emulsions containing potato protein deaminated for different durations
MVI为平台区域后MSD曲线的斜率,与宏观黏度有关,能反映体系的质构、流动性、长期稳定性[27]。粒子移动到一定距离的时间越长,表示液滴运动速度越低,MVI值越高。另一方面,粒子移动的越快,样品的黏度越弱,粒子移动的越慢,样品的黏度越强[28]。MVI实际为乳液在零剪切速率下的黏度,是表征体系结构承受低剪切效应的能力,数值越大,说明体系的结构越强[29]。如图4所示,脱酰胺改性6 h的乳状液MVI值最大,黏度最大。不同脱酰胺时间的马铃薯蛋白乳液的MVI值与未处理的相比呈现增大的趋势,更高的宏观黏度说明粒子需要更多的时间移动,它们具有较低的粒子速度,可能会提高乳液的稳定性。
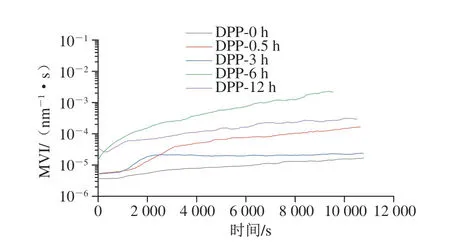
图4 不同脱酰胺时间的马铃薯蛋白乳液MVI曲线Fig.4 MVI curves of emulsions containing potato protein deaminated for different durations
EI可以表示样品弹性随时间的变化过程[30]。EI值对应于MSD平台值的倒数,平台值越高,EI值越低。如图5所示,未经处理的乳液EI值较低,说明乳液液滴间的相互作用较差。酶解时间延长,乳状液的EI值升高,说明酶解处理增加了乳液的弹性。EI值的增大表明乳液形成了致密的结构。较高的EI值归因于较高的表面蛋白浓度和较厚的界面层,可以防止液滴的破坏和聚集,乳液相对稳定[31]。
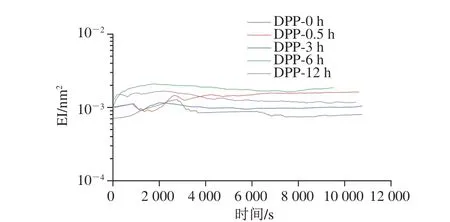
图5 不同脱酰胺时间的马铃薯蛋白乳液EI曲线Fig.5 EI curves of emulsions containing potato protein deaminated for different durations
SLB值代表样品固体性质和液体性质的比率,反映固液特性。0<SLB<0.5时,体系中固体行为(凝胶行为)占主导作用;SLB=0.5时,体系中液体行为与固体行为同等;SLB>0.5时,体系中液体行为占据主导地位[32];SLB>1表示沉积物的出现。较短的去相关时间内,SLB值对应MSD平台区的斜率;斜率越高,粒子移动越快,说明样本更趋向于液体。如图6所示,刚开始乳液的SLB值都很大,随着时间的延长SLB值逐渐降低,后面趋于稳定。未经过脱酰胺处理的马铃薯蛋白乳液的SLB值最大,表明乳液的乳化性不好,存在上浮和下沉的现象。经过谷氨酰胺酶处理过的马铃薯蛋白乳液SLB值在0.5~1.0之间,乳液的黏度降低,乳液的流动性增强,液滴运动速率增加,液体行为更加明显。乳液中,液滴运动速率低可能表示体系处于稳定状态,而过高的运动速率可能与液滴的沉降和乳液的相分离有关。

图6 不同脱酰胺时间的马铃薯蛋白乳液SLB曲线Fig.6 SLB curves of emulsions containing potato protein deaminated for different durations
FI反映了系统中液滴的流动性,与MVI呈负相关[33]。如图7所示,未处理的脱酰胺马铃薯蛋白乳液的FI值最大,乳液流动性最快,这是因为未处理的乳液的黏度较小,粒子的运动速度快。经过脱酰胺处理0.5、3、6 h和12 h的乳液FI值降低,乳液黏度增大,粒子运动速度减慢。这说明脱酰胺处理对马铃薯蛋白乳液的布朗运动有一定的促进作用。
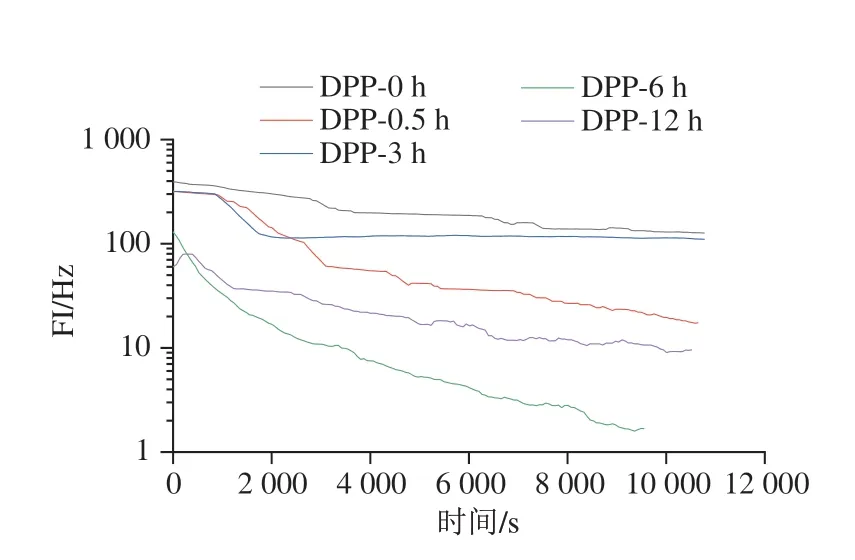
图7 不同脱酰胺时间的马铃薯蛋白乳液FI曲线Fig.7 FI curves of emulsions containing potato protein deaminated for different durations
2.4 谷氨酰胺酶对马铃薯蛋白乳液微观结构的影响
由图8可知,未经过脱酰胺改性的马铃薯蛋白乳液油滴大而且分散不均匀;脱酰胺0.5 h的马铃薯蛋白乳液油滴与未改性的乳液相比大油滴减少、小油滴分布较多;脱酰胺3 h和6 h的马铃薯蛋白乳液液滴分布相对均匀,形成的乳液液滴较小,这可能是因为静电斥力增大,阻止了液滴的聚集;脱酰胺12 h的马铃薯蛋白乳液相比脱酰胺3 h和6 h的马铃薯蛋白乳液油滴大且分布较为分散,这可能是因为蛋白分子在油水界面间的相互作用受到抑制,降低了界面膜的黏弹性[34],此外电荷斥力降低使蛋白在界面既不能伸展也不能重新排布[35]。
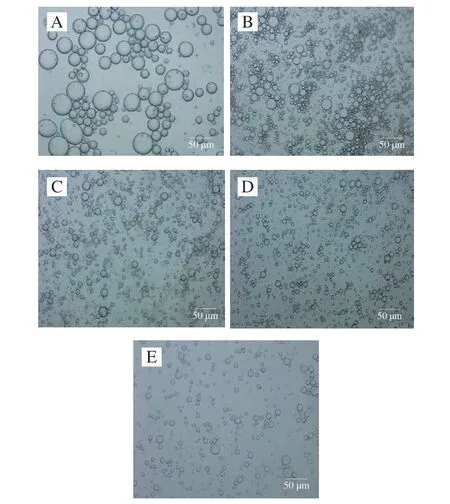
图8 脱酰胺马铃薯蛋白乳液的光学显微镜图像Fig.8 Optical microscope images of deaminated potato protein emulsions
3 结论
采用谷氨酰胺酶处理马铃薯蛋白,探究谷氨酰胺酶对马铃薯蛋白乳化特性的影响,并对不同脱酰胺乳液的粒度分布、稳定性、微流变特性及微观结构进行分析。结果表明,未经过脱酰胺处理的马铃薯蛋白乳液粒径较大,乳液稳定性差;脱酰胺3 h和6 h的马铃薯蛋白乳液粒径分布均匀,乳液较为稳定;微流变特性表明未经过脱酰胺的马铃薯蛋白乳液的MVI、EI值最小,SLB、FI值最大,说明未脱酰胺的乳液体系最不稳定,脱酰胺6 h的马铃薯蛋白乳液的MVI值最高,黏度最大,粒子运动速度减慢,形成的体系最稳定。因此,脱酰胺6 h的乳液体系较为稳定、乳液黏度、弹性较好。本实验为马铃薯蛋白作为乳化剂的开发并将其应用于食品行业中提供一定理论基础,为提高马铃薯的产品附加值提供思路,谷氨酰胺酶可能是提高马铃薯蛋白在食品工业中可用性的一种潜在工具。

