牛痘相关激酶1在小鼠肺动脉平滑肌细胞增殖和迁移中的作用及机制*
陆倩茹 , 孙雄山, 杨永健,
(1西南交通大学医学院,四川 成都 610031;2西部战区总医院心血管内科,四川 成都 610083)
动脉型肺动脉高压(pulmonary arterial hypertension, PAH)是一种慢性进行性的病理生理综合征,其特征包括肺血管异常收缩、肺血管重塑和血管阻力增加,严重的将最终导致右心衰竭和死亡[1]。作为肺动脉的主要成分,肺动脉血管平滑肌细胞(pulmonary arterial smooth muscle cells, PASMCs)在维系血管的正常结构和功能上发挥了关键作用[2]。缺氧被认为是PAH发生发展的关键因素之一[3]。长期缺氧引起PASMCs过度增殖和迁移,导致肺动脉狭窄,最终进展为PAH[4]。既往研究表明,多种分子机制参与PASMCs的过度增殖和迁移[5-7]。然而,基于上述机制的防治措施尚不能有效阻断或逆转血管再狭窄的发生[8],PAH仍有较高的发病率和死亡率。因此,探索再狭窄潜在的分子机制和寻找新的治疗靶点十分必要。
牛痘相关激酶1(vaccinia-related kinase 1, VRK1)属于丝氨酸/苏氨酸蛋白激酶家族,其可被多种病理性应激如缺氧和机械刺激等诱导表达,在细胞增殖、肿瘤进展和运动神经元疾病等过程中发挥调控作用[9-10]。VRK1在增殖活跃的细胞和组织中含量丰富,被认为是细胞周期的调节剂[11]。VRK1可以在各种类型的肿瘤细胞和神经元干细胞中发挥促增殖作用[12-13]。然而,VRK1是否与低氧刺激后PASMCs增殖、迁移有关尚不清楚。本研究通过构建低氧干预小鼠PASMCs诱导体外增殖和迁移,探讨VRK1在PASMCs增殖和迁移中的作用及机制,从而为治疗血管再狭窄提供参考资料。
材料和方法
1 实验细胞及主要试剂
小鼠PASMCs购于中国武汉普诺赛生命科技有限公司;DMEM高糖培养液、双抗、0.25%胰蛋白酶、磷酸盐缓冲液(phosphate-buffered saline, PBS)、胎牛血清购于 Gibco; SKL2001 购自 MedChemExpress。二甲基亚砜(dimethyl sulfoxide, DMSO)购于Sigma。Vrk1特异短发夹 RNA(Vrk1short hairpin RNA, sh-Vrk1)三保一慢病毒及相关阴性对照RNA(shCon)由中国上海吉凯基因科技有限公司构建; GAPDH单克隆抗体购于Abcam。VRK1多克隆抗体购自Invitrogen。β-catenin抗体、Ki-67抗体购自CST。山羊抗兔Ⅱ抗购于北京中杉金桥生物技术有限公司;全蛋白提取试剂盒和BCA蛋白定量试剂盒购于北京索莱宝生物有限公司;ECL发光液购于Millipore。
2 方法
2.1 细胞培养及分组 PASMCs在含10% 胎牛血清及1%双抗的DMEM高糖培养液培养,置于5%CO2、37 ℃细胞培养箱孵育,之后每2 d更换1次培养液,当细胞融合度达80%左右时,予胰酶消化后按1∶4或1∶5传代培养。选择处于对数生长期的细胞进行后续实验。按照参考文献的方法[14],在低氧环境(3% O2、5% CO2、92% N2、37 ℃)中诱导小鼠PASMCs体外增殖和迁移。用Vrk1特异性shRNA沉默Vrk1的表达,用40 μmol/L SKL2001恢复β-catenin的活性[15]。为确定沉默Vrk1表达对PASMCs增殖和迁移的影响,将PASMCs稳定转染shCon或shVrk1后,在常氧或低氧培养条件下干预不同时间(12 h、24 h、36 h)后检测相关指标。为确定VRK1是否通过影响β-catenin的活性调控PASMCs增殖和迁移,在沉默Vrk1表达后,加入40 μmol/L SKL2001处理细胞 6 h[15],将 PASMCs分为 shCon+DMSO 组、shVrk1+DMSO组和shVrk1+SKL2001组,并在低氧环境下培养,观察小鼠PASMCs增殖和迁移情况。
2.2 沉默慢病毒的构建 由上海吉凯基因科技有限公司构建重组shVrk1和空载慢病毒shCon,shVrk1携带基因序列编号为NM-011705。根据公司提供慢病毒操作手册,制备密度为5×107/L的细胞悬液,将细胞悬液铺于小皿中,当细胞融合度达50%左右,使用感染复数(multiplicity of infection, MOI)=100的携带Vrk1基因沉默慢病毒或空载慢病毒感染PASMCs,感染8 h后更换完全培养液,继续培养至细胞融合度达80%左右进行细胞传代,并在后续培养液中加入2 mg/L嘌呤霉素筛选稳定转染细胞,再进行后续实验。
2.3 免疫荧光测定 细胞爬片放入6孔板中,加入细胞悬液,按前述分组处理后吸去培养液,PBS浸洗3次;4%多聚甲醛固定30 min,再次用PBS浸洗3次;0.3%的TritonX-100常温通透15 min,PBS洗3次;山羊血清常温封闭30 min;吸去封闭液后,每份玻片滴加适量的Ki-67抗体(1∶300)并放至4 ℃湿盒中孵育1晚。次日PBS洗3次,在黑暗环境中滴加荧光Ⅱ抗(1∶100),湿盒 37 ℃孵育 1 h;滴加 DAPI复染核 5 min,PBS洗3次;吸水纸吸尽液体后用含抗荧光淬灭剂的封片液封片;在荧光显微镜下观察调整,并采集图像[16]。
2.4 细胞划痕实验 将慢病毒稳定转染后的PASMCs上述分组接种于6孔板中(每孔1×105个),当细胞融合度达90%左右,用无菌200 μL吸头垂直于板底划线。用PBS浸洗3次,去除残余的漂浮细胞,并拍下0 h图片。加入无血清培养液,按照分组要求给予处理,置于常氧或低氧培养箱中孵育,并拍下划痕24 h图片。
2.5 Western blot检测 VRK1及 β-catenin蛋白水平 按上述分组提取各组PASMCs蛋白检测VRK1及β-catenin蛋白水平,按照全蛋白提取试剂盒说明书进行操作。BCA法测定蛋白浓度,蛋白样品进行SDS-PAGE分离,然后转至PVDF膜上,置于5%胎牛血清中室温封闭1 h[17]。加入相应的VRK1抗体、β-catenin抗体和GAPDH抗体,VRK1抗体和β-catenin抗体稀释比为1∶1 000,GAPDH抗体稀释比例为1∶10 000,置于4 ℃摇床上孵育1晚。次日,TBST洗膜后用Ⅱ抗(1∶5 000)室温孵育1 h。TBST洗膜,滴加ECL发光液曝光。采用Image J软件分析条带灰度值。
3 统计学处理
采用SPSS 20.0软件进行统计分析。计量资料以均数±标准差(mean±SD)表示,符合正态分布且方差齐的资料,两组比较采用独立样本t检验,多组间比较采用单因素方差分析,进一步两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
结 果
1 低氧诱导PASMCs中VRK1的蛋白表达
Western blot结果显示,与常氧组相比,PASMCs在低氧环境中培养12 h后,VRK1蛋白表达量稍增高,但差异无统计学意义(P>0.05),但继续培养24和36 h后,PASMCs中VRK1蛋白表达量升高且具有时间依赖性(P<0.01),见图1。
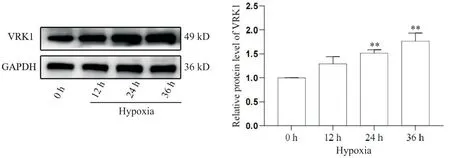
Figure 1. Effect of hypoxia for different time courses on the protein expression of VRK1 in mouse PASMCs. Mean±SD. n=3. **P<0.01 vs 0 h group.图1 不同时间低氧刺激对小鼠PASMCs中VRK1表达的影响
2 低氧诱导PASMCs中胞核和胞质中VRK1蛋白的表达
Western blot结果显示,与PASMCs中胞核比较,胞质内VRK1蛋白表达更加丰富。相较于常氧组,低氧培养24 h后,PASMCs胞核中VRK1蛋白表达差异无统计学意义(P>0.05),但胞质VRK1蛋白表达量显著升高(P<0.01),见图2。
3 沉默Vrk1抑制低氧条件下PASMCs的增殖和迁移
Western blot结果显示,常氧条件下,shVrk1组细胞中VRK1蛋白表达量显著下调(P<0.01)。细胞划痕实验显示,常氧条件下,shVrk1组划痕愈合率较shCon组比较差异无统计学意义(P>0.05),但低氧条件下shCon组划痕愈合速度明显加快(P<0.01)。低氧条件下,shVrk1转染组划痕愈合率较shCon组降低(P<0.01)。通过Ki-67免疫荧光染色显示,常氧条件下,shCon组与shVrk1组Ki-67阳性的细胞数量变化无显著差异(P>0.05),而低氧处理shCon细胞24 h后,Ki-67阳性的细胞率显著增加(P<0.01)。低氧条件下,shVrk1转染可显著降低Ki-67阳性细胞率(P<0.01),见图3。
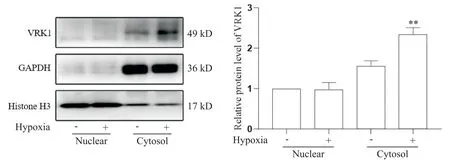
Figure 2. Effect of hypoxia on the expression of VRK1 in nucleus and cytosol of mouse PASMCs. Nuclear and cytosolic enriched fractions were prepared from mouse PASMCs treated with hypoxia for 24 h. The relative protein expression levels of VRK1 were determined by Western blot. Mean±SD. n=3. **P<0.01 vs normoxia group.图2 低氧刺激对小鼠PASMCs胞核和胞质中VRK1表达的影响
4 沉默Vrk1对β-catenin蛋白表达的影响
Western blot结果显示,常氧条件下,shVrk1转染后细胞中β-catenin蛋白水平较shCon组显著降低(P<0.01),见图4。
5 VRK1通过上调β-catenin促进PASMCs增殖和迁移
Western blot结果显示,低氧条件下,相较于shCon+DMSO组,shVrk1+DMSO组的β-catenin蛋白水平显著降低(P<0.01),而与 shVrk1+DMSO 组相比,shVrk1+SKL2001组β-catenin蛋白水平显著升高(P<0.01)。Ki-67免疫荧光显示,低氧条件下,与shCon+DMSO组相比,shVrk1+DMSO组Ki-67阳性细胞率降低(P<0.01),而相较于shVrk1+DMSO组,sh-Vrk1+SKL2001组Ki-67阳性细胞率增加(P<0.01)。同时,细胞划痕实验显示,低氧条件下,与shCon+DMSO组相比,shVrk1+DMSO组划痕愈合速度降低(P<0.01),而 相 较 于 shVrk1+DMSO 组 ,shVrk1+SKL2001组划痕愈合速度提高(P<0.01),见图5。
讨 论
PAH是由多种异源性疾病和不同发病机制引起肺血管结构或功能改变,进而引起肺血管阻力和肺动脉压力升高的病理生理综合征[8],严重的最终可导致右心衰竭甚至死亡。多种病理条件下慢性缺氧引起PASMCs过度增殖和迁移,最终发展为PAH[18]。以过度增殖和迁移为特点的PASMCs表型转换是PAH进展的关键[19]。PAH的分子调控机制尚未完全阐明,现认为是多因素、多环节共同作用,涉及多种血管活性成分(如前列环素、内皮素、血管紧张素Ⅱ、一氧化氮等),多种离子通道(如钙离子通道、钾离子通道和新型阳离子通道等)和多信号通路(如低氧诱导因子/经典型瞬时受体电势通道通路、丝裂原活化蛋白激酶通路、Rho激酶通路等)[20-21]。本研究通过低氧干预小鼠PASMCs诱导体外增殖和迁移,探讨VRK1在PASMCs增殖和迁移中的作用及机制。
VRKl是细胞核中的一种丝氨酸/苏氨酸激酶,在静息细胞中覆盖于染色质表面,并于与几种不同类型的染色质蛋白形成稳定的复合物,包括组蛋白、转录因子和参与DNA修复过程的蛋白[9]。VRK1通过磷酸化组蛋白参与核小体的共价修饰。作为染色质激酶,VRK1另一个重要作用是与转录复合物结合,通过与多种转录因子相互作用并使其磷酸化,控制细胞周期进程,在细胞分裂、转录激活、DNA修复及组蛋白修饰中发挥作用[22-23]。VRK1在哺乳动物中广泛表达,在(多种细胞)增殖、肿瘤转移和运动神经元疾病中发挥作用[12,24]。但 VRK1 在 PASMCs增殖和迁移中是否发挥调控作用尚不清楚。既往研究表明,慢性缺氧所致PASMCs表型转换在血管再狭窄的进展中发挥关键作用[18]。本研究显示VRK1在低氧干预的小鼠PASMCs中蛋白表达水平升高,而沉默Vrk1表达能抑制低氧干预后PASMCs体外的增殖和迁移。说明VRK1表达上调可以促进PASMCs的增殖和迁移,但其调控PASMCs增殖和迁移的作用机制的尚不清楚。
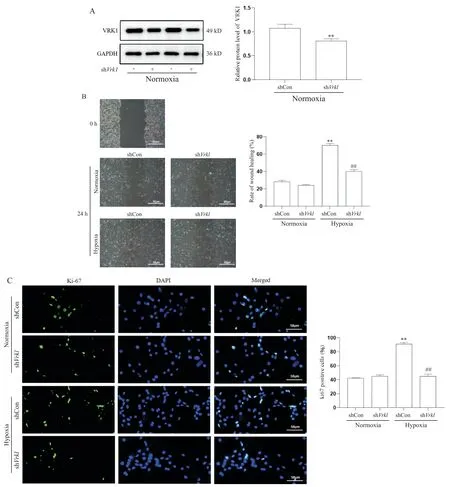
Figure 3. Effects of Vrk1 silencing on hypoxia-induced proliferation and migration of mouse PASMCs. PASMCs were transfected with the lentivirus carrying short hairpin RNA of Vrk1 (shVrk1) or control virus(shCon) and cultured under normoxic/hypoxic conditions for 24 h. A: the relative protein expression level of VRK1 in mouse PASMCs was determined by Western blot;B: cell migration was analyzed by wound healing assay; C: mouse PASMCs treated as above mentioned were stained with Ki-67 (green) and DAPI (blue). Scale bar=50 μm. Mean±SD. n=3. **P<0.01 vs normoxia+shCon group; ##P<0.01 vs hypoxia+shCon group.图3 沉默Vrk1对低氧诱导的小鼠PASMCs增殖和迁移的影响
研究表明,VRK1对细胞增殖和迁移的调节作用取决于β-catenin的激活[25]。β-catenin作为Wnt信号通路的关键分子,在胚胎发育、细胞增殖和肿瘤转移中发挥重要作用[26]。另一项研究显示,β-catenin信号与VSMC的增殖、迁移和血管内膜增厚有关[27]。Sun等[28]研究表明,VRK1通过mTORC1/β-catenin通路调控血管平滑肌细胞增殖和迁移。但β-catenin是否参与VRK1介导的PASMCs调节仍然未知。因此,我们在PASMCs中进一步研究了VRK1对β-catenin活性的影响。体外实验表明,沉默PASMCs中Vrk1的表达水平后,β-catenin的表达水平亦下降,提示在PASMCs中β-catenin也受VRK1正向调控。既往研究显示,SKL20001通过破坏Axin/β-catenin相互作用激活β-catenin活性[29],本研究亦表明,使用SKL2001后β-catenin表达水平恢复。而β-catenin活性恢复后,沉默Vrk1对小鼠PASMCs增殖和迁移的抑制作用被逆转。由此推论,沉默Vrk1可通过降低β-catenin表达抑制小鼠PASMCs体外的过度增殖和迁移。
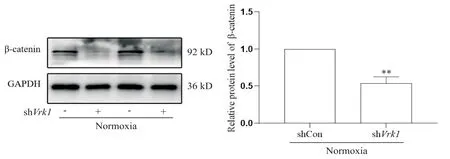
Figure 4. Effect of Vrk1 silencing on β-catenin protein expression in mouse PASMCs under normoxia condition. Mean±SD. n=3. **P<0.01 vs shCon group.图4 沉默Vrk1对小鼠PASMCs中β-catenin蛋白表达的影响
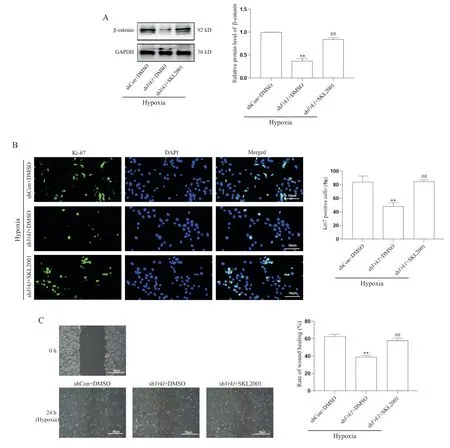
Figure 5. Effect of SKL2001 on proliferation and migration of hypoxia-induced mouse PASMCs after restoring β-catenin activity. A:the protein level of β-catenin in above-treated VSMCs incubated with or without SKL2001 (40 μmol/L) for 6 h was determined by Western blot; B: mouse PASMCs treated as above mentioned were stained with Ki-67 (green) and DAPI (blue);C: cell migration was analyzed by wound healing assay. Scale bar=50 μm. Mean±SD. n=3. **P<0.01 vs shCon+DMSO group; ##P<0.01 vs shVrk1+DMSO group.图5 SKL2001恢复β-catenin活性对低氧诱导的小鼠PASMCs增殖和迁移的影响
综上,沉默Vrk1可抑制低氧干预后小鼠PASMCs体外的过度增殖和迁移,机制与VRK1正向调控β-catenin有关,这可能为治疗血管再狭窄提供新的参考资料。但由于本研究集中在体外实验,尚未进行相关体内实验研究,具有局限性,因此关于VRK1对PAH中肺动脉血管重塑是否与体外实验结果一致仍需进一步研究。

