黄芪多糖对镉染毒大鼠肝肾损伤改善和肠道菌群结构调节的作用
邢喜平,何玉林,薛 娜,颜春鲁,伍志伟,
(1.甘肃中医药大学附属医院,甘肃 兰州 730000;2.桂林医学院基础医学院,广西 桂林 541199;3.甘肃中医药大学,甘肃 兰州 730000)
镉是自然界中含量丰富、分布广泛的一种重金属元素,同时,镉及其化合物也是一类重要的重金属污染物,可通过氧化应激[1]等方式引起人和动物肾脏[2]、肝脏[3]、骨[4]等多种组织器官的炎性反应和功能紊乱[5]。饮食是人体镉暴露的最主要途径,经饮食摄入的含Cd食物和/或水进入肠道后,被肠道上皮细胞吸收,在肠上皮细胞的顶膜处通过质子-金属共转运体二价金属转运体1(divalent metalion tranxporter-1,DMT1)、钙-ATP酶转运子、锌转运子等转运体的介导进入体液循环并散布于人体的不同组织与器官,逐步造成相应组织和器官的镉蓄积。沉积在细胞中的镉离子可与含羟基、巯基、氨基的蛋白分子结合形成镉-蛋白质复合物,或通过镉与钙、锌竞争,从而抑制碱性磷酸酶(alkaline phosphatase,ALP)、超氧化物歧化酶(superoxide dismutase,SOD)等多种酶的活性,引起细胞氧化损伤、代谢紊乱和凋亡[6],然而,镉暴露引起人和动物中毒具体机制依然不清。
镉的摄入不仅会对人和动物肝、肾、睾丸等造成损伤,也会通过氧化损伤、炎症反应、细胞凋亡、免疫病理等途径对肠道造成影响。肠道菌群作为肠道的重要组成部分,在调节机体生理平衡、维持机体健康、有效清除和促进体内重金属排泄方面发挥着重要作用。已有研究表明,低剂量镉暴露会导致小鼠肠道菌群结构改变,引起肠壁通透性增强和调节部分肝脏基因的表达水平,造成雄性小鼠肝脏脂质代谢紊乱和脂肪堆积,同时,重金属暴露时间长短与肠道菌群变化程度呈正向关[7]。
目前,对于镉中毒的治疗以乙二胺四乙酸(ethylene diamine tetraacetic acid,EDTA)、1,2-二巯基丙醇(2,3-dimercaptopropanol,BAL)、二乙基二硫代氨基甲酸钠(diethyl dithiocarbamate,DDTC)螯合剂类药物为主。近年来,以中医药理论为基础,应用中药复方、单味中药或组分在治疗镉中毒方面取得了长足发展和明显疗效,但其机制尚不清楚。
本研究采用CdCl2腹腔注射法建立镉染毒Wistar大鼠模型,以具有调节免疫、抗氧化、抑制细胞凋亡等功效的黄芪多糖为调节剂,应用高通量测序技术和生物信息学软件分析其对镉中毒大鼠肠道菌群结构的调节作用,以期从肠道菌群的角度揭示黄芪多糖对镉造成肝肾损伤的改善。
1 材料与方法
1.1 动物SPF级Wistar雄性大鼠40只,体质量(180±20) g,由甘肃中医药大学医学实验动物中心提供,生产许可证号:SCXK(甘)2015-0002,使用许可证号:SYXK(甘)2015-0005。实验动物处理程序符合相关伦理要求,得到甘肃中医药大学实验动物伦理委员会批准。
1.2 主要试剂与仪器黄芪多糖由甘肃中医药大学科研实验中心药物制剂实验室提取(纯度50%以上);粪便基因组DNA提取试剂盒购自天根生化科技(北京)公司(DP180523);CdCl2购自天津市巴斯夫化工公司(20161010);镉标准贮存溶液(100 mg·L-1)购自厦门海标科技公司(2018324)。
1-14K高速低温冷冻离心机,德国Sigma公司;CP214精密电子天秤,美国OHAUS仪器有限公司;Illumina PE250测序系统,美国Illumina公司;ZEENIT700石墨炉原子吸收光谱仪,德国Analytikjena公司。
1.3 方法
1.3.1动物分组与造模 40只SPF级Wistar雄性大鼠适应性饲养3 d后,按随机数字表法分为空白对照组(BC)、黄芪多糖组(APS)、CdCl2组(CD)、黄芪多糖+CdCl2组(APS+CD),每组10只,分笼饲养。SPF级饲养环境:温度(20~25) ℃,湿度40.0%~50.0%,12 h·d-1采光,自由摄食和饮水。
BC和APS组小鼠以0.9%无菌生理盐水腹腔注射(2 mL·d-1),其余各组腹腔注射CdCl2水溶液(1.5 mg·kg-1·d-1),每周5次,持续处理5周,以建立镉染毒大鼠模型[8]。
1.3.2动物给药 CD和APS+CD组于每次腹腔注射CdCl2前2 h,分别以生理盐水和20 mg·kg-1·d-1黄芪多糖灌胃[19];BC和APS于每次腹腔注射0.9%生理盐水前2 h,分别以生理盐水和20 mg·kg-1·d-1黄芪多糖灌胃;每日1次,持续处理5周。
1.3.3镉标准曲线的绘制 取0.1 mL镉标准贮存溶液(100 mg·L-1)于100 mL容量瓶,用1% HNO3定容、稀释成浓度为100 μg·L-1镉标准使用液。吸取0.0、50.0、100.0、150.0、200.0、250.0、300.0 μL镉标准使用液,分别置于100 mL容量瓶,用1% HNO3定容、稀释成浓度为0、0.5、1.0、1.5、2.0、2.5、3.0 μg·L-1镉标准工作液;应用石墨炉原子吸收光谱法测定其吸光度[9]。
1.3.4尿量及尿镉检测 于每周末次灌胃结束后,将动物单独置于代谢笼中,收集24 h尿液和测量体积,连续进行5周;应用石墨炉原子吸收光谱法测定尿液中镉的含量[9]。
1.3.5肝肾中镉残留检测 末次药物和染毒处理24 h后,采用CO2窒息法处死大鼠,解剖、收集大鼠肝脏和肾脏。采用石墨炉原子吸收光谱法测定组织中镉的含量[9]。
1.3.6肝肾病理学组织学检查 切取解剖后大鼠部分肝肾组织,以无菌生理盐水浸洗,经10%福尔马林固定、石蜡包埋、切片后,采用HE染色法观察各组大鼠肝脏、肾脏组织病理变化。
1.3.7DNA的提取、PCR检测和测序 建模结束前24 h,每只大鼠随机无菌收集新鲜粪便4粒,经捣碎、混合均匀后,应用QIAamp粪便总DNA提取试剂盒提取粪便总DNA,具体操作参照说明书;样品总DNA 16S rDNA V3-V4区扩增与反应参照文献[10]进行,扩增产物经2%琼脂糖凝胶检测分析后,采用AxyPrep DNA凝胶回收试剂盒回收目标条带;回收产物通过QuantiFluorTM-ST蓝色荧光定量系统定量分析,符合标准的纯化回收产物送上海凌恩生物科技有限公司进行Illumina PE250测序。
1.3.8生物信息学分析 Illumina PE250测序所得PE reads经overlap关系拼接、质控和过滤后,应用UPARSE 7.1软件在97%相似性原则下进行操作分类单元(OTU)聚类分析和物种分类学分析。基于OTU聚类分析数据,进行物种多样性指数分析和测序深度检测;基于GreenGene数据库对OTU代表序列进行比对和物种注释,在各个分类水平上进行群落结构的统计分析。
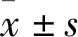
2 结果
2.1 镉标准曲线及方程的建立以ZEENIT700石墨炉原子吸收光谱仪测得的吸光度(A)为纵标准、镉标准工作液浓度为横坐标绘制镉标准曲线(Fig 1),根据相应数据和曲线计算得到回归方程Y=0.0129X+5.0×10-5和相关系数R2=0.999 8。由此表明,浓度在0.5~3.0 μg·L-1镉标准工作液吸光度呈现良好的线性关系。
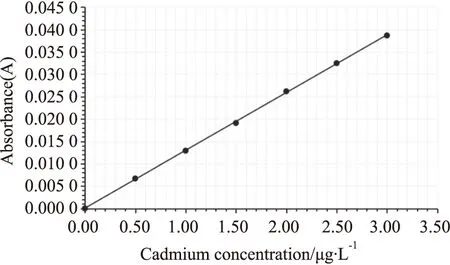
Fig 1 Cadmium standard curve obtained by calculation
2.2 尿量与尿镉含量分析1~5周各组大鼠尿量的收集分析表明,正常大鼠(BC)24 h的平均尿量约为10.6 mL;腹腔注射0.1% CdCl2后,尿量随处理时间的延长逐渐减少,在第4~5周时基本保持稳定,与BC相比,差异有统计学意义(P<0.05或P<0.01);经黄芪多糖灌胃处理后,镉染毒大鼠尿量回升,与CD相比,差异具有统计学意义(P<0.05或P<0.01)。由此可见,黄芪多糖具有缓解镉暴露大鼠尿量减少的作用,见Tab 1。
1~5周各组大鼠尿镉含量检测结果如Tab 2所示,BC大鼠的尿镉含量约为1.07 μg·L-1,与APS比较,差异无统计学意义(P>0.05);腹腔注射CdCl2后,CD和APS+CD大鼠尿镉含量随注射时间的延长明显增加,在第4周时达到峰值并保持相对稳定,组间差异无统计学意义(P>0.05),但与BC相比,差异极明显(P<0.01)。由此可见,黄芪多糖灌胃对镉染毒大鼠尿镉含量影响不明显,但可通过利尿作用促进体内镉的排除。
2.3 肾脏与肝脏镉蓄积分析实验大鼠肾脏和肝脏中镉含量的石墨炉原子吸收光谱显示,镉染毒大鼠(CD)肾脏和肝脏镉含量明显增加,与BC和APS相比,差异有统计学意义(P<0.01);经黄芪多糖灌胃处理后,APS+CD肾脏和肝脏中镉含量均下降,与CD相比,差异有统计学意义(P<0.05或P<0.01),见Tab 3。由此可见,黄芪多糖具有降低大鼠肝脏和肾脏中含量的功效。
2.4 大鼠肝肾组织病理学分析
2.4.1肝组织病理学分析 HE染色显示,BC和APS组肝细胞排列规则、紧密,胞核轮廓清晰分明,肝小叶清晰可见,肝细胞索以中央静脉为中心呈放射状排列,肝窦正常(Fig 2A,2C);腹腔注射CdCl2后,肝细胞肿胀,部分区域呈现片状坏死,胞核着色较浅,肝小叶边界不清,肝细胞索排列紊乱,大量炎性细胞浸润(图Fig 2B);黄芪多糖灌胃处理后,部分肝细胞肿胀坏死,细胞轮廓可见,胞核着色加深,肝窦走向正常、清晰,呈放射状(Fig 2D)。
2.4.2肾组织病理学分析 HE染色镜检显示,BC和APS组肾小管上皮细胞排列规则,管腔完整,胞核清晰可见、大小均一(Fig 3A,3C);腹腔注射CdCl2后,CD肾组织细胞肿胀、坏死,肾小管结构不完整,管腔内出现蛋白样沉淀,肾小球萎缩,细胞空泡化及炎性细胞浸润(Fig 3B);APS灌胃处理后,APS+CD肾组织细胞肿胀、坏死减轻,肾小管结构趋于完整,炎性细胞浸润和空泡减少,肾组织损伤改善明显(Fig 3D)。

Tab 1 Effect of astragalus polysaccharides on urine volume of cadmium exposed n=10)

Tab 2 Effect of astragalus polysaccharides on cadmium content in urine of cadmium-exposed n=10)

Tab 3 Effect of astragalus polysaccharides on cadmium content in kidney and liver of cadmium-exposed n=10)
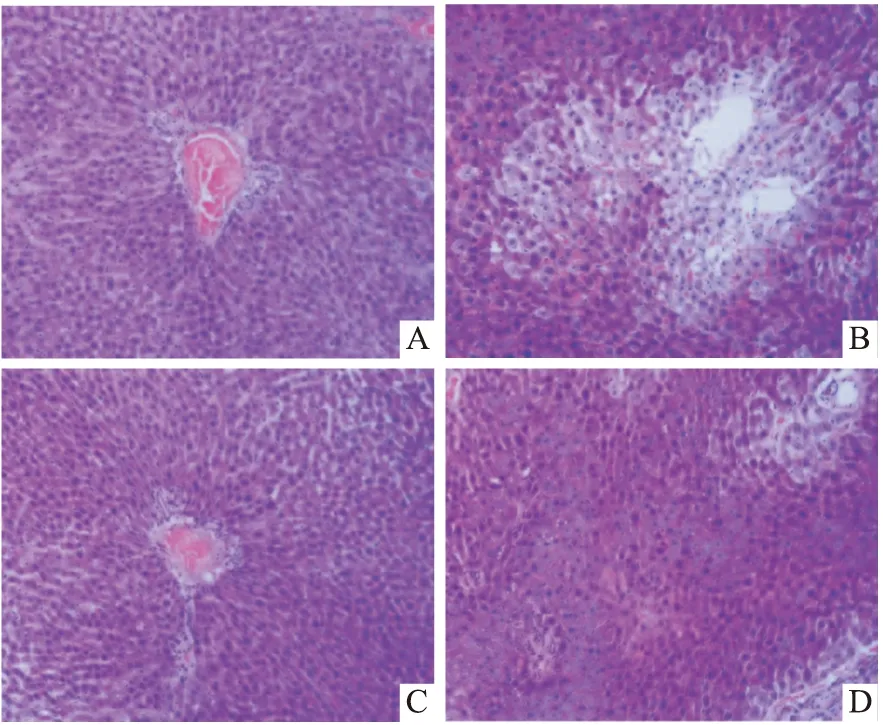
Fig 2 Histopathological examination of liverA:BC,B:CD,C:APS,D:APS+CD(×200)

Fig 3 Histopathological examination of kidneyA:BC,B:CD,C:APS,D:APS+CD(×200)
2.5 黄芪多糖对镉染毒大鼠肠道菌群的影响
2.5.1OTUs聚类分析 原始序列经数据过滤筛选获得优质序列662 513条,平均长度为420 bp,占总序列数的99.87%。按照97%相似性原则对优质非重复序列进行OTU聚类分析,4组测序样品共得到1408个OTU,其中BC为356个、CD为332个、APS为372个、APS+CD为348;4组共有OTU为223个;BC、CD、APS和APS+CD独有OTU数分别为17、14、11和6,Fig 4提示,黄芪多糖灌胃有逆转CdCl2注射引起的大鼠肠道菌群多样性减少的作用。
Fig 4 Venn analysis of OTU existing in BC,CD,APS,and APS+CD
2.5.2Alpha多样性分析 Alpha多样性是基于样本中OTU分类和序列数,通过计算Chao1、ace、shannon和simpson指数反映样品中物种丰富度和均匀度的一种分析方法。Chao1和ace指数通常能反映样本物种的相对丰度,即OTU的数目;shannon和simpson指数反映肠道细菌群落的多样性,shannon指数越大、simpson指数越小,表明样品物种多样性越高。腹腔注射CdCl2后,大鼠chao1、ace、shannon指数明显降低,simpson指数明显升高,与BC相比,差异具有统计学意义(P<0.05);经与黄芪多糖合并处理后,镉染毒大鼠样本chao1、ace、shannon指数明显回升、simpson指数明显回落(P<0.05)。数据表明,黄芪多糖提升了镉染毒大鼠肠道细菌的相对丰度和多样性,Fig 5。
2.5.3β多样性分析 β多样性主要用于分析不同样本间肠道菌群组成的相似性。采用NMDS法对各样本数据的β多样性分析显示,同一组别的重复样本距离较近,聚集在一起;不同组别明显分布于由NMDS1和NMDS2组成二维平面图的不同区域,表明各组之间肠道菌群结构区分明显(Fig 6)。不同组别重复样本的PCoA分析显示,腹腔注射CdCl2后,CD与BC间距离拉大,经黄芪多糖灌胃处理后,APS+CD与BC之间距离拉近(Fig 6),表明黄芪多糖具有调节镉暴露大鼠肠道菌群结构向正常组过渡的作用。
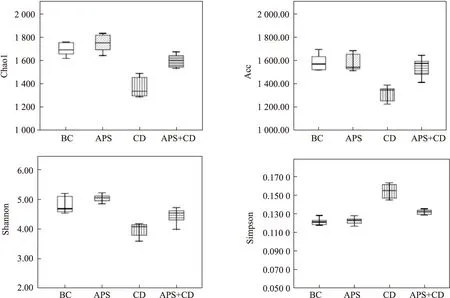
Fig 5 Alpha diversity index (Chao,ace,Shannon and Simpson) analysis
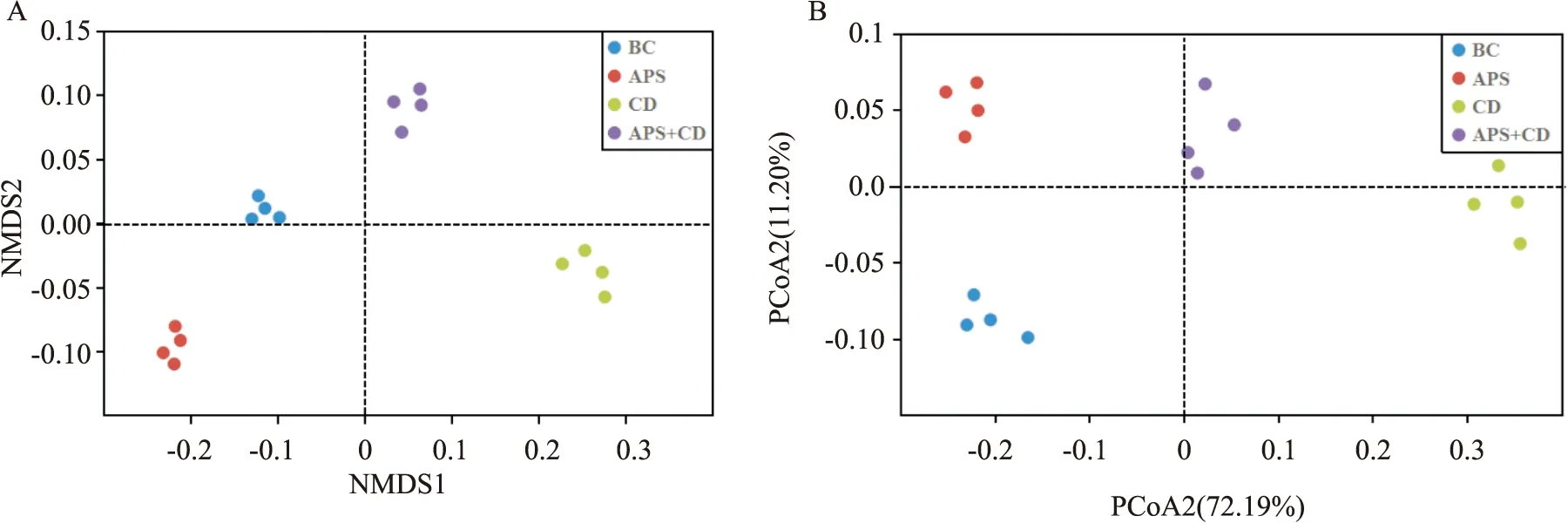
Fig 6 Analysis of different samples by NMDS (A) and PCoA (B) methods
2.5.4肠道菌群结构差异性分析
2.5.4.1门水平分析 按照0.97的相似性比对原则,经OUT注释分析表明,4组样本共获得11个菌门,分别为厚壁菌门(Firmicutes)、拟杆菌门(Bacteroidetes)、变形菌门(Proteobacteria)、酸杆菌门(Acidobacteria)、放线菌门(Actinobacteria)、CandidatusSaccharibacteria、柔膜菌门(Tenericutes)、梭杆菌门(Fusobacteria)、纤维杆菌门(Fibrobacteres)、螺旋体门(Spirochaetes)和迷踪菌门(Elusimicrobia);各样本优势菌门均为Firmicutes、Bacteroidetes和Proteobacteria,三者之和占比均在96%以上。与BC比较,腹腔注射CdCl2后,Proteobacteria、Elusimicrobia和Fibrobacteres丰度明显下降,Fusobacteria和Actinobacteria丰度增加,差异具有统计学意义(P<0.05或P<0.01);经黄芪多糖灌胃后,镉染毒大鼠肠道中Firmicutes丰度极明显下降,Bacteroidetes、Proteobacteria、Elusimicrobia和Fibrobacteres明显增加(P<0.05或P<0.01),Fusobacteria在肠道中消失,出现Acidobacteria、Spirochaetes和Tenericutes,Fig 7A。
2.5.4.2属水平分析 16份样本共包含62个菌属,Prevotella、Ruminococcus、Oscillibacter、Bacteroides、Flavonifractor、ClostridiumXlVa和Roseburia均为各样品优势菌属,丰度占总数的70%以上。腹腔注射CdCl2后,Ruminococcus、Bacteroides、Flavonifractor、Roseburia和Elusimicrobium丰度明显下降,Lactobacillus、Lachnospiracea_incertae_sedis、Parasutterella、ClostridiumXlVb、ClostridiumXI、Intestinimonas和Fusobacterium丰度明显上升,与BC相比,差异均具有统计学意义(P<0.05或P<0.01);黄芪多糖灌胃后,镉染毒大鼠肠道中Prevotella、Bacteroides、Parasutterella、Elusimicrobium和Barnesiella丰度明显上升,Ruminococcus、Oscillibacter、Flavonifractor、ClostridiumXlVa、Roseburia、Lactobacillus、Ruminococcus2、Lachnospiracea_incertae_sedis、ClostridiumIV、ClostridiumXlVb、ClostridiumXI和Intestinimonas明显下降,同时出现了Saccharibacteria_genera_incertae_sedis,但Fusobacterium消失,与CD相比,差异均具有统计学意义(P<0.05或P<0.01),Fig 7B。
3 讨论
镉经消化道、皮肤、血液、淋巴液到达肝脏和肾脏后,在其内大量蓄积,通过血管内皮细胞变性、非实质细胞空泡化、功能性蛋白失活、氧化压力和脂质过氧化反应及炎症反应等多种途径,导致部分肝肾组织缺血、细胞线粒体、内质网和核仁功能紊乱及炎性损伤[11]。在病理学上表现为,肝细胞肿胀、坏死,胞核着色较浅,肝小叶边界不清,肝细胞索排列紊乱,大量炎性细胞浸润[12];肾脏表现为肾小管结构不完整,细胞肿胀、坏死,管腔内出现蛋白样沉淀,肾小球萎缩,细胞空泡化及炎性细胞浸润[11]。本研究中,镉染毒大鼠肝脏和肾脏HE染色结果与上述结论一致。同时,课题组前提研究表明,镉染毒后肝肾组织中MDA含量升高、SOD 活性降低、IL-2水平下降,提示肝肾组织的氧化压力和炎性反应增强[8]。
黄芪多糖为中药黄芪的重要活性成分,可通过抗氧化、增强机体免疫功能、调节炎症反应、利水等作用改善和保护镉中毒引起的肝肾损伤[13]。课题组前期研究证实,黄芪多糖灌胃可使镉染毒大鼠肝肾组织中MDA含量下降、SOD活性增加、IL-2水平升高[11]。本研究结果表明,经黄芪多糖灌胃处理后,镉染毒大鼠肝肾组织中镉含量明显下降、尿量增加、病理损伤减轻,两实验结果均证实黄芪多糖可通过上述作用改善由镉暴露引起的肝肾损伤,但其发生的具体机制尚待进一步探究。
近年来,随着肠道微生态研究的逐步深入,微生态作为机体的重要组织器官,其结构和功能得到进一步揭示[14]。中药来源的多糖既是人体所需的重要能量物质和疾病治疗的必要药物组分,也是肠道菌群的天然底物。已有研究表明,藜麦多糖、人参多糖、麦冬多糖等以底物诱导的方式调节肠道菌群结构和组成,同时肠道菌群亦可通过底物代谢产生的次生代谢产物促进肠道菌群的动态平衡和维持机体健康[15]。本研究发现,通过黄芪多糖灌胃处理正常大鼠后,肠道内菌群结构和多样性发生了较大的变化。从门水平而言,Firmicutes和Fusobacteria丰度明显下降,Bacteroidetes、Proteobacteria和Fibrobacteres明显增加,Elusimicrobia消失,CandidatusSaccharibacteria、Acidobacteria、Tenericutes和Spirochaetes显现。从属水平而言,Prevotella、Bacteroides和Parasutterella丰度明显上升,Ruminococcus、Oscillibacter、Flavonifractor、Roseburia、Lactobacillus、ClostridiumIV和ClostridiumXI明显下降,同时出现了Saccharibacteria_genera_incertae_sedis,但Fusobacterium消失。这一结果与吴莉等[16]基本一致。
镉具有较强的氧化应激诱导作用,低剂量镉的摄入就会引起肠壁细胞和蓄积组织或器官的代谢、分泌等功能异常,从而抑制菌群生长和降低细菌丰度,导致肠道菌群结构及稳态破坏,影响细菌排除体内有害物质和金属离子的作用[17]。本实验研究发现,从门水平而言,CdCl2的摄入明显抑制了Proteobacteria、Elusimicrobia和Fibrobacteres细菌的生长,相应细菌丰度下降,但促进了Fusobacteria和Actinobacteria生长,相应细菌丰度增加;从属水平而言,Ruminococcus、Bacteroides、Flavonifractor、Roseburia和Elusimicrobium细菌生长被抑制,相应细菌丰度下降,但Lactobacillus、Lachnospiracea_incertae_sedis、Parasutterella、Clostridium XlVb、Clostridium XI、Intestinimonas和Fusobacterium细菌生长得到促进,细菌丰度上升。由此可见,镉明显影响了肠道菌群的结构和细菌丰度,对肝肾造成了严重的损伤。
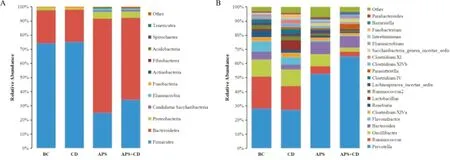
Fig 7 Relative abundances of top 10 phyla (A) and 20 genera (B) in each sample
经黄芪多糖灌胃后,从门水平而言,镉染毒大鼠肠道中Firmicutes细菌生长被限制,细菌丰度回落,Bacteroidetes、Proteobacteria、Elusimicrobia和Fibrobacteres细菌得到促进,细菌丰度回升;同时,Fusobacteria在肠道中消失,出现了Acidobacteria、Spirochaetes和Tenericutes细菌。从属水平而言,Prevotella、Bacteroides、Parasutterella、Elusimicrobium和Barnesiella细菌生长被促进、丰度回升,Ruminococcus、Oscillibacter、Flavonifractor、Clostridium XlVa、Roseburia、Lactobacillus、Ruminococcus2、Lachnospiracea_incertae_sedis、Clostridium IV、Clostridium XlVb、Clostridium XI和Intestinimonas细菌生长被抑制、丰度明显回落;同时,出现了Saccharibacteria_genera_incertae_sedis,但Fusobacterium消失。由此可见,黄芪多糖可在一定程度上通过调节肠道菌群结构来改善镉染毒大鼠的肝肾损伤。
总之,黄芪多糖和镉的摄入均可改变大鼠肠道菌群结构与多样性。然而菌群结构的变化在不同的实验研究报告中并不具有严格的规律性或一致性,其数据差异来源可能与实验动物异质性、饲养方式、肠道菌群的原始组成、镉的注射剂量、处理时间、DNA提取方式、测序技术平台和分析设定参数等因素有关。目前,镉染毒实验多选用大鼠、小鼠、家兔等为实验动物,以吸入、饮食和腹腔注射的方式建立实验动物模型。在本研究中,选用与人亲缘关系较近的啮类动物—大鼠,采用腹腔注射的方式能够快速、准确、科学地建立镉染毒大鼠动物模型,在实验设计和操作中尽量减少由于上述因素带来的偏差。虽然腹腔注射能够有效控制小鼠摄入体内的镉剂量和快速建立动物模型,但无法完全切实模拟人体正常摄入重金属镉的方式,从而导致实验数据与结果在不同的实验中出现一定的偏差。
腹腔注射CdCl2后,重金属镉可通过肠壁吸收、体液输送至肠腔、肝脏和肾脏,引起机体组织功能分泌异常,从而直接或间接导致大鼠肠道菌群结构生理平衡状态破坏,使得有害菌的种类和数量增加,有益菌的种类和数量相对减少或消失,严重抑制了菌群解毒和排毒的功能。随着重金属污染程度的日益加剧,采用重金属实验动物模型从肠道菌群结构角度揭密镉暴露对人体组织器官的功能危害的机制显得尤为必要。然而,目前对于镉中毒的治疗及体内蓄积镉的驱除,多采用具有吸附功能的螯合剂药物,通过螯合方式排出体外,但其仍然存在一定的安全性与有效性隐患。天然药物或其组分具有调节菌群结构能力强、解毒作用明确、来源广泛、毒副作用小、安全性高等优点,而成为目前预防重金属中毒的重要研发焦点。

