高尿酸血症实验动物模型研究进展
岳义松,张 雯,谢逸菲,秦雪梅,杜冠华
(1.山西大学中医药现代研究中心,山西 太原 030006;2.中国医学科学院北京协和医学院药物研究所,药物靶点研究与新药筛选北京市重点实验室,北京 100050)
高尿酸血症(hyperuricemia,HUA)是一种遍及全球的代谢性疾病,全球发病率为5%~25%[1],我国发病率估计已超过10%[2],且随着生活水平的不断提高,高热量、高脂肪、高蛋白摄入量增加,HUA患病率呈现上升和年轻化趋势。HUA已经成为高血压、高血脂、高血糖“三高”之后的第四高,严重危害人类健康。尿酸是人体内的正常代谢产物,血清中含量男性为149~416 μmol·L-1,女性为89~357 μmol·L-1。目前HUA的临床检验标准为:在正常饮食情况下,两次不同日空腹检测血清尿酸水平男性>416.0 μmol·L-1,女性>356.9 μmol·L-1[3]。临床上一般将HUA分为原发性HUA和继发性HUA,原发性HUA是由于先天性嘌呤代谢紊乱或尿酸排泄减少所引起,继发性HUA是由于疾病、药物治疗或饮食摄入不均衡引起。HUA易引起痛风、肾损伤,并与糖尿病、高血压、心血管等疾病有密切关系,且病情易反复发作。
HUA已经成为危害人民健康的常见病理表现,研究HUA的发病机制和防治药物是医药科学发展的重要任务。人类在进化过程中失去了尿酸酶,尿酸成为人类嘌呤类物质的最终代谢产物。而在常用的实验动物体内,依然保持着尿酸酶,可以直接将尿酸代谢为尿囊素而排泄。因此,常用实验动物一般不会出现HUA,这也是制备HUA实验动物模型的难点所在。目前,现有的HUA模型理论和技术趋于成熟,已在啮齿类,灵长类,禽类,鸟类和鱼类等机体上成功构建HUA模型,并根据HUA病理机制不同构建出不同类型的HUA模型,但存在模型不稳定、死亡率高、并发症严重、个体差异大等缺点,因此,建立稳定且能够反映临床病理特征的HUA动物模型具有重要意义。
1 尿酸和高尿酸血症
1.1 尿酸生成尿酸是一种弱有机酸,体内尿酸来源主要分为两种,一种是外源性即饮食摄取,约占总尿酸来源的20%;另一种由机体内的核酸等代谢分解而来,约占总尿酸的80%[4]。尿酸是人类嘌呤代谢的最终氧化产物,生成途径为腺嘌呤和鸟嘌呤经去氨基、去磷酸化分别形成肌苷和鸟苷,在酶的作用下分别生成次黄嘌呤和鸟嘌呤,又在黄嘌呤氧化酶的作用下转化为黄嘌呤,进一步转化为尿酸[5]
1.2 尿酸排泄尿酸的代谢途径主要分为肠道排泄和肾脏排泄,其中肠道排泄占25%,与尿酸转运蛋白和肠道菌群有关[6]。体内75%的尿酸经过肾脏排泄,但尿酸在经肾小球过滤后,约有90%被肾小管重吸收,少部分经肾小管排出体外[7]。尿酸转运蛋白参与尿酸排泄,通过对尿酸的分泌和肾小管重吸收的精细调控,调节体内尿酸浓度的动态平衡。
1.3 高尿酸血症正常机体内,尿酸的生成与排泄处于动态平衡,当平衡被打破,尿酸在体内浓度过高时,引发HUA。HUA使尿酸过饱和,以尿酸钠盐的形式形成结晶,沉淀在关节、滑膜、肾小管等处,引起痛风性关节炎、肾结石等疾病。HUA会增加急性肾损伤的风险,对肾小管上皮细胞造成伤害,长期如此,会引起慢性肾病。肾功能受损后,肾小球过滤等功能下降,尿酸排泄减少,导致尿酸浓度持续升高。临床上,90%的HUA患者是由于肾脏排泄能力下降所致[8]。
2 HUA模型检测技术
在评价模型是否成功,研究药效和机制等方面,检测指标和检测技术都至关重要,往往影响着实验结果。
尿酸是嘌呤代谢的终产物,是评价HUA模型的核心指标,采用磷钨酸还原法检测尿酸水平,在碱性环境中无蛋白滤液尿酸还原磷钨酸生成钨兰,钨兰的生成量与尿酸含量成正比,通过比色测定尿酸水平。肌酐(creatinine,Cr)是肌肉代谢的产物,由肾小球滤过排出,是评价肾脏滤过、重吸收能力的生化指标,采用苦味酸法检测Cr水平,碱性条件下,Cr与苦味酸产生Jaffe反应,生成黄色复合物,进行比色测定Cr水平。肾脏功能和肝脏功能也是HUA模型中不可忽视的评价指标,它们既能评价造模程度,也能评价药物对疾病的治疗效果和对机体的副作用。尿素氮(blood urea nitrogen,BUN)是人体蛋白质代谢的主要终末产物,从肾小球滤过后排出体外,当肾功能受损时,血液中BUN升高,是评价肾小球滤过功能的指标,采用脲酶-谷氨酸脱氢酶法检测尿素氮。丙氨酸转氨酶(alanine aminotransferase,ALT)、天冬氨酸转氨酶(aspartate aminotransferase,AST)是评价肝功能水平的常见指标,通常采用底物法检测。HUA与血糖血脂关系密切,总胆固醇(cholesterin,CHO)、甘油三酯(triglyceride,TG)和血糖等也是常见的检测指标。黄嘌呤氧化酶(xanthine oxidase,XOD)直接催化黄嘌呤生成尿酸,其活性对尿酸生成有着重要影响,是评价肝功能的常用指标,XOD主要分布在肝脏,当肝功能受损时,XOD 大量释放到血清中,采用黄嘌呤氧化酶活性检测试剂盒测定。肾脏离子转运体URAT1、OAT1、OAT2、OAT3、ABCG2,肠道转运体GLUT2、GLUT5、GLUT9等均参与尿酸调控,通常检测其mRNA水平和蛋白表达水平。丙二醛(malonaldehyde,MDA)是自由基发生氧化反应的最终氧化产物,含量反映机体或组织氧化水平,MDA可与硫代巴比妥酸缩合,形成红色产物,532 nm有最大吸收峰。肝肾脏通过HE染色制成石蜡切片,观察肾小球体积变化、内皮细胞、炎性细胞、肾小管内蛋白质变化等评价肝肾损伤程度。目前,评价HUA模型的指标和技术较为全面,但尚无统一的评价标准,理想的HUA模型应具备以下特点:(1)尿酸升高迅速;(2) HUA状态稳定;(3)减少非尿酸所致的组织病变;(4)HUA模型可复制。
3 高尿酸血症动物模型
根据HUA的形成机制,制备HUA动物模型主要有五种方法:①增加尿酸来源;②抑制尿酸排泄;③抑制尿酸代谢;④综合因素;⑤基因改造型。
3.1 增加尿酸来源制备动物模型通过对实验动物直接补充尿酸或补充尿酸前体物质制备HUA模型,如腺嘌呤、次黄嘌呤等,腺嘌呤是一种含氮杂环类嘌呤,机体摄入大量的腺嘌呤后,磷酸核糖焦磷酸与谷酰胺的水平显著增加,黄嘌呤氧化酶活性增加,加快尿酸的合成,从而提高血尿酸含量;次黄嘌呤是尿酸生成的直接前体物质,经酶分解转化成尿酸,短时间内尿酸大量产生,机体不能及时将尿酸转化为尿囊素,血液中尿酸水平显著升高。
实验动物给予大剂量的酵母、果糖等食物也可升高尿酸水平。酵母富含蛋白质,分解产生大量嘌呤碱和嘧啶碱,引起嘌呤代谢紊乱,从而促进尿酸的产生。果糖磷酸化分解需要消耗三磷酸腺苷(adenosine triphosphate,ATP),ATP进一步分解成腺嘌呤核糖核苷酸(adenosine monophosphate,AMP),AMP激活嘌呤代谢酶系统,被分解为尿酸。
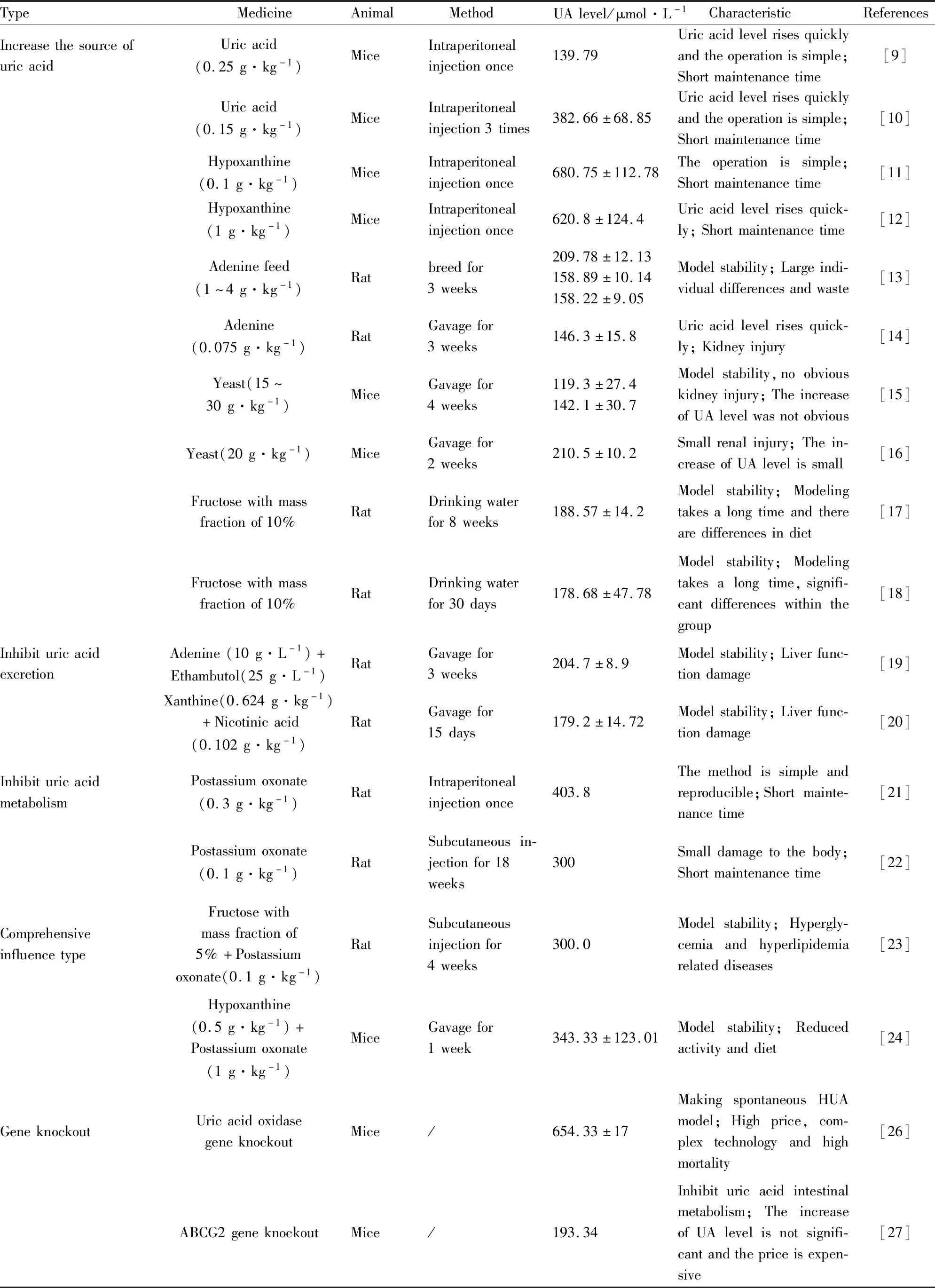
3.1.1尿酸法 给小鼠腹腔注射尿酸(0.125 ~0.5 g·kg-1),制备急性HUA模型。以0.25 g·kg-1注射剂量造模效果最好,在注射10 min后血尿酸水平最高,维持4 h以上。性别对该模型小鼠血清尿酸水平无影响,老年小鼠比青年小鼠更易构建HUA模型[9]。腹腔注射尿酸(0.15 g·kg-1)3次诱导形成HUA小鼠,与对照组相比,模型组尿酸值升高2.7倍,URAT1和GLUT9基因表达水平无变化,蛋白表达显著升高[10]。
3.1.2次黄嘌呤法 小鼠一次性腹腔注射给予次黄嘌呤(0.1 ~1 g·kg-1)造模,2 h、4 h、8 h测血清尿酸,尿酸浓度值显著升高。一次性腹腔注射0.1 g·kg-1次黄嘌呤,0.5 h 尿酸达到峰值680.75±112.78 μmol·L-1,4 h降到峰值一半,24 h后模型组尿酸仍显著高于对照组[11]。小鼠一次性腹腔注射次黄嘌呤(0.1 g·kg-1),45 min后测得模型组尿酸水平为对照组的3.8倍,XOD活力、URAT1的mRNA表达水平显著升高,但BUN、Cr、ALT和AST无显著差异[12]。
3.1.3腺嘌呤法 用含有腺嘌呤的饲料(1 ~4 g·kg-1)喂养大鼠,d 7中、高剂量组(2,4 g·kg-1)尿酸显著升高并到达峰值,随着持续给予腺嘌呤,血清尿酸浓度逐渐下降。d 14中、高剂量组肾间质被炎性细胞浸润,肾小管扩张,出现针状结晶,表明出现肾损伤[13]。大鼠连续3周灌胃给予腺嘌呤(0.075 g·kg-1),每周尾静脉取血,测尿酸、BUN、TG、Cr和MDA水平。造模1周后,模型组血清尿酸升高26.8%,造模3周后,尿酸升高43.3%,XOD活性显著下降,肾脏系数升高27.5%,BUN升高111.5%,Cr升高41.7%,MDA升高39.3%[14]。
3.1.4酵母法 连续用酵母膏(0~60 g·kg-1)灌胃给药,研究不同剂量酵母膏造模对小鼠尿酸水平的影响,高剂量组给药d 3小鼠出现死亡,d 4死亡一半,其余组小鼠尿酸水平显著升高,且存在量效关系;用0~30 g·kg-1酵母膏连续灌胃给药4周,第1周尿酸水平显著性升高,停药3 d后继续给药,尿酸水平下降,可能与肾脏排泄能力增强有关[15]。连续14 d灌胃给予酵母膏(20 g·kg-1)造模,与空白对照组相比,模型组小鼠血清尿酸、XOD和BUN水平显著增高,但Cr水平无显著差异[16]。
3.1.5果糖法 10%的果糖饮用水,大鼠连续饮用8周,模型组尿酸水平升高45.4%,XOD活性升高65.7%,十二指肠GLUT2、GLUT5蛋白表达水平显著升高[17]。大鼠连续给予10%果糖水,d 20起,模型组尿酸水平显著升高,肝脏XOD活性亦显著升高,但尿酸水平,尿酸清除率无差异,果糖转运体GLUT9的mRNA表达水平无显著差异[18]。
一次性直接补充尿酸或尿酸前体物质,可以快速升高尿酸水平,是较为简单快捷的方法,但不能够长期维持,若长期给药,又造成严重的并发症,如长期给药腺嘌呤可制备肾衰竭模型。通过长期给予酵母膏和果糖饮用水等诱导尿酸升高,模型较稳定,但由于无法控制每个实验动物的饮食饮水量,造成尿酸水平个体差异大,且浪费大。
3.2 抑制尿酸排泄制备动物模型尿酸主要通过肾脏排泄,肾小管上分布大量尿酸重吸收蛋白和尿酸分泌蛋白,通过抑制肾脏的排泄功能,增强尿酸重吸收、减少尿酸分泌,使尿酸在体内聚集,机体尿酸水平升高,造成HUA。常用的造模剂有乙胺丁醇,烟酸等,乙胺丁醇是一种抑菌性抗结核药物,可竞争性抑制近端小管中的尿酸分泌引起血清尿酸升高,维生素C属于酸性物质,当大剂量使用时,可使尿中草酸盐的含量增加10倍以上,对尿酸的正常代谢造成影响,从而引起HUA。烟酸即维生素B3,在人体内转化为烟酰胺,参与体内脂质代谢、组织呼吸的氧化过程和糖类无氧分解的过程,既能增加尿酸的产生,也能降低其清除率,对尿酸的升高成剂量依赖性。
Tab 1 Summary of hyperuricemia model
腺嘌呤(10 g·L-1)加乙胺丁醇(25 g·L-1)连续21 d大鼠灌胃给药。造模第1周,模型组出现脱毛,活动减少等现象,第3周,体质量相比对照组明显下降,尿酸、Cr和BUN水平显著升高,肾小球体积增大,出现空泡样,肾小管蛋白质渗出[19]。次黄嘌呤(0.624 g·kg-1)加烟酸(0.102 g·kg-1)连续15 d大鼠灌胃给药,模型组尿酸水平为(179.2±14.72) μmol·L-1,Cr水平为(46.6±10.02) μmol·L-1,BUN水平为(7.9±0.45) μmol·L-1,显著高于对照组[20]。
乙胺丁醇用于抗肺结核,烟酸是人体必需维生素,它们作为药物被患者服用,此类模型可用于模拟由于药物减少或抑制尿酸排出导致的HUA。联合氧嗪酸钾造模,能长时间维持高尿酸水平,但停药后,尿酸水平会立刻下降。
3.3 抑制尿酸代谢制备动物模型尿酸酶存在于啮齿类动物体内,尿酸可通过尿酸酶代谢为尿囊素排出体外,因此抑制尿酸酶可抑制尿酸排泄,从而升高尿酸水平。氧嗪酸钾为三氮杂苯类化合物,其结构与尿酸的嘌呤环相似,能选择性抑制尿酸酶活性,是常用的HUA动物模型造模剂。
大鼠一次性腹腔注射氧嗪酸钾(0.1~0.6 g·kg-1)制备急性HUA模型。结果显示给药1 h后血清尿酸逐渐升高,2 h达到顶点值,0.3 g·kg-1剂量组大鼠血清尿酸值可升至403.8 μmol·L-1,并能维持4 h[21]。分别用5%果糖水加0.1 g·kg-1氧嗪酸钾,5%果糖水和0.1 g·kg-1氧嗪酸钾三种造模方式,连续18周大鼠皮下注射给药。第1周,联合给药组血清尿酸显著升高,第2周开始,两个单一给药组血清尿酸也显著升高,至第4周,与正常组相比,差异消失,联合给药组持续存在差异,尿酸水平维持在300 μmol·L-1,整个实验期间动物身体精神状况健康[22]。
氧嗪酸钾作为尿酸酶抑制剂,可以排除尿酸酶的干扰,模拟人类内无尿酸酶。单独给药能在短时间内造成HUA模型,但排泄快,单独使用无法长期造模,常采用联合给药方式。
3.4 综合因素模型增加尿酸生成的同时,减少尿酸的排泄,此类多重因素影响下的造模方式,比单一给药造模方式更稳定,尿酸水平升高更显著。如给予氧嗪酸钾的同时,再给予尿酸前体物质或富含嘌呤食物。
分别用酵母(30 g·kg-1)、次黄嘌呤(1 g·kg-1)、氧嗪酸钾(0.25 g·kg-1)、腺嘌呤(0.1 g·kg-1)加乙胺丁醇(0.25 g·kg-1)4种造模方式,连续14 d灌胃给药,模型组尿酸值均显著升高,其中以氧嗪酸钾造模效果最显著,升高108%[23]。用次黄嘌呤(0.3 g·kg-1)加氧嗪酸钾(0.25 g·kg-1)、次黄嘌呤(0.3 g·kg-1)加氧嗪酸钾(0.75 g·kg-1)、次黄嘌呤(0.5 g·kg-1)加氧嗪酸钾(1 g·kg-1)、氧嗪酸钾(1.5 g·kg-1)共4个模型组,小鼠连续7 d灌胃给药,探究出最佳造模剂量为次黄嘌呤(0.5 g·kg-1)加氧嗪酸钾(1 g·kg-1),但该组小鼠造模期间出现饮食及活动减少[24]。
3.5 基因改造制备动物模型在大小鼠尿酸排泄过程中,尿酸被尿酸酶氧化分解为尿囊素排出体外,通过敲除尿酸酶基因,可抑制尿酸的转化,从而升高尿酸水平。在肾脏排泄途径中,肾小管起分泌尿酸作用,通过敲除参与尿酸分泌的肾小管转运体蛋白基因,抑制肾小管的尿酸分泌,可升高尿酸水平[25]。
Wu等[26]在胚胎干细胞中通过同源重组敲除小鼠的氧化酶基因,构建一种HUA小鼠模型。150只纯合突变小鼠有97只在出生4周内死亡,死亡率达到65%。纯合突变小鼠血清尿酸是野生型和杂合型的10倍,但过早出现肾脏损坏,在出生6 d后,肾脏出现皮质囊肿和沉积物,8 d后观察到肾小管再生和扩张,第五周出现严重的肾积水。通过腹腔注射给予别嘌醇(150 g·L-1)治疗,纯合突变体小鼠血清尿酸降低约50%,存活率提高31.1%。
Takada等[27]在研究小鼠ABCG2基因敲除对尿酸排泄途径的影响时发现,该基因对尿酸肠道排泄途径影响较大,对肾脏排泄途径无影响,尿酸水平升高不明显,联合氧嗪酸钾造模可以获得较好的效果。
4 制备高尿酸血症模型的动物选择
合适的实验模型是研究疾病的病理机制和研发相应治疗药物的基础。不同的动物模型具有各自的特点,选择适合研究的模型至关重要。目前,HUA模型所用的实验动物主要有啮齿类、禽类,亦有研究人员选用灵长类动物和斑马鱼作为模型动物。常用的给药方式有灌胃、腹腔注射和饲喂等。
啮齿类动物HUA模型:啮齿类动物属哺乳动物,在种属上与人相近,是最常用的实验动物,成本低,管理方便。但在复制HUA模型时,因动物体内存在尿酸酶,与人的患病机制存在很大差别,因此常用氧嗪酸钾与其他造模剂联合给药造模,以消除尿酸酶的差异。大鼠常用SD大鼠和Wistar大鼠,小鼠常用昆明小鼠和C57BL/6小鼠。
禽类动物HUA模型:禽类动物体内不含尿酸酶,尿酸是最终产物,因此会发生禽痛风,鸡、火鸡、水禽、雉、鸽子等都可发生痛风。在一些鸡场常发生禽痛风,死亡率高达30%[28]。禽类嘌呤代谢途径与人相似,但因种属差异太大,且饲养不方便,故选用此类动物的较少。
其它动物HUA模型:灵长类动物与人同源,在尿酸代谢途径上与人一样,是最优的模型动物,但成本高昂。Tang等[29]将Cr(0.075~0.2 g·kg-1)腹腔注射于恒河猴体内,30 min后,血清尿酸值从0 h的(51.77±14.48) μmol·L-1升高至(178.32±14.47) μmol·L-1,1 h达到峰值(201.41±42.73) μmol·L-1,成功建立急性HUA模型。Zhang等[30]选用氧嗪酸钾(200~400 μmol·L-1)和黄嘌呤(10~20 μmol·L-1)联合浸泡孵化后5 d的斑马鱼幼鱼,成功构建HUA急性模型,以别嘌醇作为阳性药物验证模型,为大量筛选降尿酸药物提供了一种新思路。
5 讨论与展望
近年来,研究者对HUA动物模型的建立做出了很多创新和探索,建立了各种不同机理的HUA模型,以期满足临床上HUA患者,但依然存在一定差距和各种问题。一是缺乏统一的造模评价标准,二是动物模型与人类患病机理存在差距。评价一个模型是否制备成功,需要测定各项指标是否满足模型标准,目前尚无认可的、统一的评价指标。大多由研究者自主评价,依靠统计学对比模型组与空白对照组是否有差异,若有差异,则认为造模成功,但无确切的差异标准。且评价模型时,指标选取单一,不够全面,大部分仅仅考察尿酸和肌酐水平。人类HUA 80%为多基因遗传病,受遗传因素影响,与环境和生活方式相关,发病机制复杂。实验模型则发病原因单一,不能完全模仿人类发病机制。文章中所总结的造模类型,也仅仅是从五种单一的发病机制来构建模型,若要建立一种复杂的模型,则在动物身上无法承受,造模引发的严重并发症导致实验动物死亡。动物造模后往往会出现不同程度的肾脏损伤,这种损伤是由HUA导致的并发症还是造模剂的副作用还需进一步考察。性别对造模的影响也无统一结论,有研究发现雌鼠的尿酸波动大,但也有研究发现性别对HUA造模无影响,性别因素还需进一步研究。现阶段常用的实验动物以大鼠为主,造模方法多采用尿酸酶抑制剂氧嗪酸钾加尿酸前体物等联合给药,这类方法较稳定,能长期实验,对动物机体损害小。但人类的病情远比动物模型复杂,寻找到科学、稳定、可重复性高的造摸方法,是我们不断追求的目标。

