补阳还五汤通过PI3K/AKT通路调控自噬抗大鼠脑缺血/再灌注损伤的作用
单玉栋,赵艳萌,靳晓飞,周晓红,叶佳蓓,马秀娟,田 甜,蔡国英,高维娟
(河北中医学院,河北省心脑血管病中医药防治研究重点实验室,河北 石家庄 050091)
脑卒中是人类第二大死亡原因,也是导致残疾的主要原因,给家庭与社会造成巨大的经济损失,缺血性脑卒中是其最常见的类型之一[1]。因此,更有效的防治缺血性脑卒中是迫切需要解决的重要问题。由动脉闭塞引起的缺血性卒中,通过静脉溶栓和血管内血栓清除术进行快速再灌注是治疗的重点。中医认为,缺血性脑卒中属于“中风”范畴,气虚血瘀是其根本病因,补气活血化瘀是治疗要义。在治疗上与现代医学有异曲同工之妙。
中医药是治疗脑卒中的重要疗法之一,补阳还五汤是治疗缺血性脑卒中和卒中致残的经典方剂,已经有数百年的历史。补阳还五汤出自清·王清任的《医林改错》,方名寓含治法,是补气活血的代表方剂之一。从中医的观点来看,该汤用于改善经络气血,促进血液循环,广泛应用于缺血性脑卒中的临床防治。已有文献[2]及本课题组前期研究表明,补阳还五汤通过调节自噬减轻大鼠脑缺血/再灌注损伤,但其具体作用机制尚待进一步探究。
研究表明PI3K/AKT通路对脑缺血/再灌注后的细胞存活至关重要[3]。因此,本研究将通过大鼠大脑中动脉阻塞再灌注(middle cerebral artery occulusion/ reperfusion,MCAO/R)模型为研究对象,探讨补阳还五汤是否通过PI3K/AKT通路调控自噬起到神经保护作用。
1 材料
1.1 实验动物♂,体质量(220~250)g,SPF级,SD大鼠50只,购自北京维通利华实验动物技术有限公司,许可证号:SCXK(京)2016-0011。本实验经河北中医学院伦理委员会批准(批准文号:DWLL2020075),所有操作符合实验动物伦理要求。
1.2 主要试剂与耗材PI3K通路抑制剂LY294002(HY-10108)购自MCE公司;p62抗体(18420-1-AP)购自Proteintech公司;β-actin抗体(23660-1-AP)购自Proteintech公司;SDS-PAGE试剂盒、Cy3标记山羊抗兔IgG(A0516)、抗荧光淬灭封片液含DAPI(P0131)购自beyotime公司;LC3B抗体(L7543)购自SIGMA公司;LC3B抗体(ZRB100)购自SIGMA公司;PI3K抗体(4249S)、AKT抗体(4691S)、p-AKT抗体(4060S)购自CST公司;苏木精染液(G1004-100ML)、伊红染液(G1001-100ML)、TTC(G1017)购自servicebio公司;MCAO线栓(2636-A3)购自北京西浓公司;黄芪120 g,当归6 g,地龙3 g,川芎3 g,赤芍5 g,桃仁3 g,红花3 g,购自北京同仁堂有限公司后本课题组进行液相色谱-质谱(HPLC-MS)联用技术,检测补阳还五汤中黄芪甲苷含量为0.133 mg·g-1生药、毛蕊异黄酮苷含量为0.139 mg·g-1生药、芍药苷含量为0.492 mg·g-1生药、阿魏酸含量为0.04 mg·g-1生药并做成冻干粉。
1.3 主要仪器51700全自动脑立体定位仪(Stoelting公司);EG11508组织包埋机(Leica公司);RM2255全自动轮转切片机(Leica公司);DM5000B光学显微镜(Leica公司);THUNDER免疫荧光显微镜(Leica公司);Fusion FX5 Spectra成像系统(Vilber公司);Varioskan LUX多功能微孔板读数仪(Thermofisher公司),恒压电泳仪及转膜仪(Bio-Rad公司)。
2 方法
2.1 动物分组、动物模型制备及脑室内注射随机将50只SD大鼠分为假手术组(Sham)10只、模型组(Model)10只、补阳还五汤组(BYHWD)10只、PI3K抑制剂组(LY294002)10只与溶媒剂组(Vehicle)10只。补阳还五汤组大鼠造模完成后,应用补阳还五汤冻干粉3.02 g·kg-1·d-1灌胃处理。大鼠MCAO/R模型制备参照本课题组前期基础[4-5],1%戊巴比妥钠(50 mg·kg-1)麻醉,在颈前横过矢状面做中线切口,结扎颈外动脉远端。4-0单丝尼龙线结扎颈外动脉近端,并将多聚赖氨酸包被的线栓经颈内动脉送入大脑中动脉,MCAO 2 h后撤回线栓并结扎端口。72 h后进行各项检测。手术全过程使用加热垫,使大鼠保持37 ℃肛温。
LY294002溶于DMSO后加入Tween-80助溶,后用生理盐水稀释到20 μmol·L-1,MCAO造模前30 min取5 μL进行脑立体定位注射[6]。在颅骨钻孔,将10 μL Hamilton注射器的针头经颅骨钻孔插入左侧脑室。定位注射参数[7]:以前囟为坐标零点定位,AP为0.8 mm;ML为1.4 mm;DV为3.6 mm,1 μL·min-1注射完毕后留针15 min拔针,消毒缝合。
2.2 大鼠神经功能学评分采用盲法对各组大鼠进行Zea longa[8]评分:无神经功能损伤0分;不能完全伸展对侧爪1分;向手术对侧转圈2分;向手术对侧倾倒3分;意识丧失4分。选择1~3分大鼠入组。
2.3 脑梗死体积测定断头取脑,-20 ℃中冷冻30 min,切成冠状面切片,厚度2 mm。放入小培养皿中,37 ℃ 0.5% TTC避光孵育20 min,中途翻面1次,吸出多余的TTC,放入4%多聚甲醛中固定24 h后拍照。梗死体积/%=(正常侧半脑面积-梗死侧正常面积)/2×正常侧半脑面积×100%[9]。
2.4 HE染色观察脑组织病理损伤大鼠麻醉后,心脏灌流快速取脑。4 ℃中性甲醛固定48 h,石蜡包埋,行冠状切片,厚5 μm。进行HE染色,光学显微镜下拍照,观察脑组织IP神经细胞的损伤情况。
2.5 免疫荧光检测LC3B表达石蜡切片常规脱蜡、脱水、抗原修复、双氧水封闭。免疫染色封闭液封闭15 min,LC3抗体(1 ∶200)4 ℃过夜。Cy3标记山羊抗兔IgG(1 ∶500)37 ℃避光孵育1 h,封片液封片。Leica荧光显微镜拍摄图片并分析荧光强度。
2.6 Western blot检测相关蛋白提取大鼠缺血侧半暗带蛋白,测定组织蛋白浓度。将蛋白经SDS-PAGE分离湿转至PVDF膜,5%牛血清白蛋白室温封闭,将膜与一抗LC3(1 ∶1 000)、p62(1 ∶2 000)、PI3K(1 ∶1 000)、p-AKT(1 ∶2 000)、AKT(1 ∶1 000)4 ℃孵育过夜,二抗(1 ∶20 000)37 ℃孵育1 h,混合ECL A/B液,置于多功能成像系统中显影,用软件对条带灰度值进行分析。
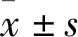
3 结果
3.1 补阳还五汤对神经功能缺损的影响与Sham组比较,大鼠MCAO/R后,Model组神经功能缺损明显(P<0.01);与Model组比较,BYHWD组神经功能缺损明显改善(P<0.05);BYHWD改善神经功能缺损的作用被LY294002降低(P<0.05);BYHWD组与Vehicle组比较差异无统计学意义(P>0.05)。见Fig 1。
3.2 补阳还五汤对脑梗死体积的影响与Sham组比较,大鼠MCAO/R后,Model组脑梗死体积明显增加(P<0.05);与Model组比较,BYHWD组脑梗死体积明显缩小(P<0.05);BYHWD降低脑梗死体积的作用被LY294002所减弱(P<0.05);BYHWD组与Vehicle组比较差异无统计学意义(P>0.05),见Fig 2。

Fig 1 Neurological scores of each 1:Sham;2:Model;3:BYHWD;4:BYHWD+LY294002;5:BYHWD+Vehicle.##P<0.01 vs Sham,*P<0.05 vs Model,^P<0.05 vs BYHWD and BYHWD+Vehicle.
3.3 补阳还五汤对脑组织缺血半暗带病理损伤的影响Sham组大鼠脑组织IP形态结构正常,细胞形态清晰,结构致密,核仁清晰;Model组脑组织IP空泡化严重,大量神经元丢失和死亡,部分核溶解和凝聚;与Model组比较,BYHWD组大鼠脑组织IP损伤情况明显缓解;BYHWD改善大鼠脑组织IP病理损伤的作用被LY294002所抑制;BYHWD组与Vehicle组比较无差异,Fig 3。
3.4 补阳还五汤对大鼠脑组织LC3B免疫荧光表达的影响大鼠MCAO/R后,与Sham组比较,Model组大鼠脑组织LC3B荧光表达升高(P<0.05);与Model组比较,BYHWD组大鼠脑组织LC3B荧光表达降低(P<0.05);BYHWD降低大鼠脑组织LC3B荧光强度的作用被LY294002所减弱(P<0.05);BYHWD组与Vehicle组比较差异无统计学意义(P>0.05),见Fig 4。
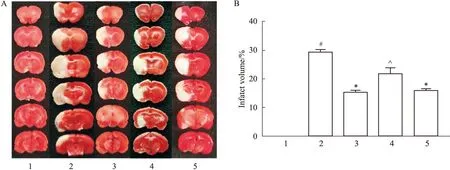
Fig 2 Representative pictures of TTC staining and relevant quantitative 1:Sham;2:Model;3:BYHWD;4:BYHWD+LY294002;5:BYHWD+Vehicle.A:Representative pictures of brain sections stained with TTC;B:Percentage of volume.#P<0.05 vs Sham,*P<0.05 vs Model,^P<0.05 vs BYHWD and BYHWD+Vehicle.

Fig 3 HE staining of brain tissues in each group of rats(Scale=50 μm)Representative images of HE staining in the rat cerebral ischemic penumbra.A:Sham;B:Model;C:BYHWD;D:BYHWD+LY294002;E:BYHWD+Vehicle.
3.5 补阳还五汤对各组PI3K,p-AKT,AKT蛋白表达的影响大鼠MCAO/R后,相对于Sham组,Model组通路蛋白PI3K与p-AKT/AKT表达明显降低(P<0.05);与Model组比较,BYHWD组通路蛋白PI3K与p-AKT/AKT表达明显升高(P<0.05);BYHWD的调控作用被LY294002所抑制(P<0.05);BYHWD组与Vehicle组比较差异无统计学意义(P>0.05),见Fig 5。
3.6 补阳还五汤对各组自噬标志蛋白LC3、p62的影响Sham组比较,Model组LC3Ⅱ/Ⅰ表达升高,p62表达降低(P<0.05);与Model组比较BYHWD组LC3Ⅱ/Ⅰ表达降低,p62表达升高(P<0.05);BYHWD降低LC3Ⅱ/Ⅰ与升高p62表达的作用被LY294002所减弱(P<0.05);BYHWD组与Vehicle组比较差异无统计学意义(P>0.05),见Fig 6。
4 讨论
缺血性脑卒中是临床常见病,当大脑某个区域的血液供应因栓塞或血栓而突然中断,进而导致相应的神经功能障碍甚至脑细胞死亡时,就会发生缺血性脑卒中。缺血性脑卒中患者最初的临床缺陷很大程度上是由大脑中低灌流、生物电异常的缺血性半暗带所致[10]。随着时间的推移,这一区域逐渐转化为不可逆转的损伤组织即缺血核心区。因此,梗死组织半暗带恢复再通是治疗首选,但脑缺血/再灌注会引发一系列生化和细胞损伤。
细胞自噬是脑缺血/再灌注后细胞死亡的重要途径之一。自噬是一种自我保护的细胞分解代谢途径,通过该途径,不需要的蛋白质被降解成代谢元素,并被循环利用,进而维持细胞自身的动态平衡和其正常生命活动[11-12]。在分子角度上,自噬主要由多个自噬相关基因(Atg)执行,同时也受多种信号网络调节。自噬小体的形成过程需要两个泛素样蛋白Atg12和Atg8,LC3-Ⅰ存在于胞质中,是Atg8蛋白家族中最具特征性的成员。在磷脂酰乙醇胺参与下LC3-Ⅰ偶联形成LC3-Ⅱ,LC3-Ⅱ参与自噬体膜的形成,因此LC3Ⅱ/Ⅰ的变化反应自噬程度[13]。p62(也称SQSTM1蛋白)是负责溶酶体降解的自噬适配器,可以被自噬机制识别,运送到溶酶体并进行降解,故自噬发生时p62含量下降[14]。有研究表明[15-16]基于自噬的PI3K/AKT通路在脑缺血/再灌注损伤中扮演着重要的角色。
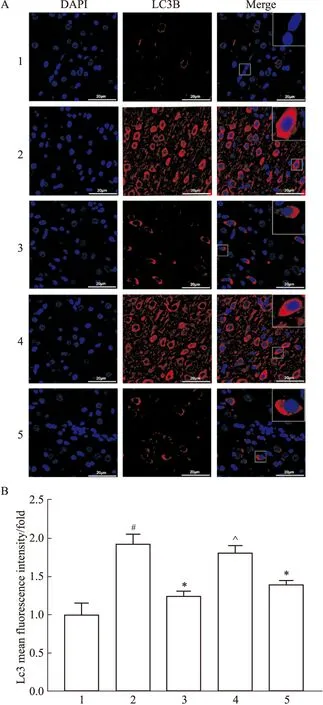
Fig 4 Representative immunofluorescence staining images of LC3B in each group n=3)1:Sham;2:Model;3:BYHWD;4:BYHWD+LY294002;5:BYHWD+Vehicle.A:Representative immunofluorescence staining images of LC3B in each group B:Analysis of LC3B mean fluorescence intensity of each group.#P<0.05 vs Sham,*P<0.05 vs Model,^P<0.05 vs BYHWD and BYHWD+Vehicle.

Fig 5 The protein expressions of PI3K,p-AKT and AKT in each n=3)1:Sham;2:Model;3:BYHWD;4:BYHWD+LY294002;5:BYHWD+Vehicle.A:Representative Western blot images of PI3K,p-AKT and AKT levels.B:PI3K and p-AKT/AKT expression.#P<0.05 vs Sham,*P<0.05 vs Model,^P<0.05 vs BYHWD and BYHWD+Vehicle.

Fig 6 The protein expressions of LC3Ⅰ,LC3Ⅱ and p62 in each n=3)1:Sham;2:Model;3:BYHWD;4:BYHWD+LY294002;5:BYHWD+Vehicle.A:Representative Western blot images of LC3Ⅰ,LC3Ⅱ and p62 levels.B:LC3Ⅱ/LC3Ⅰ ratio.C.p62 expression.#P<0.05 vs Sham,*P<0.05 vs Model,^P<0.05 vs BYHWD and BYHWD+Vehicle.
本研究以大鼠MCAO/R模型,模拟脑缺血/再灌注过程。实验结果表明补阳还五汤能够改善大鼠脑缺血/再灌注引起的损伤,同时能够使PI3K,p-AKT/AKT,LC3Ⅱ/Ⅰ表达升高,使p62表达降低。而LY294002能够减弱补阳还五汤的保护作用。综上所述,补阳还五汤能够通过激活PI3K/AKT通路抑制自噬抗大鼠脑缺血/再灌注损伤。

