奥沙利铂通过内质网应激PERK-eIF2α-ATF4通路诱导口腔鳞癌HSC-3细胞凋亡发生的研究
李惠如,杨治鑫,高子媛,郑 翔,耿娜娜
(1.遵义医科大学 贵州省普通高等学校口腔疾病研究特色重点实验室暨遵义市口腔疾病研究重点实验室,贵州 遵义 563099;2.遵义医科大学 口腔医学院,贵州 遵义 563099;3.遵义医科大学 基础医学院医学遗传学教研室,贵州 遵义 563099)
口腔癌约占口腔恶性肿瘤的90 %,全球每年约有超过30万新发病例,占总新发肿瘤病例数的2.1 %[1]。其中,口腔鳞状细胞癌(Oral squamous cell carcinoma,OSCC)约占口腔癌的90 %,主要包括发生在舌前2/3、唇颊部、口底、牙龈、磨牙后三角和硬腭等8个不同部位的亚群[2]。尽管存在包括免疫疗法[3]在内的多种新方法,但目前临床上对OSCC的治疗主要以手术为主,并且在现阶段放化疗仍是重要的辅助治疗手段[4]。铂类药物是目前使用最广泛的抗癌药物之一,可通过与肿瘤细胞DNA交联形成Pt-DNA加合物,阻止肿瘤细胞DNA的复制和转录,并最终诱导肿瘤细胞凋亡。近年来,第三代铂类广谱抗癌药物奥沙利铂(Oxaliplatin,OXA)广泛用于临床,它能有效降低肿瘤细胞的耐药性,对肝、肾、胃肠道和骨髓的毒性较顺铂和卡铂明显降低,具有良好的耐受性[5]。最近的研究发现,OXA对结直肠癌[6]、胃癌[7]、胰腺癌[8]和胆管癌[9]等均有较好的抗肿瘤效果。
内质网(Reticulum stress, ER)中的蛋白质处理、修饰和折叠是决定细胞功能、命运和存活的严格调控过程。研究发现,内质网应激(Endoplasmic reticulum stress,ERS)不仅发生在正常细胞中,与肿瘤细胞也有着密切关系,影响着肿瘤的存活、自噬、迁移、侵袭等[10]。在短期应激下,细胞发生的内质网应激能够通过多种机制适应性恢复其稳态,机制之一则是通过蛋白肌酶R样内质网激酶-真核起始因子2α-活性转录因子4(Protein kinase R-like ER kinase-eukaryotic initiation factor 2α-activating transcriptional factor 4,PERK-eIF2α-ATF4)通路实现的[11]。但长期应激状态下会最终导致细胞发生凋亡。此外PERK-eIf2信号传导和ATF4蛋白的表达也被证明是肿瘤侵袭和转移所必需的[12-13]。因此,实现对肿瘤细胞内质网应激PERK-eIF2α-ATF4通路的调控在抗肿瘤治疗过程中具有重要的作用。
目前在口腔领域中,关于OXA对OSCC抑制作用的相关文献较少,报道主要涉及DNA损伤[14]、氧化应激[15]等信号通路,鲜有其机制与ERS的报道。而近年来,奥沙利铂也已被证明能够通过ERS诱导乳腺癌细胞的凋亡[16]。因此,本课题通过探讨OXA对口腔鳞癌HSC-3细胞杀伤作用中ERS及其主要信号通路PERK-eIF2α-ATF4的影响,以期为OSCC的临床化疗方案提供新的分子靶点和理论依据。
1 材料
1.1 仪器 二氧化碳培养箱购自美国Themo scientific公司;倒置荧光显微镜购自日本Olympus公司;多功能酶标仪购自美国分子仪器公司;生物洁净工作台购自中国苏州安泰空气技术公司;蛋白免疫印迹系统购自美国Bio-Rad公司;低温冷冻离心机购自美国Themo scientific公司;Real-time PCR检测仪购自美国Bio-Rad公司;超微量核酸蛋白定量仪购自美国Thermo Fisher公司;流式细胞仪购自德国Beckman Coulter公司。
1.2 试剂 口腔鳞癌细胞系HSC-3,由中国科学院细胞库提供;DMEM高糖培养基购自美国Thermo Fisher公司(Gibco,货号:C11965500BT);使用来自AusGeneX的胎牛血清(货号:FBS500-S);OXA、CCK-8、DAPI和ANNEXIN V- FITC/PI 凋亡检测试剂盒均购自北京索莱宝公司(货号分别为:O3390、CA1210、C0065和CA1020);Glucose regulated protein78 (GRP78)、PERK、eIF2α、ATF4、 C/EBP-homologous protein (CHOP)、Caspase3和GAPDH抗体均购自ProteinTech公司(货号分别为:11587-1-AP、24390-1-AP、11170-1-AP、10835-1-AP、15204-1-AP、19677-1-AP、10494-1-AP);Phospho-PERK(Thr980)抗体(Bioss, 货号:bs-3330R);山羊抗兔二抗(ProteinTech,货号:SA00001-2);TB Green Premix Ex Taq II、Trizol和逆转录试剂盒均购自TAKARA公司(货号分别为:RR820A、9108和RR037A)。
2 方法
2.1 细胞培养 口腔鳞癌HSC-3细胞系使用DMEM高糖培养基(含10 %胎牛血清、2.0 g/L NaHCO3、100 μg/mL链霉素及100 U/mL青霉素),置于二氧化碳培养箱(5 % CO2、恒温37 ℃、湿度饱和)中培养,每隔2~3天传代。
2.2 细胞增殖率检测 将HSC-3细胞(接种密度为8×103/mL)接种于96孔板中,培养24 h后,采用不同浓度(10、20、30、40、50 mg/L)的OXA处理细胞,同时设置对照组,OXA处理24 h后每孔加入10 μL CCK-8溶液,于培养箱中避光培养2 h后使用酶标仪检测在450 nm处细胞的吸光值(A),检测各组细胞增殖率。细胞增殖率=(实验组A值-空白对照组A值)/(阴性对照组A值-空白对照组A值)×100 %,最后计算出药物的半数有效浓度(Half maximal inhibitory concentration, IC50)。其中,阴性对照组细胞增殖率记为100 %。
2.3 DAPI染色 将HSC-3细胞(接种密度为2.4×105/mL)接种于6孔板中,静置培养24 h后,分别采用0、20、40、80 mg/L OXA处理细胞,对照组中加入等体积的培养基。处理24 h后,加入2 mL PBS缓冲液漂洗2次,经丙酮固定10 min后,再次用PBS溶液漂洗2次,最后用DAPI溶液避光染色10 min,于荧光显微镜下观察细胞核变化并采集图像。
2.4 流式细胞术检测细胞凋亡率 将HSC-3细胞(接种密度为3×105/mL)接种于6孔板中,静置培养24 h后,分别采用0、20、40、80 mg/L OXA处理细胞,24 h后收集细胞。用缓冲液漂洗2次,离心后使用Annexin V/PI 进行染色。室温下避光反应15 min后,再用适量缓冲液重悬细胞,置于流式细胞仪中,检测活细胞百分率、早期凋亡细胞百分率、晚期凋亡细胞百分率和坏死细胞百分率。计算细胞的总凋亡率,总凋亡率=早期凋亡细胞百分率+晚期凋亡细胞百分率+坏死细胞百分率。
2.5 实时荧光定量PCR(RT- qPCR) 不同浓度(20、40、80 mg/L)的OXA处理细胞24 h后,收集细胞并提取细胞总RNA,根据试剂盒步骤,将其逆转录合成cDNA,逆转录条件:37 ℃、15 min,85 ℃、5 sec,4 ℃。PCR引物序列如下:GRP78,F:5′-TCAAGTTCTTGCCGTTCAAGG-3′, R:5′-AAATAAGCCTCAGCGGTTTCTT-3′;PERK,F:5′-ACGATGAGACAGAGTTGCGAC-3′R:5′-ATCCAAGGCAGCAATTCTCCC-3′;eIF2α,F:5′-GAAGGCGTATCCGTTCTATCAAC-3′,R:5′-AGCAACATGACGAAGAATGCTAT-3′;ATF4,F:5′-ATGACCGAAATGAGCTTCCTG-3′,R:5′-GCTGGAGAACCCATGAGGT-3′;CHOP,F:5′-CAAGAGGTCCTGTCTTCAG1ATGA-3′,R:5′-TCTGTTTCCGTTTCCTGGTTC-3′;Caspase3,F:5′-GAAATTGTGGAATTGATGCGTGA-3′,R:5′-GAAATTGTGGAATTGATGCGTGA-3′;GAPDH,F:5′-AGAAGGCTGGGGCTCATTTG-3′,R:5′-AGGGGCCATCCACGTCTTC-3′。实时荧光定量PCR反应体系总体积为20 μL,包括无菌水7 μL、TB Green Premix Ex Taq II 10 μL 、正向引物1 μL、反向引物1 μL、cDNA 1 μL。 扩增条件:95 ℃ 30 s,(95 ℃ 5 s,58 ℃ 30 s)39个循环,95 ℃ 10 s。将GAPDH设置为内参基因,并采用2-ΔΔCt法对目的基因的相对表达量进行计算。
2.6 蛋白免疫印迹(Western blot) 采用不同浓度(20、40、80 mg/L)的OXA处理HSC-3细胞24 h后裂解细胞,并提取细胞总蛋白,采用BCA法测定蛋白浓度,根据所需蛋白量取相应体积样品进行变性,并完成制胶、上样、电泳、转膜、脱脂牛奶封闭、孵育一抗(PERK 1∶1 000,p-PERK 1∶1 000,GRP78 1∶2 000,eIF2α 1∶1 000,ATF4 1∶1 000,CHOP 1∶1 000,GAPDH 1∶10 000,Caspase3 1∶1 000)和二抗(1∶2 000)、曝光与显影。
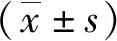
3 结果
3.1 OXA抑制HSC-3细胞的增殖 参考OXA体外诱导其他肿瘤细胞的凋亡用药浓度梯度[16-17],本实验最终采用0、10、20、30、40、50 mg/L的OXA处理HSC-3细胞,并用 CCK-8法检测细胞的增殖率。结果显示,与对照组相比,不同浓度的OXA均能抑制HSC-3细胞的增殖(P<0.05或P<0.01),且均呈剂量依赖性,其中半数有效抑制浓度IC50为40 mg/L(见图1),因此本研究后续实验采用20、40、80 mg/L浓度的OXA。
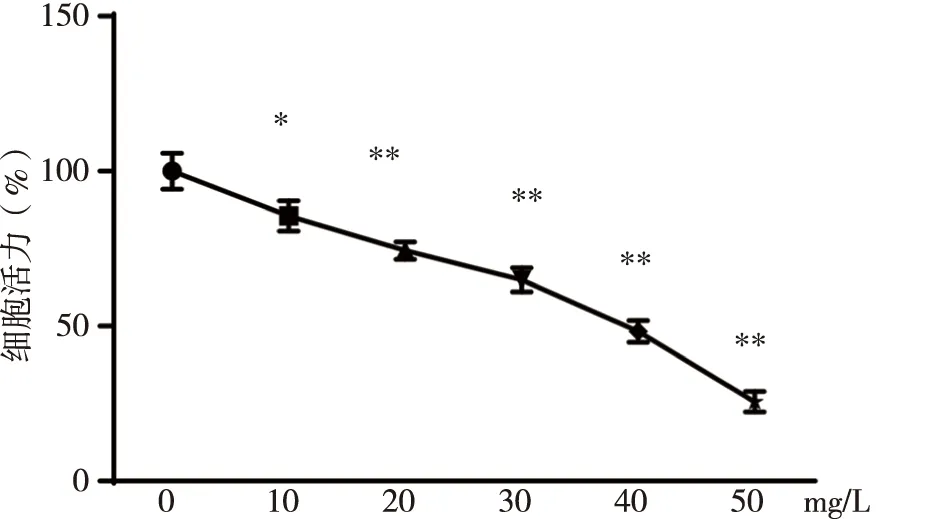
*、**:与对照组比较, P<0.05, P<0.01。图1 OXA对HSC-3细胞的增殖的抑制作用
3.2 OXA促进HSC-3细胞的凋亡 不同浓度(0、20、40、80 mg/L)的OXA处理HSC-3细胞后,采用DAPI法检测细胞核的凋亡情况、Annexin V-FITC/PI流式细胞术检测细胞的总凋亡率。本研究DAPI染色结果显示,对照组细胞核呈现圆形或椭圆形,核完整,染色质较为均匀,呈淡蓝色;经OXA处理后部分细胞核开始固缩,产生部分蓝色荧光及凋亡小体(红色圆圈所示),呈现较为典型的细胞凋亡的核形态特征,且随着OXA剂量的增加,细胞核凋亡情况进一步加剧(见图2)。流式细胞术结果显示,20、40、80 mg/L OXA组细胞总凋亡率分别为(4.5±0.4、12.9±0.7、20.3±0.6)%,均显著高于对照组(1.2±0.2)%,(P<0.01,见图3)。以上结果表明,OXA促进了HSC-3细胞凋亡的发生。
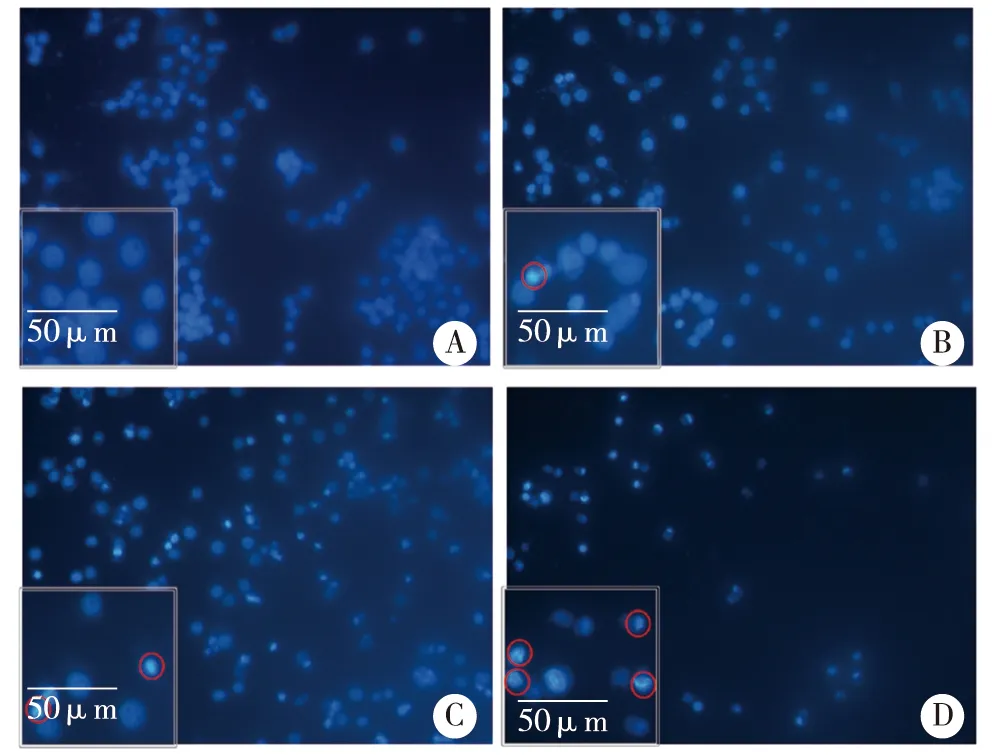
A:对照组;B~D:分别为奥沙利铂20、40、80mg/L组;×200。图2 DAPI染色观察HSC-3细胞核凋亡情况
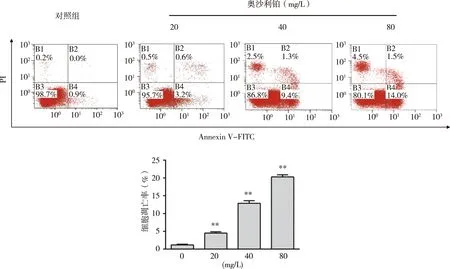
B1:坏死细胞百分率;B2:晚期凋亡细胞百分率;B3:活细胞百分率;B4:早期凋亡细胞百分率;**:与对照组比较, P<0.01。图3 流式细胞术检测HSC-3细胞的凋亡率
3.3 OXA激活HSC-3细胞中ERS及其PERK-eIF2α-ATF4信号通路 q-RT-PCR结果显示,与对照组相比,各组OXA处理HSC-3细胞24 h后,mRNA水平上GRP78、PERK、eIF2α、ATF4、CHOP、Caspase3 表达均呈上调趋势,剂量依赖,且高剂量组均显著上调(见图4)。Western blot结果显示,与对照组相比,各组OXA处理HSC-3细胞24 h后,GRP78、p-PERK/PERK、ATF4、CHOP、Cleaved-caspase 3/Pro-caspase 3蛋白表达水平均呈上调趋势,尤其是高剂量组均显著上调,eIF2α蛋白中剂量组显著上调,而高剂量组显著下调(见图5)。以上结果表明,OXA激活了HSC-3细胞中ERS的水平,同时激活了ERS途径中PERK-eIF2α-ATF4信号通路,尤其是标志性分子CHOP的上调,进一步促进Caspase 3的剪切激活,最终诱导了细胞凋亡的发生。
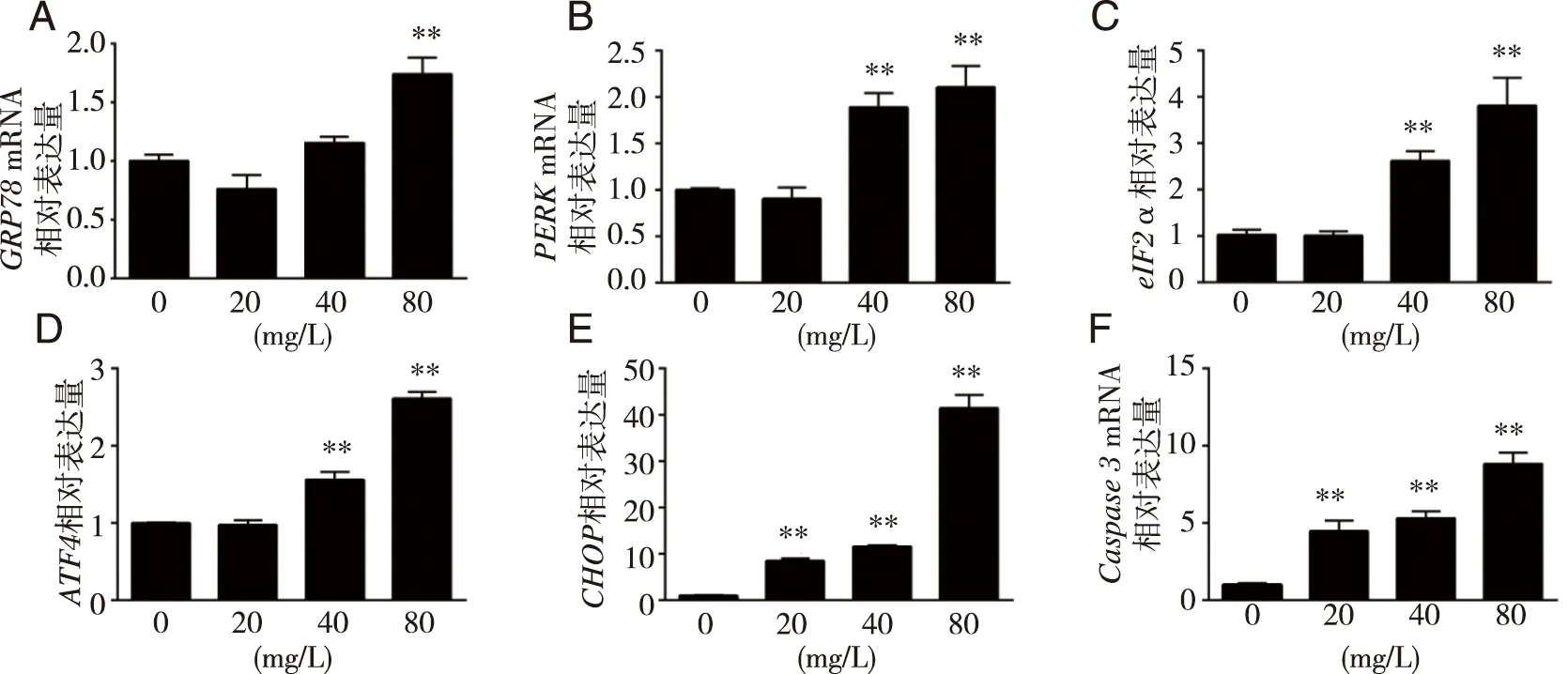
**:与对照组比较, P<0.01。图4 OXA对细胞GRP78、PERK、eIF2α、ATF4、CHOP、Caspase 3 转录水平的影响
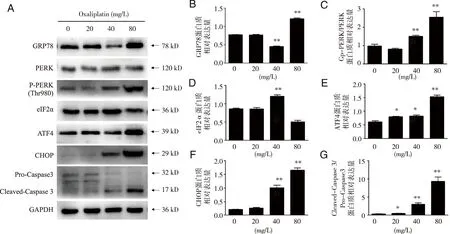
*、**:分别与对照组比较, P<0.05、 P<0.01。图5 OXA对细胞GRP78、PERK、p-PERK、eIF2α、ATF4、CHOP、Pro-Caspase3、Cleaved-Caspase 3蛋白水平的影响
4 讨论
肿瘤进程与细胞凋亡有关,细胞凋亡的抑制会阻碍肿瘤发生发展,因此研究细胞凋亡相关通路及蛋白成为寻找肿瘤治疗靶点的主要途径之一。而内质网作为真核细胞中具有分泌、合成、折叠和修饰蛋白功能的细胞器,在多种因素刺激下会产生和聚集大量错误折叠甚至未折叠的蛋白质,从而引发内质网应激。对于肿瘤细胞而言,缺糖、酸中毒及严重缺氧将伴发ERS的产生[18],此时肿瘤细胞会激发未折叠蛋白反应,避免自身凋亡[19];然而当发生持续性、长久性的ERS时,肿瘤细胞亦会发生凋亡。因此ERS感受器及其下游信号通路的异常激活已成为肿瘤生长、转移以及对化疗、靶向治疗和免疫治疗反应的关键调节因子[20]。
大量研究表明,内质网应激在肿瘤发生发展的病理生理学机制中占有重要地位,也是口腔肿瘤治疗的靶点之一[21-23]。在临床OSCC病理组织中内质网应激相关分子GRP78在蛋白水平上的表达量与临床病理和预后存在一定的相关性,可作为潜在的标记物用以判断其恶性程度以及预测其预后[24]。本研究结果显示,OXA对HSC-3细胞的生长增殖具有抑制作用,且呈一定的剂量依赖性,并促进GRP78的表达升高,与OSCC临床病理研究结果基本一致,说明此时发生ERS。如前所述,肿瘤细胞会通过未折叠蛋白反应避免细胞凋亡。ERS诱导下产生的未折叠蛋白反应主要有以下3种信号转导通路:肌醇激酶1-X盒结合蛋白1、PERK-eIF2α-ATF4和活性转录因子6通路[25]。而其中,PERK-eIF2α-ATF4通路也是ERS诱导细胞凋亡的主要信号通路之一[26]。因此,该通路也可能成为调控肿瘤细胞凋亡的重要途径之一。PERK是内质网I型跨膜蛋白,属于真核细胞起始因子2蛋白激酶家族。在非ERS时,PERK能够与GRP78形成复合物;当发生ERS时,GRP78与PERK发生解离,PERK自身磷酸化以活化。PERK活化后可以诱导ATF4的转录,活化的ATF4可诱导ERS下游标志性分子CHOP的产生,进一步激活Caspase家族级联反应,最终激活半胱天冬酶3(Caspase 3)从而促进细胞凋亡的发生[27]。本研究结果进一步表明,在OXA作用下能够诱导口腔鳞癌细胞的凋亡,其分子机制与ERS通路PERK-eIF2α-ATF4有关,表现在PERK、eIF2α、ATF4等关键分子表达上调,同时促进了其PERK的磷酸化水平、CHOP的表达和Caspase 3发生剪切激活。
综上所述,OXA能够抑制口腔鳞癌HSC-3细胞的生长增殖,同时促进其细胞凋亡过程,其分子机制可能主要是通过上调其GRP78的表达,激活ERS中PERK-eIF2α-ATF4通路,促进ERS下游分子CHOP的表达,进一步激活Caspase家族级联反应,最终诱导Caspase-3发生剪切激活,从而促进细胞凋亡的发生。
——疾病防治的新靶标

