不同脱苦处理对骨胶原蛋白肽品质及抗氧化特性的影响
赵 欣,成晓瑜,张顺亮,王 乐,岳宜静,刘博文,王 辉
(中国肉类食品综合研究中心,北京食品科学研究院,肉类加工技术北京市重点实验室,北京 100068)
骨胶原蛋白肽是指胶原蛋白经酶解、分离纯化等手段制备的产物,相对于胶原蛋白更易于被人体吸收,具有抗氧化、延缓皮肤老化、预防动脉粥样硬化、促进骨细胞生长等一系列生理活性[1-2],在食品、医疗等方面具有广阔的应用前景。可用作增稠剂、乳化剂、稳定剂、澄清剂等食品添加剂;降血压、补钙和促进肠道吸收等保健品;控制肥胖、促进伤口愈合、治疗骨质疏松等医疗用品[3]。此外,胶原蛋白是动物骨中的主要蛋白,骨胶原蛋白肽的生产可提高畜禽屠宰副产物的利用价值,减少环境污染,产生更高的社会效益和经济效益。
骨胶原蛋白肽的提取方法通常包括酸法提取、碱法提取、中性盐提取及酶法提取,其中酶法提取应用较为广泛[4]。胶原蛋白肽的功能特性与酶的类型和水解条件有关。邵燕秋等[5]优化鳗鱼骨胶原蛋白血管紧张素转化酶抑制肽的制备方法,其中碱性蛋白酶为最适水解酶,且在温度50 ℃、质量浓度15 g/L、酶解时间5.25 h、加酶量3.1%、pH 9.2条件下得到的水解产物有较好的抑制率;毛嘉敏等[6]研究表明,驴骨蛋白经木瓜蛋白酶酶解,可制备有螯合亚铁离子能力的驴骨胶原肽,具有促进铁吸收的潜力;郑平安等[7]通过对胰酶、中性蛋白酶、复合蛋白酶等6 种常见工业酶进行对比,发现胰酶对鲟鱼软骨的酶解效果最好,适用于鲟鱼软骨Ⅱ型胶原蛋白的提取。然而,研究表明,骨胶原蛋白肽在酶解提取过程中会导致疏水氨基酸的暴露和一些苦味肽的产生,造成产品具有消费者所不能接受的苦味,从而对骨胶原蛋白肽的口感产生不利影响[8]。苦味成为限制骨胶原蛋白肽在食品及医疗行业中使用的一个主要因素,脱苦技术的研发对骨胶原蛋白肽的生产及应用具有重要的意义。目前多使用掩盖法和酶法对肽进行脱苦。β-环糊精由于具有特殊的内部疏水结构,是一种良好的苦味掩盖剂,可通过捕获疏水肽而降低苦味,在药物和食品中得到广泛应用[9]。乳铁蛋白因具有疏水性区域,可被用作苦味分子的纳米载体,可作为肽的苦味掩盖剂[10]。外肽酶在肽的酶法脱苦中具有良好的应用,依据其作用位点的不同分为氨基肽酶和羧基肽酶两大类,二者分别从肽基质的N末端和C末端进行催化水解。而肽链C末端疏水性对苦味的影响更大,研究表明,酶解处理,特别是具有外肽酶活性的风味蛋白酶可以降低苦味,并被用作脱苦剂,因为它能够去除C末端疏水氨基酸[11],并产生独特的风味[12]。
因此,本研究比较分析不同的脱苦技术(不同比例β-环糊精、乳铁蛋白和风味蛋白酶)对骨胶原蛋白肽苦味强度及脱苦效率的影响,结合疏水性、游离氨基酸含量、傅里叶变换红外光谱对其脱苦原理进行分析。此外,还阐明了所得脱苦产物的产品特性和抗氧化活性,为开发低苦度骨胶原蛋白肽产品提供技术支持和理论依据。
1 材料与方法
1.1 材料与试剂
骨胶原蛋白肽(通过酶法制备,分子质量在2 000 Da以下) 包头东宝生物技术股份有限公司;β-环糊精(食品级) 河南万邦化工科技有限公司;乳铁蛋白(食品级) 河南深蓝食品配料有限公司;风味蛋白酶诺维信(中国)生物制药有限公司。
盐酸、5-磺基水杨酸、溴酚蓝、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH) 国药集团化学试剂有限公司;总抗氧化能力(total antioxidant capacity,T-AOC)检测试剂盒(铁离子还原抗氧化能力(ferric ion reducing antioxidant power,FRAP)法)北京索莱宝科技有限公司。
1.2 仪器与设备
AM-3高速匀浆机 日本Nihonseiki Kaisha公司;CR-400色差计 柯尼卡美能达投资有限公司;Synergv H4酶标仪 美国伯腾仪器有限公司;TS5000Z味觉分析系统 日本Insent公司;L-8900高速全自动氨基酸分析仪 日本日立公司;Nicolet iSl0 FTIR傅里叶变换红外光谱仪 美国Thermo Scientific公司。
1.3 方法
1.3.1 骨胶原蛋白肽的酶解脱苦
将骨胶原蛋白肽配制为100 g/L的溶液,在溶液中分别加入不同比例的风味蛋白酶(500 LAPU/g、pH 7.0、50 ℃),使风味蛋白酶在骨胶原蛋白肽溶液中的最终质量浓度分别为0.5、1.0、1.5、2.0、2.5 g/100 mL,水解1 h,沸水浴10 min灭酶,8 000 r/min离心15 min,取上清液,于-80 ℃预冻4 h,在真空度15 Pa条件下,样品温度由-40 ℃升温至30 ℃,冷阱温度保持在-45 ℃的条件下真空冷冻干燥36 h。
1.3.2 骨胶原蛋白肽的β-环糊精、乳铁蛋白方法脱苦
将骨胶原蛋白肽样品与蒸馏水以1∶4(m/V)的比例混合,然后在38 ℃下孵育30 min,并在摇床上持续振荡。然后,将β-环糊精及乳铁蛋白分别以不同比例添加到溶液中,使β-环糊精、乳铁蛋白在骨胶原蛋白肽溶液中的最终质量浓度分别为1、2、3、4、5 g/100 mL。在38 ℃下连续振荡孵育30 min,8 000 r/min离心15 min,取上清液,于-80 ℃预冻4 h,在真空度15 Pa条件下,样品温度由-40 ℃升温至30 ℃,冷阱温度保持在-45 ℃的条件下真空冷冻干燥36 h。
1.3.3 感官分析
苦味值的测定采用感官分析法进行,参照Gao Yi等[13]的方法,并适当调整。筛选12 名22~35 岁的感官评价成员组成小组,进行苦味值评价。制备不同质量浓度的苦味溶液作为苦味标准品,分别将纯水及20、40、60、80、100 mg/L奎宁标准品溶液的苦味强度定为0、2、4、6、8、10。训练评价成员对标准品进行打分以使得评价成员经培训后均能分辨出不同苦味强度的样品,且评价标准相对一致。每个样品重复评价3 次,样品评价的时间选取3 d内的相同时间段。
1.3.4 电子舌分析
通过电子舌系统进行测量。将骨胶原蛋白肽样品与蒸馏水以1∶6(m/V)的比例混合,然后在38 ℃下孵育30 min,并在摇床上持续振荡,使骨胶原蛋白肽充分溶解。待样品恢复至室温,进行电子舌测试,每个样品数据重复采集4 次,采集时间为120 s,取3 次误差最小值为每个样本的测量数据。
1.3.5 色泽测定
样品的亮度值(L*)、红度值(a*)、黄度值(b*)和总色差(ΔE)根据Singh等[14]的方法进行测定。
1.3.6 表面疏水性测定
参考王宏伟等[15]的方法测定并稍做修改,将样品质量浓度调整至2.5 mg/mL,通过溴酚蓝的结合量表示表面疏水性。向1 mL骨胶原蛋白肽中加入200 μL l mg/mL溴酚蓝溶液并充分混合,对照组为向1 mL蒸馏水中加入200 μL l mg/mL溴酚蓝溶液,样品在室温下搅拌10 min,4 000 r/min离心10 min,将上清液稀释10 倍,在595 nm波长处测定吸光度,溴酚蓝结合量按式(1)计算。
1.3.7 游离氨基酸含量测定
参照Liu Chunsheng等[16]的方法进行。准确称量1 g样品,加入15 mL 0.02 mol/L稀盐酸,充分均质后用超声波清洗5 min,然后用冷冻离心机(5 000 r/min、4 ℃)离心10 min,取上清液,用0.02 mol/L稀盐酸定容至50 mL。定容后转移2 mL,加入2 mL体积分数5%磺基水杨酸溶液,经0.22 μm水相滤膜过滤,氨基酸分析仪上机测定,进样量为20 μL,样品经阳离子交换柱分离,于115~120 ℃进行显色反应,生成的紫色物质在570 nm波长处进行比色测定,生成的黄色化合物在440 nm波长处进行比色测定。进行3 组平行实验,测定结果取平均值。
1.3.8 傅里叶变换红外光谱分析
参照赵冰等[17]的方法,并稍作修改。用傅里叶变换红外光谱仪对4 000~400 cm-1区域的所有光谱进行扫描分析。
1.3.9 抗氧化活性测定
使用T-AOC检测试剂盒对骨胶原蛋白肽的抗氧化活性进行测定。
DPPH自由基清除率测定:参照郑辉等[18]的方法并适当调整。取1 mL 2.5 mg/mL样品溶液与1 mL 0.01 mg/mL DPPH无水乙醇溶液,混匀,避光静置30 min后,5 000 r/min离心10 min,取上清液测定其在517 nm波长处的吸光度。DPPH自由基清除率按式(2)计算。
式中:Ai为1 mL 2.5 mg/mL样品溶液+1 mL空白试剂(无水乙醇)的吸光度;Aj为1 mL 2.5 mg/mL样品溶液与1 mL 0.01 mg/mL DPPH无水乙醇溶液的吸光度;A0为1 mL 0.01 mg/mL DPPH溶液+空白试剂(无水乙醇)的吸光度。
2,2’-联氮-双-(3-乙基苯并噻唑啉-6-磺酸)(2,2’-azinobis-(3-ethylbenzothiazoline-6-sulfonic acid),ABTS)阳离子自由基清除率测定:7 mmol/L ABTS溶液和2.45 mmol/L过硫酸钾溶液(体积比1∶1)充分混匀后室温下反应12 h,形成ABTS阳离子储备液,于4 ℃条件下贮存备用。使用前用无水乙醇对ABTS阳离子储备液进行适当稀释,调整其在734 nm波长处的吸光度为0.70f0.02,得到ABTS阳离子工作液。取0.2 mL 2.5 mg/mL样品与1.9 mL ABTS阳离子工作液混匀,室温反应60 min后,在734 nm波长处测定吸光度[19],其中,以蒸馏水代替ABTS阳离子工作液体系作为样品对照,蒸馏水代替样品溶液作为空白。ABTS阳离子自由基清除率按式(3)计算。
式中:A0为蒸馏水代替ABTS阳离子工作体系的吸光度;A1为蒸馏水代替样品溶液体系的吸光度;A2为样品溶液与ABTS阳离子工作液混合体系的吸光度。
1.4 数据处理
采用SPSS 19软件对数据进行差异显著性分析(P<0.05),Origin 2021软件作图。
2 结果与分析
2.1 不同脱苦处理对骨胶原蛋白肽感官的影响
由表1可知,与所有处理过的样品相比,对照组的苦味得分最高(P<0.05)。这可能是由于骨胶原蛋白肽在制备过程中,蛋白的疏水结构暴露,导致苦味增加[19]。苦味主要与位于肽的C末端和N末端的疏水性氨基酸有关,且疏水性氨基酸位于C末端时肽的苦味强于位于N末端[20]。当用β-环糊精处理骨胶原蛋白肽时,随着β-环糊精添加量的增加,苦味评分降低。苦味的减少可能与β-环糊精的特殊结构有关,疏水性内部空腔结构可以吸引疏水氨基酸,减少它们与味觉受体的接触,从而降低苦味[9]。此外,β-环糊精自身带有的甜味可能也会对苦味起到一定抑制作用。然而,本研究的结果显示,含有4、5 g/100 mLβ-环糊精的样品的苦味评分没有显著差异。这可能是因为4 g/100 mL的β-环糊精分子数量足以捕获苦味分子,添加更多量的苦味抑制剂不会产生更强的脱苦作用。随着乳铁蛋白的增加,骨胶原蛋白肽苦味评分降低,这可能与乳铁蛋白的疏水作用有关[10]。骨胶原蛋白肽经风味蛋白酶水解后苦味评分降低。然而,当酶剂量增加到1.5 g/100 mL时,苦味评分不再降低。这可能是由于风味蛋白酶的活性和切割位点有限,部分疏水性氨基酸仍然位于多肽的末端或以游离肽的形式出现。总的来说,添加不同量的β-环糊精、乳铁蛋白及风味蛋白酶均可有效降低骨胶原蛋白肽的苦味,添加4 g/100 mLβ-环糊精、5 g/100 mL乳铁蛋白及1.5 g/100 mL风味蛋白酶对骨胶原蛋白肽苦味降解有更好的效果,其中苦味评分排序为1.5 g/100 mL风味蛋白酶<4 g/100 mLβ-环糊精<5 g/100 mL乳铁蛋白,且添加4 g/100 mLβ-环糊精与5 g/100 mL乳铁蛋白苦味评分之间无显著差异。

表1 骨胶原蛋白肽的苦味评分Table 1 Bitterness score of bone collagen peptide
2.2 不同脱苦处理对骨胶原蛋白肽电子舌测定结果的影响
根据2.1节感官评分结果,选择添加4 g/100 mLβ-环糊精、5 g/100 mL乳铁蛋白及1.5 g/100 mL风味蛋白酶处理的骨胶原蛋白肽进行进一步研究。电子舌可以进行更客观、准确的分值评估,从而避免感官评分存在的一些不稳定性。
由图1可知,电子舌的苦味测定结果与苦味感官评分趋势一致,经过不同的脱苦处理后骨胶原蛋白肽的苦味值均显著下降(P<0.05)。添加1.5 g/100 mL的风味蛋白酶苦味值最低,这可能是由于风味蛋白酶的外切作用可释放多肽链末端的疏水氨基酸,从而降低苦味,但与此同时会增加其涩味和苦味回味强度。风味蛋白酶降解后其鲜味、咸味及鲜味回味显著提升。研究表明,酶水解过程中会产生一些咸味及鲜味成分[21-23]。

图1 不同脱苦处理条件下骨胶原蛋白肽的电子舌得分Fig. 1 Electronic tongue scores for taste intensity of bone collagen peptide under different debittering conditions
2.3 不同脱苦处理对骨胶原蛋白肽色泽的影响
由表2可知,添加4 g/100 mLβ-环糊精后骨胶原蛋白肽在L*、a*和b*方面无显著变化,说明β-环糊精对骨胶原蛋白肽色泽影响较小。经乳铁蛋白处理的骨胶原蛋白肽L*、a*显著高于其他组(P<0.05),且ΔE最高,表明乳铁蛋白脱苦处理后的样品和对照组(骨胶原蛋白肽)之间的颜色差异较大,这可能与乳铁蛋白自身的色泽有关,乳铁蛋白呈粉红色,可显著改善骨胶原蛋白肽的色泽。而添加1.5 g/100 mL风味蛋白酶后L*显著下降,b*显著上升。

表2 不同脱苦处理对骨胶原蛋白肽色度的影响Table 2 Effects of different debittering treatments on color parameters of bone collagen peptide
2.4 不同脱苦处理对骨胶原蛋白肽表面疏水性的影响
骨胶原蛋白肽在生产过程中会经历蛋白的水解或降解,通常会导致隐藏的疏水氨基酸暴露,并伴有苦味[24-25]。表面疏水性是肽呈苦味的主要原因之一[26]。由图2可知,未经脱苦处理的骨胶原蛋白肽具有最高的表面疏水性,这可能是由于骨胶原蛋白肽结构中存在大量的疏水结构,暴露在表面的疏水基团较多,因此具有苦味[27]。骨胶原蛋白肽在经4 g/100 mLβ-环糊精、5 g/100 mL乳铁蛋白处理后显示出较低的表面疏水性(P<0.05),这可能与β-环糊精及乳铁蛋白的特殊结构有关,通过疏水相互作用,导致表面疏水性显著降低[28]。这与2.2节4 g/100 mLβ-环糊精及5 g/100 mL乳铁蛋白处理的样品苦味强度降低程度相一致。同样,经1.5 g/100 mL风味蛋白酶处理的骨胶原蛋白肽的表面疏水性也显著降低(P<0.05),这可能是由于一些疏水残基被风味蛋白酶切割。因此,本研究表明,3 种方式均能显著降低骨胶原蛋白肽的表面疏水性,从而降低苦味强度。
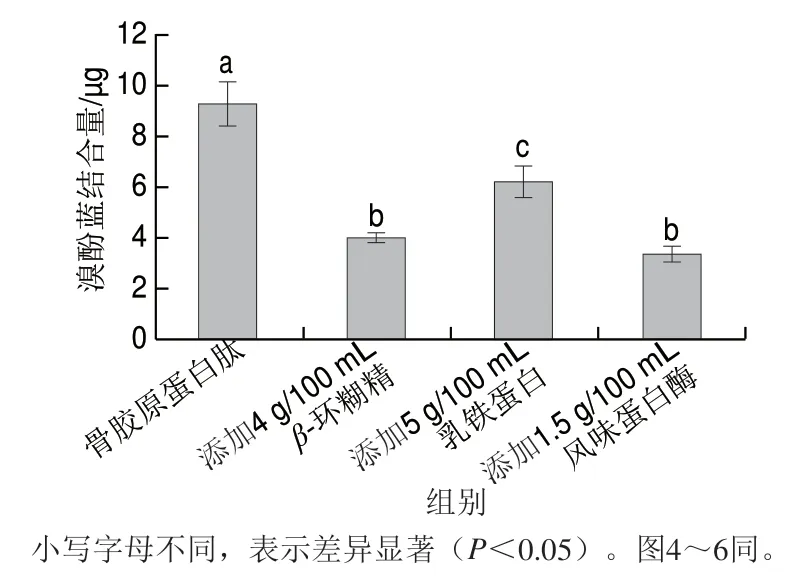
图2 不同脱苦处理对骨胶原蛋白肽表面疏水性的影响Fig. 2 Effect of different debittering treatments on hydrophobicity of bone collagen peptide
2.5 不同脱苦处理对骨胶原蛋白肽游离氨基酸含量的影响
由表3可知,骨胶原蛋白肽中含量较高的氨基酸包括丙苯氨酸(339.04 mg/100 g)、天冬氨酸(42.65 mg/100 g)、半胱氨酸(37.43 mg/100 g)和精氨酸(34.73 mg/100 g),且疏水性氨基酸含量较高,占总游离氨基酸的75.81%。骨胶原蛋白肽经4 g/100 mLβ-环糊精及5 g/100 mL乳铁蛋白处理后疏水性氨基酸含量显著降低(P<0.05),疏水性氨基酸占比分别为66.85%和68.11%,说明4 g/100 mLβ-环糊精及5 g/100 mL乳铁蛋白脱苦处理会导致疏水性氨基酸减少。β-环糊精对疏水性氨基酸具有亲和性,可通过形成包合物降低苦味[29]。而骨胶原蛋白肽经1.5 g/100 mL风味蛋白酶水解后总游离氨基酸和疏水性游离氨基酸含量均有所增加,但是疏水性游离氨基酸所占比例下降,总游离氨基酸含量显著升高至4 224.32 mg/100 g(P<0.05),其中疏水性氨基酸含量达到3 084.98 mg/100 g,这说明酶解过程中降解产生了更多的游离氨基酸。在风味蛋白酶水解过程中,可能位于C端的大量疏水性氨基酸被释放出来,呈游离状态,C端苦味氨基酸的脱除有利于减少苦味肽的平均疏水性,降低苦味肽的苦味[30]。此外,经4 g/100 mLβ-环糊精、5 g/100 mL乳铁蛋白、1.5 g/100 mL风味蛋白酶处理后鲜味氨基酸(天冬氨酸+甘氨酸)含量分别提高23.45%、30.48%和56.49%。研究表明,水解可导致扇贝肽中鲜味氨基酸(天冬氨酸和甘氨酸)增加[31]。β-环糊精能够改善小麦面筋蛋白酶解后的鲜味[32]。

表3 不同脱苦处理对骨胶原蛋白肽游离氨基酸含量的影响Table 3 Effects of different debittering treatments on free amino acid contents of bone collagen peptide mg/100 g
2.6 不同脱苦处理对骨胶原蛋白肽傅里叶变换红外光谱的影响
由图3可知,酰胺A和酰胺B分别在3 417~3 428、2 961~2 963 cm-1范围内。酰胺A代表与氢键结合的NH拉伸,酰胺B代表—CH—拉伸(不对称和对称拉伸)和—NH+3[33]。在3 426.9 cm-1处观察到的经β-环糊精和风味蛋白酶处理的骨胶原蛋白肽的酰胺A在进行脱苦后转移到更低的波数(3 425.0、3 417.2 cm-1),而经乳铁蛋白处理的骨胶原蛋白肽在进行脱苦时转移到更高的波数(3 428.3 cm-1)。这可能由于不同脱苦处理导致肽链上NH基团的氢键增加或减少[34]。经脱苦处理后骨胶原蛋白肽的酰胺B带(2 961.2 cm-1)向较高的波数(2 963.1 cm-1)移动,表明不同苦味抑制剂和NH3基团之间的相互作用[35]。多肽骨架CüO伸缩振动范围为1 600~1 700 cm-1,1 648.6~1 651.3 cm-1的吸收峰证实了NüH伸缩和CüO之间形成氢键。骨胶原蛋白肽在1 548.1、1 541.5 cm-1处的酰胺Ⅱ带,以及在1 243.9~1 248.2 cm-1的酰胺Ⅲ带,分别代表NüH弯曲振动、CüN拉伸振动和CüH拉伸。对照组及添加β-环糊精、乳铁蛋白的骨胶原蛋白肽显示出较低强度的酰胺Ⅰ和Ⅱ带,并且酰胺Ⅲ带几乎不存在。这些变化表明骨胶原蛋白肽存在较大的结构紊乱[36],可能与三螺旋状态的丧失有关。然而,经风味蛋白酶水解后的骨胶原蛋白肽显示出明显的酰胺Ⅰ、Ⅱ、Ⅲ带。因此,酶解后骨胶原蛋白肽的结构发生变化。表明不同脱苦处理可以通过改变骨胶原蛋白肽的构象来降低其苦味程度。

图3 不同脱苦处理条件下骨胶原蛋白肽的傅里叶变换红外光谱Fig. 3 Fourier infrared spectra of bone collagen peptide of bone under different debittering treatments
2.7 不同脱苦处理对骨胶原蛋白肽抗氧化活性的影响
DPPH自由基清除率是用来表示化合物自由基清除能力或作为H供体的一项抗氧化指标[12,14]。由图4可知,经4 g/100 mLβ-环糊精及5 g/100 mL乳铁蛋白处理后骨胶原蛋白肽的DPPH自由基清除活性显著降低(P<0.05),这可能与β-环糊精脱苦过程中疏水肽或疏水结构域的损失有关(P<0.05)。而经1.5 g/100 mL风味蛋白酶水解后骨胶原蛋白肽的DPPH自由基清除能力显著上升(P<0.05),这可能是由于骨胶原蛋白肽经风味蛋白酶进一步水解后产生更多的小分子肽,作为电子供体与自由基反应,将其转化为不容易氧化的产物,进而停止自由基的链式反应[15]。
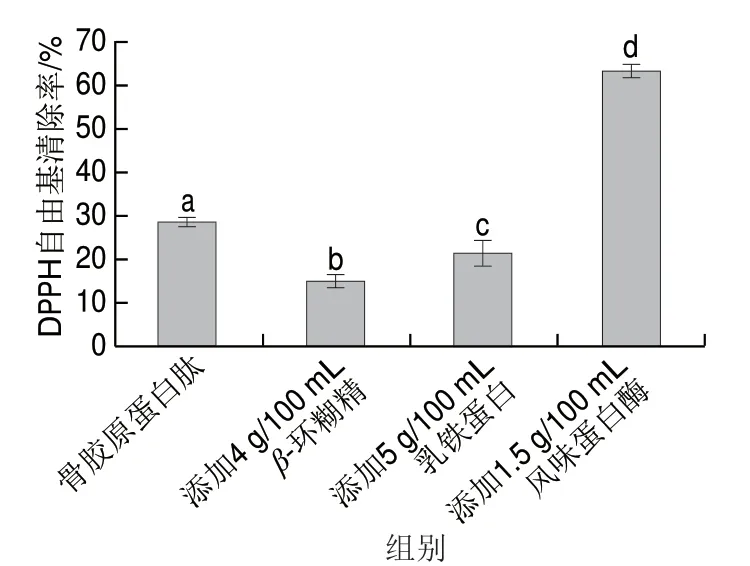
图4 不同脱苦处理条件下骨胶原蛋白肽的DPPH自由基清除能力Fig. 4 DPPH radical scavenging capacity of bone collagen peptide under different debittering treatments
此外,通过风味蛋白酶水解释放的一系列疏水性氨基酸也会提高多肽的抗氧化能力。T-AOC采用FRAP法测定,用来表示化合物通过向自由基提供电子将Fe3+-三吡啶三吖嗪合物还原为Fe2+-三吡啶三吖嗪复合物的能力[37]。由图5可知,未经脱苦处理的骨胶原蛋白肽样品比经β-环糊精及乳铁蛋白处理的样品具有更高的T-AOC(P<0.05),这可能与不同脱苦处理后骨胶原蛋白肽的结构有关。研究表明,含有更高疏水性肽或芳香族氨基酸的水解物通常具有较高的还原活性[38]。此外,经1.5 g/100 mL风味蛋白酶水解的骨胶原蛋白肽具有最高的还原活性,说明经风味蛋白酶水解的骨胶原蛋白肽更容易形成良好的抗氧化物质[39]。

图5 不同脱苦处理条件下骨胶原蛋白肽的T-AOCFig. 5 T-AOC of bone collagen peptide under different debittering treatments
ABTS实验用于确定抗氧化剂对抗脂质过氧自由基和亲水性自由基的能力[37]。由图6可知,未经脱苦处理的骨胶原蛋白肽比经4 g/100 mLβ-环糊精及5 g/100 mL乳铁蛋白处理后的胶原蛋白肽具有更高的ABTS阳离子自由基清除活性(P<0.05),这可能与其较高的疏水肽含量有关。而经1.5 g/100 mL风味蛋白酶水解的骨胶原蛋白肽ABTS阳离子自由基清除活性最高,为78.34%。综上所述,使用β-环糊精和乳铁蛋白处理可降低苦味强度,但会导致骨胶原蛋白肽抗氧化性的降低,而经风味蛋白酶水解可以改善其抗氧化性能。

图6 不同脱苦处理条件下骨胶原蛋白肽的ABTS阳离子自由基清除能力Fig. 6 ABTS radical cation scavenging capacity of bone collagen peptide under different debittering treatments
3 结 论
本实验研究不同脱苦处理对骨胶原蛋白肽的品质及抗氧化特性的影响,结果表明:不同脱苦处理均能有效地降低骨胶原蛋白肽的苦味强度和表面疏水性,其中经1.5 g/100 mL风味蛋白酶水解的骨胶原蛋白肽苦味评分最低,为3.34;苦味掩盖剂(4 g/100 mLβ-环糊精、5 g/100 mL乳铁蛋白)处理可显著降低骨胶原蛋白肽的疏水性游离氨基酸含量(P<0.05),而酶解法(1.5 g/100 mL风味蛋白酶)可降低疏水性氨基酸占比;不同脱苦处理可通过影响氨基酸官能团引起肽的结构变化,从而达到脱苦效果;相对苦味掩盖剂(4 g/100 mLβ-环糊精、5 g/100 mL乳铁蛋白)而言,经1.5 g/100 mL风味蛋白酶水解的骨胶原蛋白肽具有更高的抗氧化活性。综合比较,1.5 g/100 mL风味蛋白酶的脱苦效果及抗氧化活性最佳,在胶原蛋白肽的脱苦及抗氧化性能提升方面有较大的应用价值。

