陈皮对土壤中六价铬的去除效果及机理
刘增俊,许贺峰,郭彦旭,樊艳玲*
1. 北京市生态环境保护科学研究院,北京 100037
2. 四川中烟工业有限责任公司,四川 成都 610101
铬(Cr)是重要的工业金属,常用于金属冶炼、皮革鞣制、电镀、木材防腐等行业. 这些工业活动产生的含铬渣、废水和废气,可能会由于泄漏、储存或处置不当而污染土壤和地下水[1]. 土壤中的铬主要以三价(Ⅲ)和六价(Ⅵ)两种形态存在,且极易通过氧化还原反应而相互转化[2]. Cr(Ⅲ)一般以氧化物和氢氧化物的形式存在于土壤中,其毒性和生物可利用度较低,Cr(Ⅵ)主要以阴离子CrO42-和Cr2O72-的形式存在,不易被表面带负电的土壤颗粒吸附,相应地在土壤中的迁移能力更强[3]. 由于Cr(Ⅵ)的强氧化能力和生物膜穿透特性,其可以通过阴离子交换通道自由穿透细胞膜,具有毒性、致癌、致突变和致畸性. 研究[4]表明,人体长期暴露在Cr(Ⅵ)浓度高于4.33 mg/kg的环境中时,会对肠道、肾脏产生不良影响,严重时甚至会危及生命.
现阶段Cr(Ⅵ)污染土壤修复主要通过化学还原,常用的修复药剂包括铁及其化合物、硫化物和有机改良剂[5-6]. 铁系物和硫化物具有价格低廉、修复高效的优点,但在修复过程中产生的H+和H2S易对土壤和大气造成二次污染[7]. 有机改良剂(包括有机肥、生物炭等)虽然环境友好,但获取途径受限且修复效果较低[5]. 因此,寻找价廉、量大、易获取且环境友好的高效修复药剂成为Cr(Ⅵ)污染土壤修复的重要工作之一.
我国柑橘产量和消费量均位居世界前列. 2010-2019年,我国柑橘产量从2 581.7×104t增至4 584.5×104t,增幅高达77.58%[8]. 但无论是直接食用还是生产加工,都会产生40%~50%的果皮废弃物,这些果皮往往没有得到合理化利用而被填埋处置[9]. 陈皮是柑橘干燥后的果皮,其中含有丰富的纤维素和黄酮类化合物.这些物质的分子结构中含有大量的羟基、羧基等能团,对重金属有吸附络合作用[10]. 赵华等[11]和张玮等[12]分别使用干燥后的陈皮去除溶液中的Cr(Ⅵ)和Pb(Ⅱ),发现陈皮对两种重金属的吸附量分别为56.04%和54.40%. 此外,陈皮中富含的纤维素[13]和黄酮醇苷类物质[14]的水解产物可能充当电子供体,将Cr(Ⅵ)还原为Cr(Ⅲ). 然而,陈皮对污染土壤中Cr(Ⅵ)去除效果及机理研究还不清楚.
鉴于此,该研究以采自河南省某铬污染场地的土壤为研究对象,通过室内模拟试验,系统探讨了陈皮修复Cr(Ⅵ)污染土壤过程的影响因素、去除效果及作用途径,以期为Cr(Ⅵ)污染土壤的修复提供理论支撑.
1 材料与方法
1.1 试验材料
1.1.1化学试剂和器材
重铬酸钾(K2Cr2O7,分析纯)购自山东西亚化学工业有限公司. 所有试验塑料和玻璃容器在使用前均经过去离子水润洗.
1.1.2供试土壤
Cr(Ⅵ)污染土壤(HCR)采自河南省某铬污染场地(34.7°N、111.9°E),未污染的土壤(HN)采自河南省某农田(35.1°N、113.8°E). 两部分土壤均取自表层(0~20 cm),由不锈钢螺旋钻收集,并装入聚乙烯塑料密封中,运送至实验室. 在室温下自然风干后,剔除土壤中较大的石块砂砾和植物根系,研磨后过2 mm尼龙筛,备用.
将采集到的未污染土壤样品均匀分为3份,每1 kg土壤中分别加入60、100和300 mL K2Cr2O7溶液〔其中Cr(Ⅵ)浓度为10 000 mg/L〕,使土壤中Cr(Ⅵ)的初始浓度分别达到600、1 000和3 000 mg/kg,依次记为HN-Low、HN-Mid和HN-High. 向土壤中加入去离子水,使土壤含水量达到35%±5%,于室温条件下老化60 d,备用.
土壤理化性质见表1.

表1 供试土壤理化性质Table 1 Physiochemical properties of the test soils
1.1.3陈皮
市场采购完全成熟的柑橘,自来水冲洗并用刷子刷去表面蜡质,剥皮后用去离子水将橘子皮清洗3~5遍. 将干净的橘皮放入干燥箱中105 ℃下杀青30 min,并在60 ℃下干燥36 h,粉碎后过0.15 mm尼龙筛,贮存于干燥阴凉处,备用.
1.2 试验设计
1.2.1陈皮添加量和Cr(Ⅵ)初始浓度对土壤中Cr(Ⅵ)去除过程的影响
为分析陈皮对土壤中高Cr(Ⅵ)浓度的去除效果,向HN-High土壤中分别加入1.0%、2.0%、2.5%、5.0%、7.5%和10.0%(土壤干质量的百分比)的陈皮粉末,以不添加陈皮粉末的土壤作为对照,在培养第0、3、7、15、25和30天取样,分析土壤中Cr(Ⅵ)浓度及其浸出浓度的变化.
基于上述试验结果,将5%的陈皮粉末分别添加到3种不同污染程度(HN-Low、HN-Mid和HN-High)的室内模拟土壤中,分别标记为HT-Low、HT-Mid和HT-High,以不添加陈皮粉末的土壤作为对照,在培养第0、3、7、15、25和30天取样,分析土壤中Cr(Ⅵ)浓度及其浸出浓度的变化.
1.2.2陈皮对污染土壤中Cr(Ⅵ)的去除效果及机制
选取Cr(Ⅵ)污染土壤,设置灭菌和非灭菌两种处理. 采用MLS-3751L-PC全自动高压灭菌器(Sanyo,Japan)灭菌2次,温度设定60 ℃,时间持续6 h,每次间隔2 h,灭菌完成后获得灭菌土壤. 试验处理如下: ①不做任何处理的Cr(Ⅵ)污染土壤(CK);②灭菌处理的Cr(Ⅵ)污染土壤(CKST);③Cr(Ⅵ)污染土壤添加5%的陈皮(HT);④灭菌后的Cr(Ⅵ)污染土壤添加5%的陈皮(HTS). 在培养第30天取样,分析土壤中Cr(Ⅵ)浓度及其浸出浓度和细菌群落结构的变化.
所有处理均在室温下培养,每个处理设置3个平行. 在培养周期内,定期向处理土壤中加入去离子水,使土壤含水量维持在30%~40%. 每个处理采集土样200 g,用于Cr(Ⅵ)浓度及其浸出浓度的测定. 处理额外采集土样20 g,用于16S rDNA测定.
1.3 分析方法
1.3.1土壤理化性质测定
使用FiveEasy Plus台式pH计〔FE28-Standard,梅特勒托利多科技(中国)有限公司〕在土壤-水悬浮液中(m/V为1∶2.5)测定pH;使用TOC-5000分析仪(Shimadzu,Japan)测定总有机碳含量;使用电感耦合等离子体质谱仪〔ICAP RQ,赛默飞世尔科技(中国)有限公司〕测量阳离子交换量[15]. 参照《土壤和沉积物铜、锌、铅、镍、铬的测定 火焰原子吸收分光光度法》(HJ 491-2019)和《土壤和沉积物 六价铬的测定 碱溶液提取-火焰原子吸收分光光度法》(HJ 1082-2019)分别测定土壤中总铬和Cr(Ⅵ)浓度,检出限分别为4和0.5 mg/kg;参照《固体废物 浸出毒性浸出方法 硫酸硝酸法》(HJ/T 299-2007)测定Cr(Ⅵ)的浸出浓度,检出限为0.004 mg/L.
1.3.2DNA提取与高通量测序
土壤总DNA使用天根生化科技(北京)有限公司生产的Magnetic Soil And Stool DNA试剂盒提取.应用带有barcode的特异性引物序列341F(5'-CCTA YGGGRBGCASCAG-3')和806R(5'-GGACTACNNGG GTATCTAAT-3')扩增细菌16S rDNA的V3~V4区域.使用TruSeq DNA PCR-Free Library Preparation试剂盒(Illumina,USA)建库试剂盒进行文库的构建,经Qubit@2.0荧光剂定量和检测后,用Illumina NovaSeq进行高通量测序.
使用fastp(Version 0.20.0)对测得的原始序列进行质控,使用FLASH(Version 1.2.7)对原始序列片段进行拼接[16]. 拼接后的数据由QIIME(Version 1.9.1)[17]质量过滤器过滤后,基于97%的序列相似性进行OTU归并和划分,并使用RDP classifier[18]对每条序列进行物种分类注释. Chao1指数和Shannon-Wiener指数分别用于评价土壤细菌群落的丰富度和均匀度[19].通过主坐标分析(Principal co-ordinates analysis,PCoA)和优势物种相对丰度分析来揭示细菌群落组成与结构的变化规律. 主坐标分析和群落组成分析制图均利用R语言(Version 3.3.1)工具. 采用PICRUST对OTU丰度表进行标准化,计算各功能类别的丰度,并通过Student's t-test对PICRUST中功能基因进行假设性检验,以评估丰度差异的显著性水平[20].
1.3.3XANES分析
使用中国科学院高能物理研究所1W1B-XAFS试验站的同步辐射装置测定铬K边的X射线近边吸收光谱(X-ray absorption near-edge structure,XANES).光束线为1W1B,储存环中电子能量为2.5 GeV,流量为200 mA. Cr的参考标准物质包括K2Cr2O7和CrCl3.由于样品中Cr的浓度较低,标准物质中Cr的浓度较高,故分别采用荧光模式和透射模式进行测定,以确保结果更加真实合理. 使用Athena软件测定数据进行合并、本底扣除和归一化分析[21].
1.4 统计方法
数据采用SPSS 18.0和Excel 2019软件进行处理.
2 结果与讨论
2.1 陈皮添加量对土壤中Cr(Ⅵ)去除效果的影响
不同陈皮添加量对土壤中Cr(Ⅵ)浓度及其浸出浓度的去除效果见图1. 由图1可见,随着陈皮添加量的增加,土壤中Cr(Ⅵ)浓度及其浸出浓度均显著降低. 当陈皮添加量由1%增至5%时,土壤中Cr(Ⅵ)的去除效果明显增强,Cr(Ⅵ)浓度从(405.50±7.50)mg/kg降 至(14.50±6.98) mg/kg,Cr(Ⅵ)浸 出 浓 度 从(31.40±0.10) mg/L降至(1.06±0.28) mg/L. 继续增加陈皮添加量至10%,土壤中Cr(Ⅵ)浓度及其浸出浓度略有下降,直至趋于稳定,Cr(Ⅵ)浓度及其浸出浓度分别为(5.24±2.31) mg/kg和(0.47±0.11) mg/L. 陈皮添加量的进一步增加并没有导致Cr(Ⅵ)去除效果的显著增强. 可见,陈皮添加量为5%时能较好地去除土壤中Cr(Ⅵ).

图1 陈皮添加量对土壤中Cr(Ⅵ)浓度和Cr(Ⅵ)浸出浓度的影响Fig.1 Effect of the amount of tangerine peel added on the Cr(Ⅵ) concentration in soil and the Cr(Ⅵ)leaching concentration with cultivation time
2.2 Cr(Ⅵ)初始浓度对陈皮去除土壤中Cr(Ⅵ)效果的影响
陈皮对不同Cr(Ⅵ)污染程度土壤的去除效果如图2所示. 由图2可见,未添加陈皮时,各处理土壤中Cr(Ⅵ)浓度和浸出浓度在30 d内没有明显变化.添加5%陈皮后,各处理土壤中Cr(Ⅵ)浓度和浸出浓度均随培养时间的增加而降低,其中HT-Low处理的下降速率最快,HT-Mid和HT-High次之. 随着Cr(Ⅵ)初始浓度升高,陈皮对土壤中Cr(Ⅵ)的去除效果逐渐减弱. 然而,即使当土壤中Cr(Ⅵ)初始浓度高达(1 713.33±206.77) mg/kg时,陈皮对Cr(Ⅵ)的去除率仍可达99.15%. 由此可见,陈皮对不同Cr(Ⅵ)程度的污染土壤均有较好的修复效果.
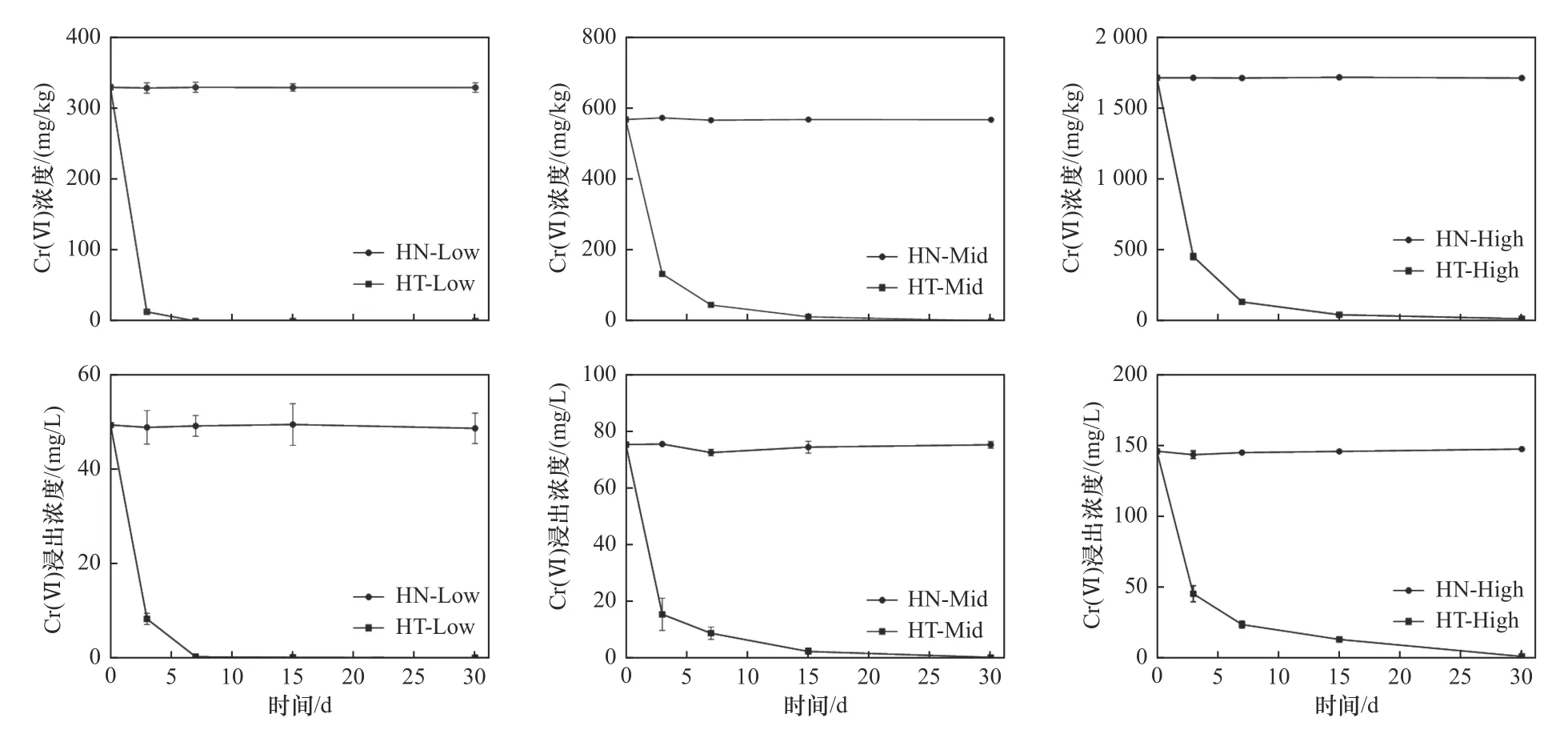
图2 土壤中Cr(Ⅵ)初始浓度对陈皮去除Cr(Ⅵ)效果的影响Fig.2 Effect of the initial Cr(Ⅵ) concentration on the Cr(Ⅵ) removal efficiency in soil by tangerine peel
2.3 土壤灭菌对陈皮去除土壤中Cr(Ⅵ)效果的影响
陈皮对未灭菌(CK)和灭菌土壤(CKST)中Cr(Ⅵ)的去除效果如图3所示. 由图3可见,在未添加陈皮时,土壤中Cr(Ⅵ)浓度及其浸出浓度在灭菌前后无显著变化,表明单一灭菌处理对土壤中Cr(Ⅵ)浓度和浸出浓度的影响有限. 陈皮添加量为5%时,CK处理中Cr(Ⅵ)浓度由初始的(1 600.13±298.11) mg/kg降至(10.07±2.98) mg/kg,Cr(Ⅵ)浸出浓度由初始的(143.20±13.5) mg/L降至(1.02±0.30) mg/L;而CKST处理土壤中Cr(Ⅵ)浓度从(1 596.67±216.73) mg/kg降至(143.20±13.5) mg/L,Cr(Ⅵ)浸出浓度从(135.24±5.87)mg/L降至(8.28±1.56) mg/L. 结果表明,陈皮对CK处理中Cr(Ⅵ)的去除效果显著高于CKST处理(P<0.05),土壤微生物可能是造成该现象的主要原因. 土壤中细菌与重金属离子之间存在复杂的关系,活性状态下重金属离子会影响细菌的多样性和代谢活性,而细菌可以通过防御系统缓解重金属离子的胁迫,如将活性态重金属离子转化为非活性态[22]. 可见,除陈皮本身的去除作用外,土壤微生物也会对陈皮去除土壤中Cr(Ⅵ)产生积极作用.
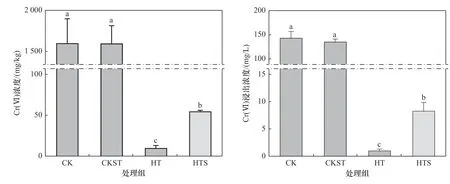
图3 灭菌处理对陈皮去除土壤中Cr(Ⅵ)浓度和Cr(Ⅵ)浸出浓度的影响Fig.3 Effect of sterilization treatment on the removal of Cr(Ⅵ) concentration and Cr(Ⅵ) leaching concentration from soil by tangerine peel
2.4 陈皮对土壤中细菌群落多样性的影响
由图4可见,与CK处理相比,CKST处理中细菌群落的Chao1指数和Shannon-Wiener指数无显著变化(P>0.05). 这与Carter等[23]的试验结果不一致,这可能是由于在高温高压灭菌过程中,容器中的土壤很难达到完全分布均匀的状态,使得土壤中的部分区域受热不均以致很难使土壤细菌完全失活. 此外,如果土壤中某些细菌处在对高温高压有较强抗性的芽孢或休眠阶段,它们也会一直存在于灭菌后的土壤中,甚至会由于外界环境条件的改变(温度升高、压强增大),在短时间内转为活性状态并大量繁殖[24]. 上述两点原因可能直接导致了CKST处理中细菌群落的多样性指数无明显变化.
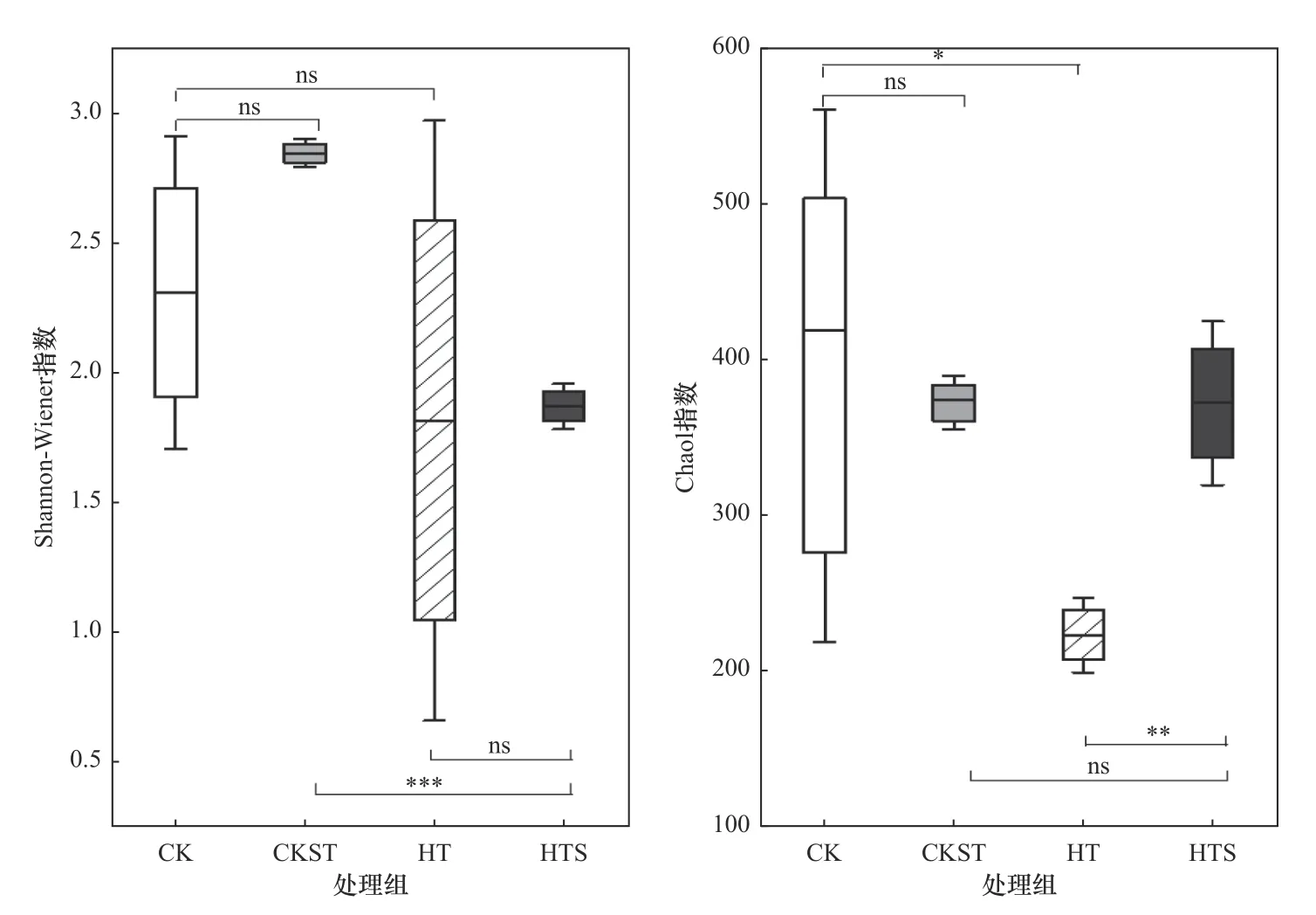
图4 不同土壤中细菌群落的Shannon-Wiener指数和Chao1指数Fig.4 Shannon-Wiener and Chao1 indexes of the soil bacteria in different treatments
添加陈皮后,CK和CKST处理中细菌群落的Chao1指数和Shannon-Wiener指数呈现不同的变化规律. CK处理土壤中细菌群落的Chao1指数显著降低,Shannon-Wiener指数无显著变化;而CKST处理土壤中细菌群落的Chao1指数无显著变化,Shannon-Wiener指数却显著降低. 结果表明,陈皮不论添加至未灭菌土壤还是灭菌后土壤,都会导致细菌群落多样性的降低. 然而,一些研究[25-26]表明,将农林废弃物添加至土壤后,有机碳和有效氮含量的增加会导致细菌群落多样性也随之增加. 这与本研究所得试验结果不一致,原因可能是土壤中铬的形态和浓度影响了细菌群落的构建.
主成分分析可反映不同处理中细菌群落组成的差异性. 由图5可见,相同处理下土壤菌群较好地聚集在一起,而不同处理群落之间具有明显分异. 其中,未经过高温高压灭菌处理的两组(CK和HT)距离较近,表明陈皮在除去土壤中Cr(Ⅵ)的过程中对土壤细菌群落的扰动较小,同时再次证实了细菌在陈皮去除Cr(Ⅵ)过程中的贡献较小.

图5 不同处理土壤中细菌群落的主成分分析Fig.5 Principal component analysis of the bacterial community
2.5 陈皮对土壤中细菌群落组成的影响
不同处理土壤的细菌群落相对丰度如图6所示.由图6可见,厚壁菌门(Firmicutes)是CK处理中的优势菌门,其相对丰度为64.14%;芽孢杆菌属(Bacillus)则是该处理中的最优菌属,其相对丰度为54.69%. 与CK处理相比,经过高温高压灭菌处理的CKST处理土壤中厚壁菌门(Firmicutes)的相对丰度降至6.92%,变形菌门(Proteobacteria)的相对丰度增至70.48%;青枯菌属(Ralstonia)和假单胞菌属(Pseudomonas)是此时土壤中存在较为丰富的菌种,它们的相对丰度分别为35.31%和16.21%. 放线菌门(Actinobacteria)是广泛存在于各处理土壤中的菌门,其在HTS处理土壤中相对丰度(83.30%)最大,HT处理(25.64%)次之. 然而,HT处理中并没有优势菌种,但链霉菌属(Streptomyces)是HTS处理土壤中的优势菌属(71.24%).
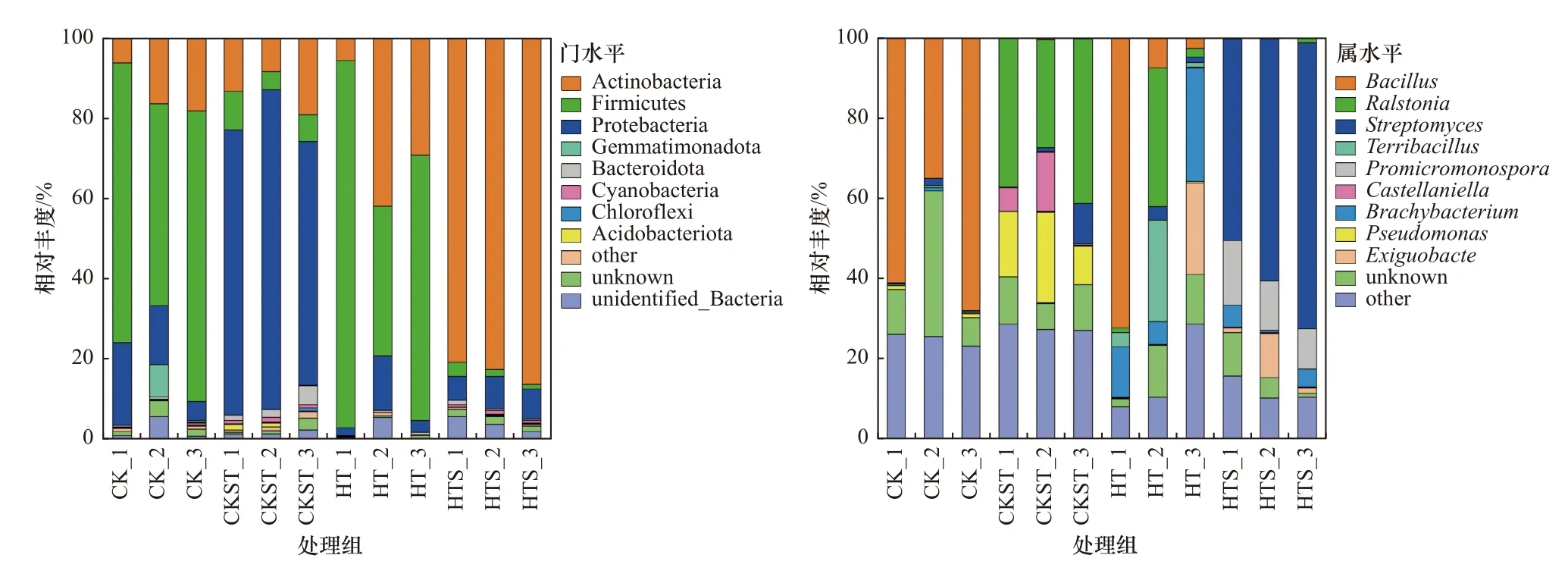
图6 不同处理土壤中细菌群落的物种组成Fig.6 Species composition of the soil bacterial community
根据样本间物种丰度的相似性进行聚类,可更明显地呈现各组处理土壤中高丰度和低丰度的菌种. 由图7可见,HT_2和CK处理的3个样本较好地聚类在一起,而CKST_3和HTS处理的3个样本聚类在一起,前者表明陈皮对细菌群落结构的扰动较低,后者则表明在灭菌时土壤受热不均匀,导致土壤中仍存在具有Cr(Ⅵ)去除潜力的菌种. 尽管如此,各处理土壤中均有特异性菌种富集. CK处理土壤中相对丰度较高的菌属多具有耐盐、耐碱和金属耐受性,如诺卡氏菌属[27](Nocardioides)、嗜盐生地所球菌[28](Egicoccus)等,但它们只能在非高温的土壤中才能正常生长. 高温高压灭菌处理使土壤中大部分土著菌属失去活性,高度灵活且具有趋化性的菌属数量增加,如青枯菌属[29](Ralstonia)、Bryobacter[30]等,这些菌属不仅具有耐盐、耐碱或金属耐受性,同时还具有嗜温热性. 当添加陈皮后,有机碳等物质的输入丰富了土壤中细菌的营养底物,与碳、氮固定相关的菌属大量富集. 同时也刺激了原有土壤中具有Cr(Ⅵ)还原潜力菌属的代谢和繁殖,使其在处理后的土壤中得到不同程度的富集,并能将有机碳作为活性电子供体促进了Cr(Ⅵ)的还原[31]. 其中HT处理中典型的菌属包括微杆菌属(Microbacterium)、土壤球菌属(Agrococcus)、链球菌属(Streptococcus),HTS处理土壤中的典型菌属则为链霉菌属(Streptomyces).
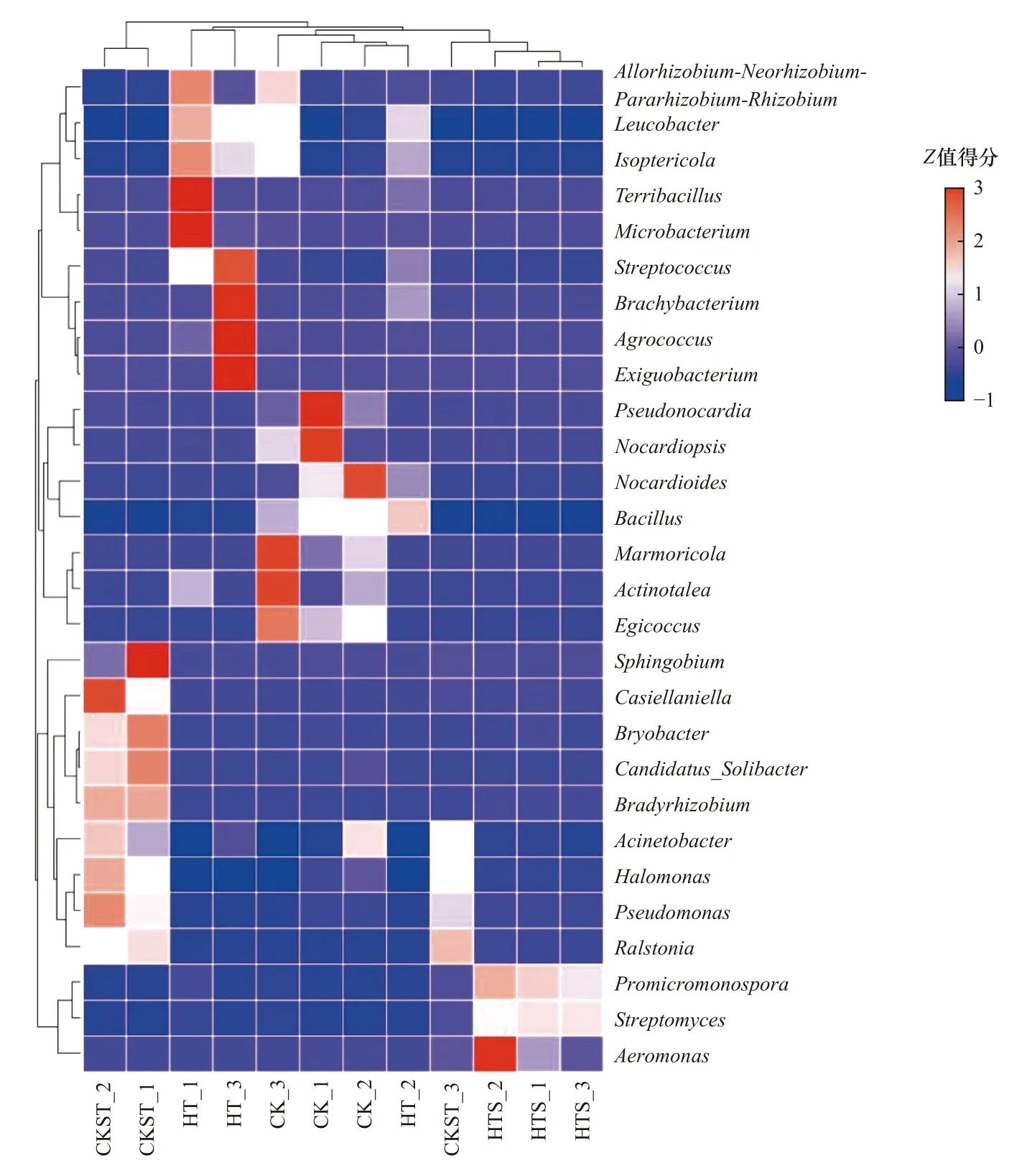
图7 不同处理土壤中特异性富集菌属的相对分布情况Fig.7 Relative distribution of some bacterial genera in each treatment
一些研究证实了这些特异性富集菌属具有Cr(Ⅵ)还原潜力,如Chen等[32]在制革厂的土壤中发现并分离出土壤球菌属(Agrococcus)的两个Cr(Ⅵ)还原菌株,并证实它们对Cr(Ⅵ)的最大去除率可达99.1%. 微杆菌属(Microbacterium)是存在于制革废水的革兰氏阳性菌,能适应Cr(Ⅵ)浓度较高的环境. 研究[33]表明,微杆菌属(Microbacterium)对环境中不同浓度Cr(Ⅵ)均有去除效果,但去除效果却随Cr(Ⅵ)浓度的升高而减弱. 在Cr(Ⅵ)还原过程中,微杆菌属(Microbacterium)表面形态与胞内代谢活动发生变化,大量铬酸盐还原酶在胞内累积,这表明它依靠胞内酶还原Cr(Ⅵ). 链球菌属(Streptococcus)是近期被证实可用于Cr(Ⅵ)修复的菌属,它主要通过细菌表面形成的生物膜吸附Cr(Ⅵ),如Streptococcus equisimilis[34]、Streptococcus salivarius[35]两种代表菌株. 而HTS处理土壤中的链霉菌属(Streptomyces)则是现阶段修复Cr(Ⅵ)污染土壤的代表性菌属,其大多数菌株对浓度低于200 mg/L的土壤具有极高的修复效果,并在35 ℃时仍具有较好的Cr(Ⅵ)去除效果,它主要利用细胞内产生的脱氢酶还原Cr(Ⅵ)[36]. 这些研究结果表明,陈皮的添加驱动了土壤中Cr(Ⅵ)还原菌不同程度的富集. 当土壤细菌处于重金属污染的环境时,低浓度的重金属能促进它们的生长,但随着重金属浓度的增加,它们会受到明显的抑制作用[31]. 在该研究高浓度Cr(Ⅵ)污染土壤中,陈皮的加入除了给予细菌大量的营养物质外,还在一定程度上缓解了Cr(Ⅵ)对土壤细菌的毒性抑制作用,改善了土壤细菌的外在生长环境,促进了具有Cr(Ⅵ)还原潜力的土著菌种数量的增大和累积. 尽管这些菌属不同时存在于陈皮处理后的土壤中,但这也是陈皮去除Cr(Ⅵ)过程中不可忽视的途径.
2.6 陈皮对土壤中细菌群落功能基因的影响
基于土壤细菌群落变化,利用PICRUST软件对陈皮处理后菌群的功能基因进行预测,基因的平均占比及显著性如图8所示. 这些变化的功能基因中有8个功能基因的表达比例在陈皮处理组中表现为增加,其中维生素B6代谢功能显著上调(P<0.05).

图8 不同处理土壤中细菌群落代谢功能分析Fig.8 Functional analysis of the bacterial community
添加陈皮后,由于有机碳的大量输入,细菌胞质中三羧酸、戊糖磷酸等途径显著上调. 同时参与碳、氮代谢且能介导应激反应的磷酸转移酶系统的相关基因也大量表达,这是细菌催化转运和调节能力的一种体现,可能是细菌缓解Cr(Ⅵ)毒性的一种代谢途径. 由于土壤中Cr(Ⅵ)浓度随着陈皮添加量的增加而逐渐降低,细菌胞内DNA也通过碱基切除修复、错配修复等自身修复系统加以重组和修复. 然而,在HT处理中菌群的维生素B6代谢起到不可忽视的调节作用. 维生素代谢是细菌还原Cr(Ⅵ)的一种非特异性反应,其往往是作为氧化还原的中间产物参与去除过程,但细菌中仅有少数维生素类化合物被证实具有Cr(Ⅵ)还原潜力,如维生素B2[37]和维生素C[38]. 现阶段,维生素B6减轻Cr(Ⅵ)毒性的能力仅在小白鼠身上得到证实[39],但鉴于动物细胞和菌细胞的差异,其在缓解细菌Cr(Ⅵ)毒性方面的作用还需进一步研究确认.
2.7 陈皮对土壤中Cr(Ⅵ)去除机理
通过X射线近边吸收光谱分析了CK和HT处理土壤中铬形态的变化. 从XANES图谱(见图9)中可以看到,标样K2Cr2O7在5 992 eV附近有明显的特征峰Peak1,CrCl3在6 007 eV附近有明显的特征峰Peak2,这分别代表了Cr(Ⅵ)和Cr(Ⅲ)的特征峰. 对比两组处理发现,CK处理同时在Peak1和Peak2处出现峰值,表明土壤中同时存在Cr(Ⅵ)和Cr(Ⅲ). 向土壤中添加陈皮后,Peak1峰面积显著减小,Peak2峰面积显著增加,表明土壤中Cr(Ⅵ)被还原为Cr(Ⅲ).
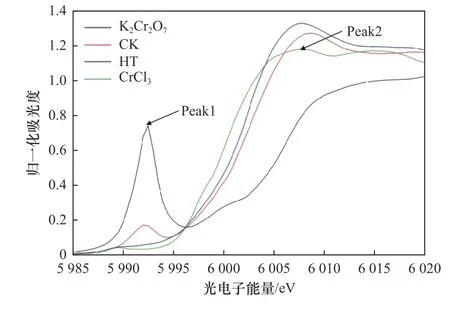
图9 陈皮对土壤中Cr赋存状态的影响Fig.9 Normalized K-edge spectra of Cr in soil
尽管陈皮本身和土壤细菌均在去除过程中起作用,但陈皮本身可能起主导作用,即陈皮在进入土壤后被微生物分解,其中的大分子物质(如纤维素、黄酮醇苷)等水解释放出可络合还原Cr(Ⅵ)的小分子有机物(如葡萄糖[13]、槲皮素[14]等). 研究证实,槲皮素中具有孤对电子的双键基团和羟基基团,能与Cr(Ⅵ)发生螯合作用,过程中Cr(Ⅵ)易被槲皮素还原为Cr(Ⅲ),而槲皮素作为电子提供者则被氧化为醌类物质,其对Cr(Ⅵ)的还原率高达99.99%[13,40]. 葡萄糖作为还原性糖,其分子中的醛基官能团也可将Cr(Ⅵ)还原,并产生铬酸络合物或氢氧化铬不溶性物质[18,41]. 因此,这些有机物可能在陈皮去除Cr(Ⅵ)过程一直发挥着作用.
综上,陈皮去除土壤中Cr(Ⅵ)的主要作用途径是通过其中纤维素和黄酮醇苷等在土壤中水解的小分子物质,直接将Cr(Ⅵ)还原为Cr(Ⅲ). 此外,陈皮可作为碳源,驱动土壤中具有Cr(Ⅵ)还原能力的菌种间接还原Cr(Ⅵ),但其贡献量较低.
3 结论
a) 陈皮能在较短时间内有效去除污染土壤中Cr(Ⅵ),当土壤中Cr(Ⅵ)初始浓度为(1 600.13±298.11)mg/kg、Cr(Ⅵ)浸出浓度为(143.20±13.5) mg/L、陈皮添加量为5%时,培养30 d后,土壤中Cr(Ⅵ)浓度及其浸出浓度分别降至(10.07±2.98) mg/kg和(1.02±0.30)mg/L,去除率分别达到99.37%和99.29%.
b) 陈皮降低了土壤中细菌群落的丰度和多样性,并改变了群落的组成. 放线菌门(Actinobacteria)是陈皮添加后土壤中的优势菌门,而微杆菌属(Microbacterium)、土壤球菌属(Agrococcus)、链球菌属(Streptococcus)和链霉菌属(Streptomyces)是土壤中特异性富集的4种菌属,且均具有还原Cr(Ⅵ)的潜力. 此外,细菌群落中维生素B6代谢的相关基因显著上调,这可能是它们还原Cr(Ⅵ)的主要代谢途径.
c) 陈皮对土壤中Cr(Ⅵ)的去除是一个复杂的过程,陈皮中大分子物质的水解产物对Cr(Ⅵ)的还原作用在过程中起主要作用. 此外,陈皮也可作为碳源,驱动土壤中具有Cr(Ⅵ)还原能力的菌种富集,但其还原贡献量较低.

