混合配体构筑的水相高稳定Zn(Ⅱ)金属有机框架铁离子荧光探针*
王凯民,石明凤,李立凤,樊保敏,孙蔚青,马钰璐
1.云南民族大学化学与环境学院,云南昆明 650504
2.昆明医科大学药学院/云南省天然药物药理重点实验室,云南昆明 650500
Fe3+是包括人类在内的所有生物体中不可或缺的元素之一,它在维持人体器官的正常功能和代谢中发挥重要作用。人体内Fe3+含量的不足或者过量都可导致严重的疾病[1]。过量摄入Fe3+会导致帕金森病、糖尿病、心血管衰竭和肝脏损害等一些威胁人类健康的疾病[2]。因此,检测食品、药品和环境中的Fe3+是非常有必要的。目前,已经发展了许多Fe3+检测方法,包括气相色谱、电感耦合等离子体质谱、原子吸收光谱和分光光度法等[3]。但是这些方法具有需要昂贵的精密仪器、复杂的样品预处理过程、测试成本高且耗时长、需特定专业的实验人员处理等缺点,限制了它们的广泛应用[4]。所以寻找操作简单、响应速度快、灵敏度高、能够识别和检测水中Fe3+离子的方法非常有必要。
金 属 有 机 框 架(MOFs,metal-organic frameworks)是由有机配体和金属离子或团簇组成的晶态多孔材料,具有较高的孔隙率、稳定的结构和巨大的表面积,已广泛应用于催化、吸附和分离、药物储存和传感等领域[5]。由于金属离子和有机配体的不同,许多MOFs 具有独特的发光特性,能够作为传感器检测金属离子、有机小分子和硝基爆炸物等[6]。迄今为止,MOFs 作为检测Fe3+离子的荧光传感器虽然已经被报道。然而,大多数MOFs 稳定性差,只能在有机溶剂体系中使用,只有少数基于MOFs 的传感器可以在水中或潮湿的环境中保持其稳定性[7]。因此,设计和合成在水中能够灵敏和选择性地传感Fe3+离子的MOFs,在人类健康和环境保护方面是一个重大的突破[8]。
为了设计合成在水中稳定性较好的MOFs,我们选择咪唑衍生物4,4′-双(2-甲基-1H-咪唑-1-基)-1,1′-联苯(4,4′-BMIB)来帮助2,5-二甲氧基对苯二甲酸(H2DTA)与d10类金属Zn(Ⅱ)构建出具有荧光性质的MOF即[Zn(DTA)(4,4′-BMIB)]n。一方面,H2DTA 作为有机配体,它的两个刚性羧酸基表现出丰富的配位位点,而且两个甲氧基作为供电子基团可以增加配体的亲核性,使其更容易配位;另一方面,咪唑衍生物的π共轭结构不仅能够提高MOFs 的发光性能,还能增强结构的稳定性,这些为检测水中的Fe3+离子提供了很大的优势。本文报道[Zn(DTA)(4,4′-BMIB)]n的合成以及其对水中Fe3+离子的检测结果。
1 实验部分
1.1 试剂及仪器
实验中所用的H2DTA、4,4′-BMIB(图1)和Zn(BF4)2·6H2O 均为市售分析纯。配合物的单晶数据是在Rigaku 003 型X-射线单晶衍射仪上测试得到,粉末X 射线衍射和热稳定性数据分别是在理学Ultima Ⅳ型粉末衍射仪和Netzsch Sta 449F5 热重分析仪上测得;C、H 和N 的元素分析用Elementar Vario EL Ⅲ元素分析仪测得;红外光谱Agilent Cary660 FTIER 红外光谱仪上获得;紫外可见吸收光谱通过北京普析TU-1901紫外可见分光光度计测得;荧光数据通过日立F-7000 型荧光仪得到。
图1 H2DTA、4,4'-BMIB的结构Fig.1 Structure of H2DTA and 4,4'-BMIB
1.2 配合物[Zn(DTA)(4,4′-BMIB)]n(MOF 1)的合成
将H2DTA(22.0 mg,0.1 mmol),4,4′-BMIB(31.0 mg,0.1 mmol)和Zn(BF4)2·6H2O(36.0 mg,0.15 mmol)溶解于DMA/H2O/CH3OH(4 mL,体积比2∶1∶1)混合液中,室温下搅拌20 min 后转移至25 mL的反应釜中,在100 ℃下恒温反应72 h,自然冷却至室温后过滤得到无色块状晶体(产率42%,基于配体H2DTA),分子式C30H26N4O6Zn。元素分析理论计算值(w/%):C 59.66,H 4.34,N 9.28;实验值(w/%):C 58.35,H 4.47,N 9.13。FTIR主要数据(KBr压片,cm-1)v:3 405(m),1 587(s),1 506(s),1 458(m),1 398(s),1 340(m),1 027(m),758(s)。
1.3 配合物的晶体结构解析
MOF 1 的 单 晶X 衍 射 数 据 在Rigaku 003 型X-射线单晶衍射仪上以Mo-Kα 射线(T=295.2 K,λ=0.071 073 nm)为辐射源,石墨单色器和ω变换扫描方式获得。晶体数据吸收校正后,在Olex2 软件中用SHELXT-2014 和SHELXL-2017 程序对配合物做结构解析[9-10]。采用全矩阵最小二乘法对非氢原子的坐标和各向异性热参数进行了精修,配合物的晶体学数据及部分键长、键角见表1 和表2。MOF 1的CCDC号为2166791。
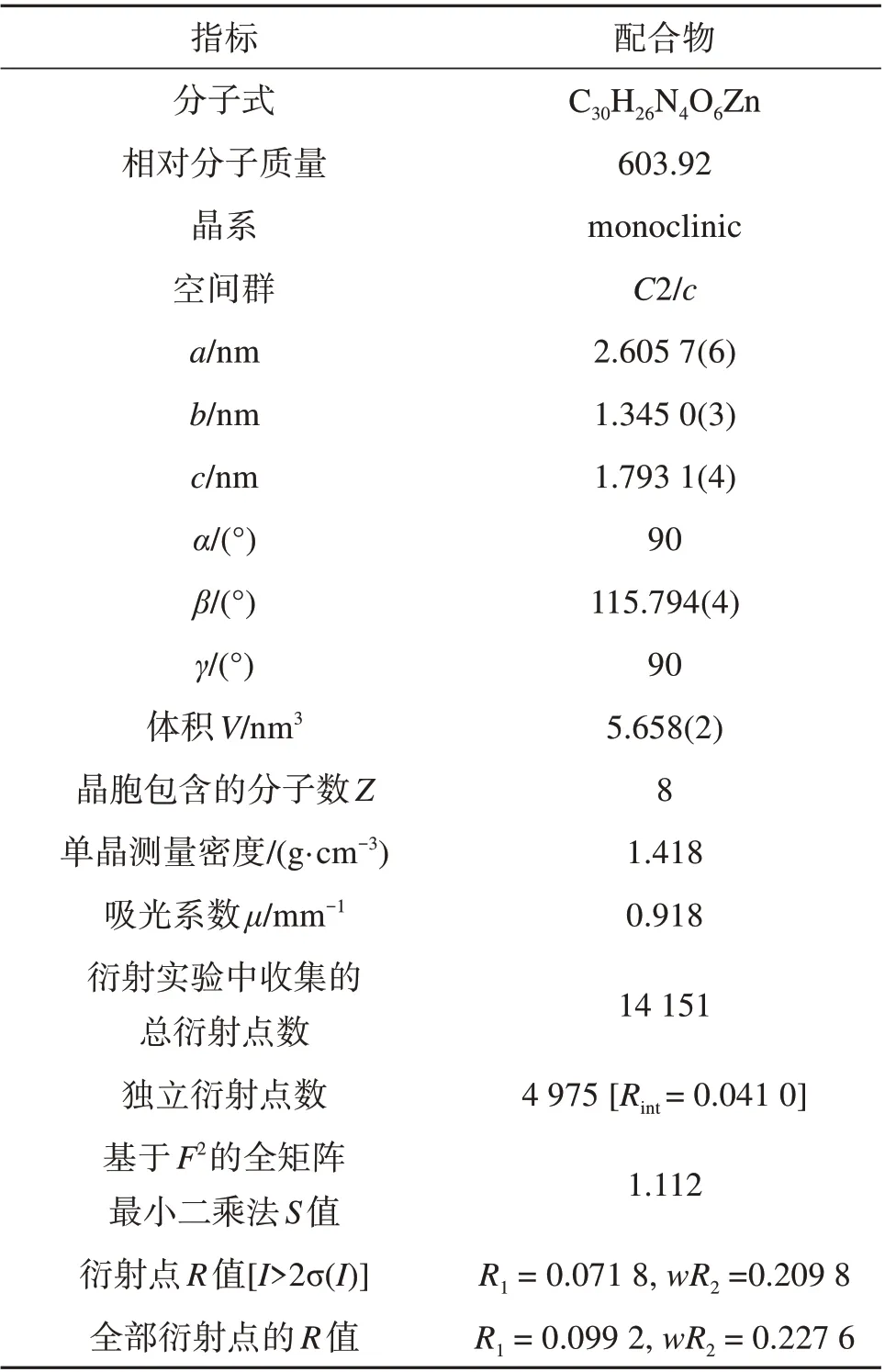
表1 MOF 1参数Table 1 Parameters of MOF 1
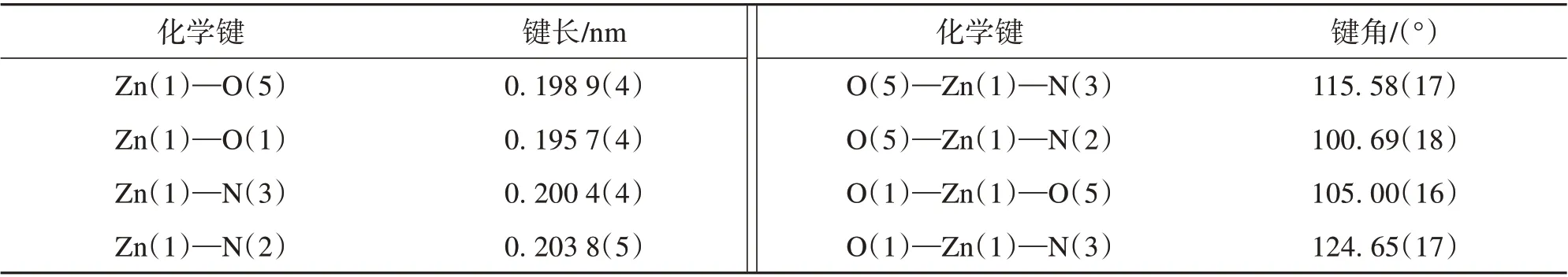
表2 MOF 1的部分键长和键角Table 2 Selected bond lengths and angles of MOF 1
2 结果与讨论
2.1 配合物的晶体结构
单晶X 射线衍射结果表明该配合物属于单斜晶系的C2/c空间群,其不对称单元包含了一个Zn2+离子,一个去质子化的DTA2-配体,一个4,4′-BMIB 辅助配体。如图2 所示,Zn2+以四配位的模式与两个DTA2-配体上的羧基O 原子(O1 和O5)和两个4,4′-BMIB 配体上的N 原子(N2 和N3)配位,形成一个变形四面体构型(图2a)。在该配合物中,Zn—O 的键长在0.195 7(4)~ 0.198 9(4)nm 之间,Zn—N的键长在0.200 4(4)~0.203 8(5)nm之间。
在配合物中,咪唑类配体4,4′-BMIB 连接2个相邻的Zn(Ⅱ)离子形成一维链结构,同时羧酸配体DTA2-以μ2-η1:η1的配位模式也与2 个Zn(Ⅱ)离子连接在不同方向上形成了另一个一维链状结构(图2b)。两种一维链穿插连接最终形成配合物的三维结构(图2c)。从拓扑的角度来看,配合物的三维框架可以简化为一个四连接的hjm网络,其拓扑符号为(63·103)(图2d)。
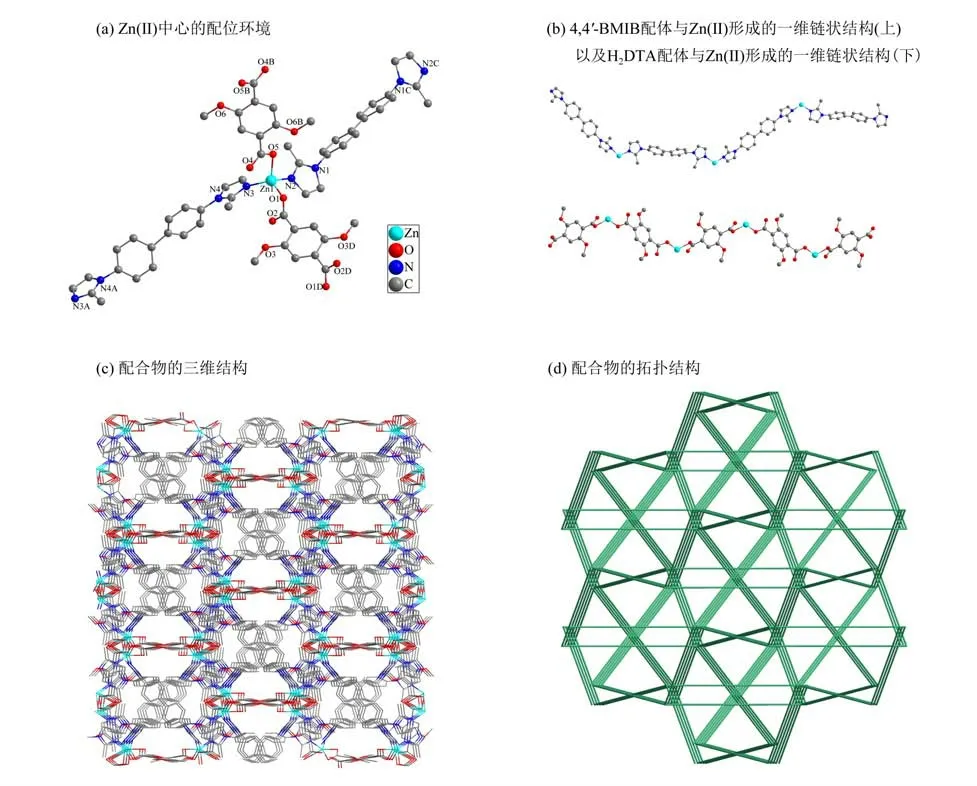
图2 MOF 1的结构示意图Fig.2 Schematic diagram of the structure of MOF 1
2.2 PXRD、稳定性和固体荧光分析
为了检测配合物的相纯度,将此配合物在室温下进行了粉末衍射(PXRD)测试。结果显示配合物的粉末衍射峰位置与它的单晶衍射数据模拟的XRD 谱图的衍射峰基本吻合,也未出现其他的衍射峰,表明该配合物比较纯(图3a)。
为探究MOF 1 的热稳定性,利用Netzsch Sta 449F5 热重分析仪在N2保护下,在25~800 ℃范围内以10 ℃/min 的加热速率收集其热稳定性(TGA)数据,最终得到图3b 所示的热重曲线。MOF 1 从25 °C 开始,至367 ℃时均未出现明显质量损失,367 ℃开始,则出现了急剧质量损失,其对应于MOF 1 骨架结构的逐步坍塌,800 °C 时失质量仍在持续。以上结果显示MOF 1 具有较好的热稳定性。
为研究配合物1 在水及不同pH 水溶液中的稳定性,分别将MOF 1 粉末加入至去离子水、pH=3和pH=5 的HCl水溶液、pH=9 和pH=11 的NaOH 水溶液中,超声混匀后在室温下浸泡3 d 后抽滤,自然晾干,测试在浸泡不同水溶液后样品的PXRD数据。通过对比,在水及不同pH 水溶液中浸泡后的MOF 1 样品PXRD 衍射峰与原始实测峰基本吻合(图3a),说明MOF 1 在不同酸碱性水溶液中均能保持结构的稳定。
考虑到d10类金属Zn(Ⅱ)离子和共轭有机配体所构建的配合物具有很好的荧光特性,是一种潜在的发光材料。本文在室温下研究了该配合物的固态发光性质,如图3c 所示。在275 nm 的激发处,H2DTA配体在410 nm处有一个最大的发射峰。而配合物的最大发射峰出现在390 nm(λex=322 nm)处。与H2DTA 配体相比,配合物的荧光增强不少且发射峰位置蓝移了20 nm。其中d10电子构型的Zn(Ⅱ)离子较为稳定,难以氧化或还原。因此,这些发射不可能是金属-配体间的电荷转移,应归因于配体间的(n-π*或π-π*)相互作用引起的[11]。
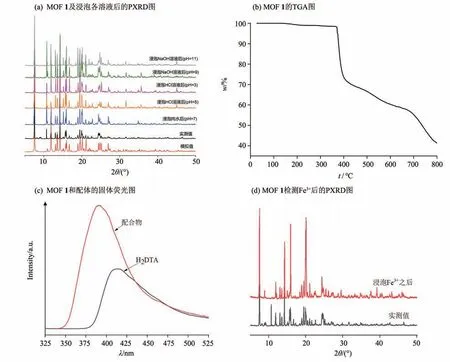
图3 MOF 1材料基本性质表征Fig.3 Characterization of basic properties of MOF 1 materials
2.3 MOF 1的传感特性
为了探究该配合物能否在水中检测金属离子,我们用其对不同的金属离子进行了发光传感实验。分别将2 mg 充分磨细的MOF 1 分别浸泡在5 mL含有0.01 mol/L 的不同硝酸盐(Zn2+、Na+、Co2+、Ni2+、Hg+、Sr2+、NH4+、Mg2+、Mn2+、Ba2+、Cr3+、Ca2+、Fe2+和Fe3+)去离子水中,超声处理0.5 h,形成稳定的混浊悬浮液。然后分别做荧光检测,检测结果如图4所示,大多数金属离子对化合物的发光强度没有明显的影响,而加入Fe3+后,配合物的荧光几乎完全猝灭,说明该配合物能够在水相中检测Fe3+离子。
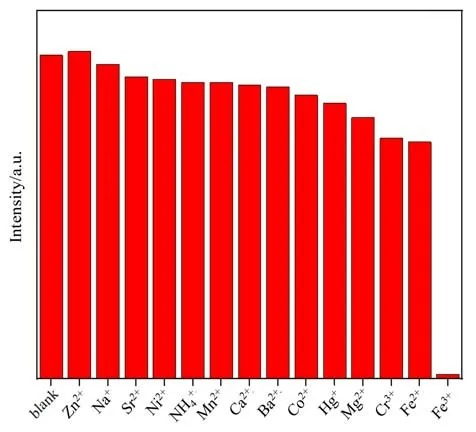
图4 MOF 1的悬浊液中加入不同金属离子的荧光强度Fig.4 Fluorescence intensities of different metal ions added to the suspension of MOF 1
为了进一步评估配合物对Fe3+的检测能力,我们进行了荧光滴定实验,发现随着Fe3+的滴入,悬浊液的荧光强度逐渐下降(图5a)。当Fe3+浓度达到5.51×10-3mol/L 时,荧光猝灭率达到了98.3%。通过Stern-Volmer 方程(I0/I= 1+Ksv[M])进行曲线拟合,其中I0是原始荧光强度,I为加入离子后的荧光强度,Ksv为荧光猝灭常数,[M]是离子的浓度[12],发现在低浓度范围,Fe3+的浓度与荧光强度有较好的线性关系(R2=0.997 0),经过计算可知Ksv为1.153×104L/mol(图5b)。由此可知,该配合物在水溶液中对Fe3+有较好的选择识别作用。另外,基于10组空白样品测量值,利用公式LOD=3σ/Ksv可计算出配合物检测Fe3+的检测限(LOD)为1.6×10-5mol/L,式中Ksv为Stern-Volmer 线性拟合后直线的斜率,即荧光猝灭常数;σ为测试标准偏差。以上实验结果与已有检测Fe3+的报道值相比均较好[13-15],证明MOF 1 具有较好检测Fe3+的能力,检测灵敏度高。
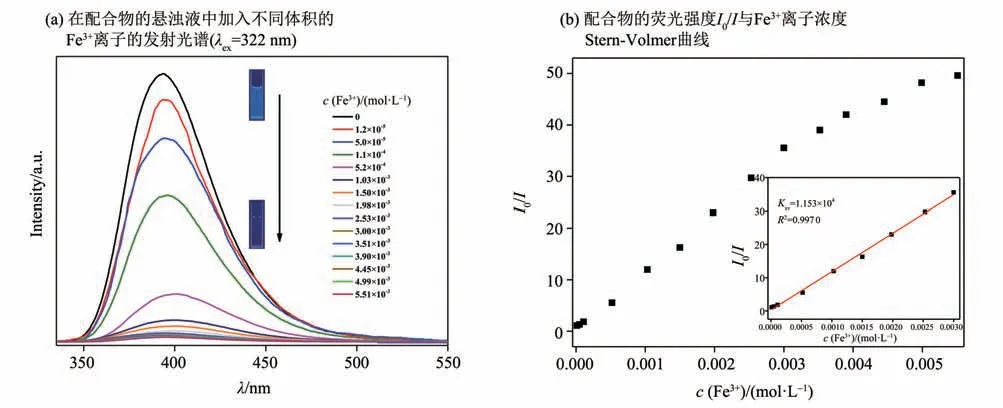
图5 MOF 1材料的荧光滴定实验Fig.5 Fluorescence titration experiment of MOF 1 material
考虑到其他离子存在下可能会对Fe3+的检测造成影响,我们进行了抗干扰实验,分别将2 mg 充分磨细的MOF 1 分别浸泡在5 mL 同时含有0.01 mol/L 的Fe(NO3)3和其他不同0.01 mol/L 的硝酸盐(Zn2+、Na+、Co2+、Ni2+、Hg+、Sr2+、NH4+、Mg2+、Mn2+、Ba2+、Cr3+、Ca2+和Fe2+)去离子水中,超声处理0.5 h,形成稳定的混浊悬浮液。然后分别做荧光检测表明在其他离子存在下对检测Fe3+没有影响(图6)。这说明该配合物对Fe3+具有良好的选择性和专一性。
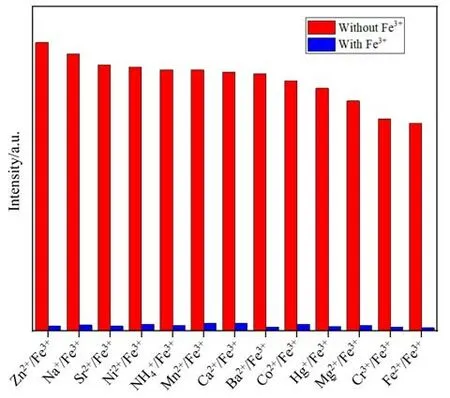
图6 MOF 1的悬浊液中加入Fe3+离子和其他离子时的荧光强度Fig.6 Fluorescence intensity when Fe3+ions and other ions are added to the suspension of the complex
2.4 MOF 1的荧光传感机理
在以往的研究中,金属离子使配合物发光猝灭主要是:(1)由于配合物框架的坍塌;(2)金属离子与配合物之间的竞争吸收[7,16]。为了证实Fe3+猝灭发光的可能原因,我们进一步探究它的机理实验。将配合物浸泡在0.01 mol/L 的Fe3+中24 h之后做粉末衍射,结果表明配合物的粉末衍射峰与模拟的衍射峰一致(图3d),说明配合物的晶体结构依旧保持完整,所以这种猝灭现象不是由框架的坍塌引起的。此外,将Fe3+的紫外-可见吸收光谱与配合物的激发光谱(322 nm)进行比较,发现配合物的激发峰被Fe3+的紫外吸收带完全覆盖(图7)。因此,该配合物检测Fe3+的荧光传感机理应属于金属离子与配合物之间的竞争吸收导致的荧光猝灭。

图7 Fe3+离子的紫外吸收光谱以及配合物的激发和发射光谱Fig.7 UV absorption spectra of Fe3+ions and excitation and emission spectra of the complex
3 结 论
综上所述,咪唑衍生物4,4′-BMIB和对苯二甲酸衍生物H2DTA 与Zn(Ⅱ)金属共同构建出具有荧光性质的三维MOF 1,荧光识别和滴定实验表明,该材料具有高选择性和高灵敏度地识别水中的Fe3+离子,猝灭常数为1.153×104L/mol。上述研究证明了MOF 1 是一种非常有潜力的铁离子的传感器候选者,未来有望运用于水环境中铁离子检测。

