D-阿洛酮糖生物合成研究进展
温鑫,宁宇航,刘光文,Mesfin Angaw Tesfay,林建强,2*,任一林,林慧彬,宋欣,林建群
1(微生物技术国家重点实验室(山东大学),山东 青岛,266237)2(山东金宸生物科技有限公司,山东 济南,250031)3(济南稀有糖生物技术有限公司,山东 济南,250000)4(青岛龙鼎生物技术有限公司,山东 青岛,266108)5(山东省中医药研究院,山东 济南,250014)
糖是一种重要食品原料,但存在高热量、导致血糖升高、龋齿等不利因素。随着经济的发展和人民生活水平的提高,人类饮食更加追求营养和健康。国际稀有糖协会(International Society of Rare Sugars,ISRS)定义稀有糖为自然界中存在但含量极少的一类单糖及其衍生物[1]。某些稀有糖不仅具有纯正的甜味,而且具有低热量、低吸收等特点,同时具有多种生理功能,在膳食、医药、保健等领域具有重要应用潜力,吸引着越来越多国内外科学家的广泛关注。
D-阿洛酮糖是D-果糖的C3位差向异构体,是一种低能量甜味剂,它的甜度为蔗糖的70%,但热量只有0.4 kcal/g,被认为是潜在的蔗糖替代品[2]。D-阿洛酮糖,英文名为D-allulose或D-psicose,化学式为C6H12O6,结构式见图1,摩尔质量为180.16 g/mol,极易溶于水,密度为1.35 g/cm3,外观为白色晶体,无特殊气味,CAS号为551-68-8。在美国,D-阿洛酮糖已经被食品药品监督管理局(Food and Drug Administration,FDA)认可为GRAS的成分,可以应用于食品中[3]。2020年,FDA发布行业指南,建议在食品标签上将D-阿洛酮糖排除在“总糖”、“添加糖”之外[4]。

图1 D-阿洛酮糖结构式Fig.1 Structural formula of D-allulose
目前,国内已有企业正积极申请D-阿洛酮糖进入新资源食品目录,预计2023年可以获得国家相关部门批复。在全球范围内,D-阿洛酮糖生产企业仍不多,主要集中在日本、美国、欧洲、韩国。我国D-阿洛酮糖生产处于起步阶段,生产规模较小,有待进一步发展,增加D-阿洛酮糖产能。
本文介绍了D-阿洛酮糖的生理功能及应用,综述了D-阿洛酮糖生物合成过程中关于生物酶、生物转化、分离纯化和结晶等的研究进展,针对当前D-阿洛酮糖生产过程中存在的某些瓶颈问题进行了讨论和分析,并提出可行的解决措施。
1 D-阿洛酮糖的生理功能及应用
1.1 低热量甜味剂,能够发生美拉德反应,可以改善食品的风味和色泽
D-阿洛酮糖具有与蔗糖相近的口感和甜度,但所含热量低。它能够提高食品的凝胶度,改善食品的风味,其可与食品中的蛋白质发生美拉德反应,不仅能够改善食品的色泽,还能提高食品的抗氧化性,延长食品的货架期[2,4]。
1.2 降血糖,抑制脂肪堆积,可用于研制治疗肥胖和糖尿病的药物
D-阿洛酮糖能够抑制肠道α-糖苷酶的活性,从而降低小肠对糖的吸收,抑制脂肪堆积,提高胰岛素的敏感性,降低血糖,在研制治疗肥胖和糖尿病药物方面具有重要的应用价值[5-7]。
1.3 促进谷胱甘肽的增量调节,具有神经保护功能
TAKATA等[8]研究发现,D-阿洛酮糖通过诱导细胞内谷胱甘肽上调而在神经退行性疾病的治疗中发挥潜在的神经保护作用。
1.4 抑制寄生虫生长,是一种潜在的驱虫剂
SATO等[9]研究发现,D-阿洛酮糖可能是通过干扰秀丽隐杆线虫(Caenorhabditiselegans)的消化、吸收或代谢,从而对秀丽隐杆线虫的运动、生长和生殖成熟产生抑制作用,成为一种潜在的驱虫剂。
1.5 生产其他稀有糖醇的前体
根据Izumoring策略[10],以D-阿洛酮糖为底物经异构酶催化可以得到D-阿洛糖,经氧化还原酶催化可以得到阿洛醇。D-阿洛糖和阿洛醇都是具有重要生理功能的稀有糖醇。
2 D-阿洛酮糖生物转化所涉及的生物酶
2.1 酮糖 3-差向异构酶
目前,D-阿洛酮糖的生物合成主要是通过酮糖 3-差向异构酶催化D-果糖得到。酮糖 3-差向异构酶主要包括2种:D-塔格糖 3-差向异构酶(D-tagatose 3-epimerase,DTE)和D-阿洛酮糖 3-差向异构酶(D-psicose 3-epimerase,DPE)。酮糖 3-差向异构酶具有高度保守的活性中心和具有相似特征的关键氨基酸残基,大多数DTE或DPE的最适反应温度区间为40~70 ℃,最适反应pH为7.5~9.0[11]。酶催化作用取决于每个亚基的分子排列,这些亚基暴露其活性位点,以实现有效的酶催化反应。相关动力学参数显示DPE对D-阿洛酮糖具有较高的底物亲和力和催化效率。金属离子在D-阿洛酮糖的生物转化中发挥重要作用,不同来源的DTE或DPE对金属离子的依赖性不同。
1993年,IZUMORI等[12]首次发现来自于PseudomonascichoriiST-24的D-酮糖 3-差向异构酶可以催化D-塔格糖和D-山梨糖、D-阿洛酮糖和D-果糖、D-木酮糖和D-核酮糖以及L-木酮糖和L-核酮糖之间的相互转化,特别是对D-塔格糖呈现出强特异性,因此将该酶命名为D-塔格糖 3-差向异构酶。2006年,KIM等[13]首次发现来自于Agrobacteriumtumefaciens的DPE对D-阿洛酮糖具有较高的Kcat和Kcat/Km,30 ℃反应,D-果糖和D-阿洛酮糖的平衡比为32∶68;50 ℃反应100 min,可以得到230 g/LD-阿洛酮糖(底物为700 g/LD-果糖),D-阿洛酮糖的转化率为32.9%。
近些年,已发现多种来自不同菌株的DTE和DPE,例如来自于Pseudomonascichorii[14]和Rhodobactersphaeroides[15]等的DTE;来自于Clostridiumsp.[1-19],Desmosporasp.8437[20],Doreasp.CAG317[21],Treponemaprimitia[22],Flavonifractorplautii[23],Arthrobacterglobiformis[24],Ruminococcussp.5_1_39BFAA[25],Halanaerobiumcongolense[26],Thermoclostridiumcaenicola[27]和Novibacillusthermophilus[28]等的DPE。不同微生物来源的DTE和DPE的酶学性质列于表1。

表1 不同微生物来源的DTE和DPE酶学性质Table 1 Enzymatic properties of DTE and DPE from different microbial sources

续表1
如表1所示,来自于Rhodobactersphaeroides的DTE最适反应温度较低,为40 ℃,而其他来源酶的最适温度分布在50~70 ℃;来自于Doreasp.CAG317的DPE最适pH偏酸性,为6.0;来自于Rhodobactersphaeroides的DTE最适pH最高,为9.0,其他DPE和DTE最适pH为7.0~8.0;大多数DTE和DPE在Co2+或Mn2+存在下表现出最高酶活性,除了Arthrobacterglobiformis和Halanaerobiumcongolense来源的DPE在Mg2+存在时具有最高酶活力;另外,来自于Doreasp.CAG317的DPE对D-阿洛酮糖具有很强的特异性。
2.2 NAD(P)-依赖型醇脱氢酶
WEN等[29]首次报道了来自于GluconobacterfrateuriiNBRC 3264 的 NAD(P)-依赖型醇脱氢酶[NAD(P)-dependent alcohol dehydrogenase,ADH]可催化阿洛醇生成D-阿洛酮糖。ADH的最适温度为50 ℃,pH为7.0~10.0 ADH的相对酶活性皆高于80%,具有较宽的pH域,Co2+能显著提高酶的催化活性。NAD(P)-依赖型醇脱氢酶(NCBI_ID:WP_099183078.1)由345个氨基酸组成,属于中链脱氢酶/还原酶,经SDS-PAGE分析得到酶分子质量约为36.5 kDa,是可溶性的酶。
3 D-阿洛酮糖的生物合成
D-阿洛酮糖的生物合成路径主要有3条(图2):(1)经DTE或DPE催化D-果糖得到D-阿洛酮糖;(2)经葡萄糖异构酶(glucose isomerase,GI)催化D-葡萄糖为D-果糖,D-果糖再经路径(1)得到D-阿洛酮糖;(3)经氧化还原酶催化阿洛醇得到D-阿洛酮糖。
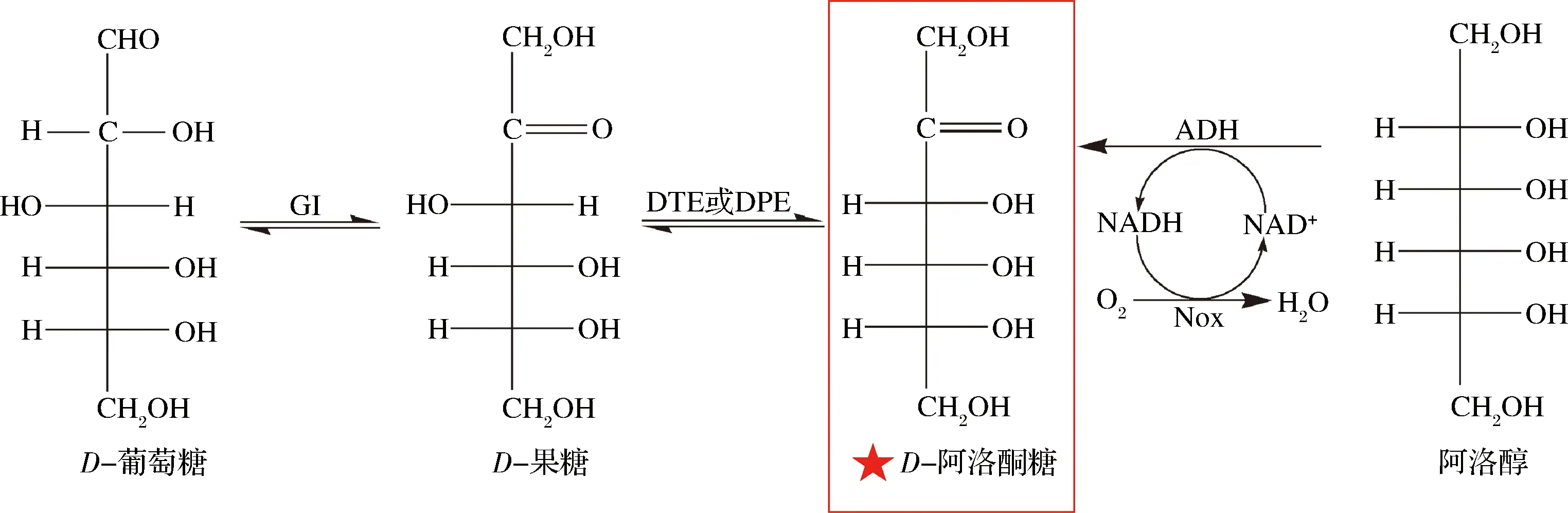
GI-葡萄糖异构酶;DTE-D-塔格糖 3-差向异构酶;DPE-D-阿洛酮糖 3-差向异构酶;ADH,NAD(P)-依赖型醇脱氢酶;Nox-NADH氧化酶图2 D-阿洛酮糖的生物合成Fig.2 Biosynthesis of D-allulose
3.1 利用微生物来源的DPE催化转化D-果糖为D-阿洛酮糖
目前,生物合成D-阿洛酮糖主要是由DPE催化D-果糖得到。DPE的异源表达系统常用的是大肠杆菌,因为其遗传背景清晰、培养简单且生长迅速。此外,食品级表达系统,例如酵母菌、枯草芽孢杆菌等,在企业生产中格外受欢迎。
PARK等[30]构建了异源表达来自于Agrobacteriumtumefaciens的DPE大肠杆菌(Escherichiacoli)工程菌株,该菌株催化D-果糖为D-阿洛酮糖的最适温度和pH分别为60 ℃和8.5,以700 g/LD-果糖为底物,反应40 min可以得到230 g/LD-阿洛酮糖,转化率为33%。PARK等[23]构建了异源表达来自于Flavonifractorplautii的DPE谷氨酸棒状杆菌(Corynebacteriumglutamicum)工程菌株,该菌株催化D-果糖为D-阿洛酮糖的最适温度和pH分别为65 ℃和7.0,以750 g/LD-果糖为底物,反应40 min可以得到235 g/LD-阿洛酮糖,转化率为31%。
LI等[25]构建了异源表达来自于菌Ruminococcussp.5_1_39BFAA的DPE短小芽孢杆菌(Bacilluspumilus)工程菌株,该工程菌株具有较高的DPE表达量,游离DPE经离子交换树脂固定,所得固定化DPE的最适温度为60 ℃,最适pH为9.0,当以500 g/LD-果糖为底物时,经固定化DPE催化4 h可得126.95 g/LD-阿洛酮糖,转化率为25%。YANG等[31]报道了1株马克斯克鲁维酵母(Kluyveromycesmarxianus)工程菌株,该菌株能够表达来自于Agrobacteriumtumefaciens的DPE,利用该工程菌株作为生物催化剂,以750 g/LD-果糖为底物,55 ℃反应12 h得到190 g/LD-阿洛酮糖,转化率达到25.3%。
ZHU等[26]构建了异源表达来自于Halanaerobiumcongolense的DPE枯草芽孢杆菌(Bacillussubtilis)工程菌株,以750 g/LD-果糖为底物,60 ℃静息细胞反应得到240 g/LD-阿洛酮糖,转化率达到32%。同时,ZHU等[26]通过理性设计获得具有组合突变体Y7H/C66L/I108A/R156C/K260C的DPE,温度为70 ℃时该突变酶的半衰期增加了5.2 h,Tm值增加了6.5 ℃。通过对关键位点进行突变,亚单元间引入了二硫化物桥梁,增加了界面交互,提高了DPE的热稳定性。利用异源表达具有组合突变体DPE的枯草芽孢杆菌工程菌株作为生物催化剂,同样地,以750 g/LD-果糖为底物,60 ℃反应可得到262.5 g/LD-阿洛酮糖,转化率高于32%,达到35%。
不同工程菌株催化D-果糖为D-阿洛酮糖的情况见表2,工程菌株催化D-果糖生产D-阿洛酮糖所得转化率介于25%~33%,当表达系统为大肠杆菌、谷氨酸棒状杆菌和枯草芽孢杆菌时,D-阿洛酮糖的转化率高于30%。相比酶催化方法,利用全细胞生物转化方法生产稀有糖颇受欢迎,因为它可以避免酶的提取、分离纯化及固定化,既可以省去繁琐的操作步骤,也能够降低生产成本。另外,对酶分子结构与功能进行深入研究,提高酶的底物特异性和热稳定性,对于实现稀有糖的高效绿色生产十分重要。

表2 催化D-果糖生产D-阿洛酮糖Table 2 Production of D-allulose by catalyzing D-fructose
3.2 利用微生物来源的GI和DPE催化转化D-葡萄糖为D-阿洛酮糖
MEN等[32]构建了1株大肠杆菌工程菌株,能够共表达来自于芽孢杆菌的GI酶和来自于Ruminococcussp.5_1_39BFAA的DPE,在65 ℃和pH 7.0的条件下进行静息细胞反应8 h,所得D-葡萄糖、D-果糖、D-阿洛酮糖的平衡比为3.0∶2.7∶1.0,D-阿洛酮糖的转化率为15%。
ZHANG等[33]在大肠杆菌表达系统中异源表达来自于Acidothermuscellulolyticus11B的GI和来自于Doreasp.CAG317的DPE,在65 ℃和pH 6.5的条件下进行静息细胞反应8 h,所得D-葡萄糖、D-果糖、D-阿洛酮糖的平衡比为2.3∶2.3∶1.0,D-阿洛酮糖的转化率为17.8%。
ZHAO等[34]在枯草芽胞杆菌表达系统中共表达来自于菌Bacillussp.的GI和来自于菌Doreasp.CAG317的DPE,在75 ℃和pH 6.5的条件下进行静息细胞反应3 h,所得D-葡萄糖、D-果糖、D-阿洛酮糖的平衡比为2.8∶2.9∶0.9,D-阿洛酮糖的转化率为13.6%。
不同工程菌株催化D-葡萄糖为D-阿洛酮糖的情况见表3,当以D-葡萄糖为底物时,D-阿洛酮糖的转化率低于20%,一方面原因是受热力学平衡的限制,另一方面多酶促反应不同的酶最适反应条件不同,很难充分发挥每一种酶的最高催化活性。因此,D-阿洛酮糖的工业化生产还需在生物催化剂性能提高方面做出更多努力。

表3 催化D-葡萄糖生产D-阿洛酮糖Table 3 Production of D-allulose by catalyzing D-glucose
3.3 利用微生物来源的ADH催化转化阿洛醇为D-阿洛酮糖
GULLAPALLI 等[35]利用EnterobacteraerogenesIK7静息细胞为生物催化剂,以30 g/L的阿洛醇为底物,在37 ℃、pH 11.0条件下反应24 h,最终所得D-阿洛酮糖的转化率为89.3%。POONPERM 等[36]利用BacilluspallidusY25 静息细胞为生物催化剂,以10 g/L的阿洛醇为底物,在55 ℃、pH 7.0条件下反应16 h,最终所得D-阿洛酮糖的转化率为98%。
WEN等[29]在大肠杆菌中异源表达来自于GluconobacterfrateuriiNBRC 3264 的 NAD(P)-依赖型醇脱氢酶,对该酶进行了纯化分析,并研究了其酶学性质,以0.05 mol/L阿洛醇为底物,在50 ℃、pH 7.0和添加0.001 mol/L Co2+的条件下反应4 h,最终所得D-阿洛酮糖的转化率为97%。另外,笔者利用异源表达来自于GluconobacterfrateuriiNBRC 3264 的 NAD(P)-依赖型醇脱氢酶的重组大肠杆菌作为生物催化剂,以10 g/L 和100 g/L阿洛醇为底物,在50 ℃、pH 10.0、细胞用量OD600为80的条件下反应最终所得D-阿洛酮糖的转化率分别为80.9%和48%。同时,笔者利用制备型色谱柱对反应液进行分离,得到阿洛酮糖溶液,通过高效液相色谱法分析、比旋光度测定和质谱分析证实由阿洛醇生产所得阿洛酮糖的构型为D型,且分子质量与已知D-阿洛酮糖分子质量一致。由表4可以看出,相比异构酶催化D-葡萄糖或D-果糖生产D-阿洛酮糖,以阿洛醇为底物生产D-阿洛酮糖具有更高的转化率。

表4 催化阿洛醇生产D-阿洛酮糖Table 4 Production of D-allulose by catalyzing allitol
3.4 D-阿洛酮糖生物转化方法分析
利用DTE或DPE催化D-果糖生产D-阿洛酮糖因受热力学平衡的限制,会导致D-阿洛酮糖的转化率较低(约为30%)。并且,由于D-阿洛酮糖与其异构体D-果糖性质极为相似,导致分离纯化困难,成为限制D-阿洛酮糖大规模工业化生产的关键因素。为了克服热力学平衡的限制,有研究人员在反应体系中添加硼酸,与糖形成配合物,由于硼酸对D-阿洛酮糖的结合亲和力远高于D-果糖,从而使反应平衡向生成D-阿洛酮糖的方向转变,可以大大提高D-阿洛酮糖转化率[37]。但是硼酸具有毒性且用量大,并且硼酸去除困难,因此难以实际应用。另外,将生物催化过程与产物分离相结合,也可以克服热力学平衡限制[38-40]。但是,该方法操作复杂且繁琐,实际应用比较困难。
虽然利用氧化还原酶催化阿洛醇生产D-阿洛酮糖可以获得较高的转化率,但是这种方法也具有一定的局限性。一方面,底物阿洛醇也是一种稀有糖醇。根据稀有糖制备策略,经合适的氧化还原酶催化可以实现阿洛醇和D-阿洛酮糖的相互转化。利用异构酶催化D-葡萄糖或D-果糖生产D-阿洛酮糖,转化率较低,需要经分离纯化后得到D-阿洛酮糖,由此带来的分离纯化成本较高;利用DPE、核糖醇脱氢酶和甲酸脱氢酶可以实现由D-果糖生产阿洛醇,阿洛醇转化率高,可以通过结晶的方式直接得到阿洛醇,不需要额外的分离纯化,得到的阿洛醇再经NAD(P)-依赖型醇脱氢酶催化可得D-阿洛酮糖,较高的转化率有望通过结晶的方式直接获得D-阿洛酮糖,此过程虽然繁琐,但是可以省去高昂的D-阿洛酮糖分离纯化步骤,当然也会增加生物催化剂培养成本和生物转化成本。虽然阿洛醇可以由廉价的底物D-葡萄糖或D-果糖催化生产得到,而且生产工艺相对成熟,但是目前国内外还未实现阿洛醇的工业化生产,导致底物来源受限。
另一方面,利用氧化还原酶催化阿洛醇生产D-阿洛酮糖过程中辅酶 NAD+的再生是其限速步骤。随着底物浓度的提高,辅酶供给不足,会限制D-阿洛酮糖的生产。因为辅酶NAD+价格昂贵,在反应体系中额外添加辅酶NAD+是不现实的。因此,解决氧化还原酶催化阿洛醇生产D-阿洛酮糖过程中辅酶再生的问题是难点和重点,也是决定该途径实用性的关键因素。稀有糖生物合成过程中常用的辅酶再生方法是酶偶联法。例如,将木糖醇脱氢酶与产水型 NADH 氧化酶偶联,应用于L-木酮糖的生产[41],其中产水型 NADH 氧化酶能够氧化 NADH 为 NAD+,为氧化还原反应提供辅酶NAD+[42]。因此,寻找一种能够与NAD(P)-依赖型醇脱氢酶偶联的,可用于再生NAD+的高效NADH氧化酶是催化阿洛醇生产D-阿洛酮糖的重要前提。
4 D-阿洛酮糖的分离和纯化
在工业化生产过程中,D-阿洛酮糖的分离和纯化相对较为困难。待分离糖液中主要包括酶或细胞催化剂、金属盐离子、色素和至少2种性质极为相似的单糖。其中,酶及细胞催化剂可以通过超滤或离心等方式较容易地去除;金属盐离子可以通过阴阳离心交换色谱去除;活性炭可以有效除去色素。然而,糖的分离是最困难的。特别地,生物合成D-阿洛酮糖的转化率为30%左右,最终糖液中D-果糖的浓度高于D-阿洛酮糖的浓度,而D-果糖和D-阿洛酮糖的结构及理化性质相似,很难分离,导致D-阿洛酮糖分离成本高,限制了D-阿洛酮糖的应用。目前,糖分离的方法主要有利用模拟移动床(simulated moving bed,SMB)技术分离和利用生物转化法分离。
4.1 SMB技术
SMB技术是一种基于色谱分离原理而建立的连续分离色谱技术。近些年,因其具有低能耗、高溶剂利用率、高生产率和高分离纯度等优点引起了人们的广泛关注。
WAGNER等[43]提出了一种SMB工艺的多目标优化方法,采用逆方法确定模型参数,并在实验室规模的SMB装置上进行实验,运行温度70 ℃,D-阿洛酮糖的产能为2.6 kg/(L·d),1 kg消耗27 L解吸剂,所得D-阿洛酮糖的纯度为97.6%。LI等[25]利用含有8根填充了钙离子树脂的色谱柱和5个压力泵组成的SMB设备分离D-阿洛酮糖,确定了SMB运行参数,最终得到D-阿洛酮糖的纯度为98.5%(图3)[25]。

1-D-果糖;2-D-阿洛酮糖a-模拟移动床示意图;b-模拟移动床设备图;c-D-阿洛酮糖高效液相色谱分析图图3 模拟移动床分离纯化D-阿洛酮糖的优化工艺Fig.3 Optimization of separation and purification of D-allulose by SMB
为了保证分离效果和延长树脂使用寿命,需要对待分离糖液进行预处理,包括去除杂质和金属离子。虽然SMB技术具有环境友好、无副产物生成等优点,但是SMB设备价格高昂、运行参数获取困难,限制了其在工业中的大规模应用。
4.2 生物转化法
生物转化法分离D-阿洛酮糖是指利用生物催化剂将剩余底物D-果糖转化为其它易于从糖液中分离的化合物。例如,LI等[40]利用固定化葡萄糖异构酶和氧化还原酶催化底物D-果糖为葡萄糖酸,然后利用阴离子交换树脂去除葡萄糖酸,最终D-阿洛酮糖纯度达到91.2%。SONG等[44]对十字花科蔬菜残渣进行生物加工,经过水解、异构酶转化和酵母菌发酵得到生物乙醇和D-阿洛酮糖,并通过渗透蒸发和阳离子交换色谱分离纯化得到生物乙醇和D-阿洛酮糖,其中D-阿洛酮糖的回收率约为86.2%(图4)。

图4 发酵法分离D-阿洛酮糖和D-葡萄糖[44]Fig.4 Separation of D-allulose and D-glucose by fermentation method[44]
YANG等[31]利用马克斯克鲁维酵母菌发酵未反应的D-果糖为乙醇,同样地乙醇经渗透挥发除去,最终D-阿洛酮糖的纯度高于90%(图5)[31]。

图5 马克斯克鲁维酵母菌循环催化示意图[31]Fig.5 Schematic diagram of cyclic catalysis of K.marxianus[31]
虽然生物转化法分离D-阿洛酮糖具有催化剂易得、操作方法简单、节省人力物力等优点,但是该方法降低了底物(D-果糖等)的利用率。另外,酵母菌发酵会产生代谢废物也存在杂菌污染的风险,并且产生的乙醇经浓缩后成为易燃品,具有一定危险性。总之,生物转化纯化方法在工业中未得到广泛应用。
5 D-阿洛酮糖的结晶
5.1 蒸发浓缩冷却结晶法
结晶是D-阿洛酮糖生产的最后一步。由于D-阿洛酮糖在高温下会变色并且溶解度高,因此常用的D-阿洛酮糖结晶方法主要是低温真空蒸发浓缩和冷却结晶法,即利用低温真空蒸发将D-阿洛酮糖溶液浓缩到一定的糖度,然后降温冷却进行结晶。这种方法对D-阿洛酮糖溶液的纯度具有很高要求,如果D-阿洛酮糖的纯度低、杂质较多则会影响D-阿洛酮糖的结晶。LI等[25]将SMB分离得到的糖液在60 ℃下真空蒸发浓缩到糖度为75%,加入0.3% 400目的D-阿洛酮糖晶种,72 h内降温到1 ℃,离心收集并50 ℃烘干得到D-阿洛酮糖晶体,经分析得到D-阿洛酮糖纯度为99.1%,D-阿洛酮糖的结晶率为82%。KIM等[45]在30~40 ℃时向D-阿洛酮糖浓缩液中加入D-阿洛酮糖晶种,最终结晶得到D-阿洛酮糖的纯度为98%。
5.2 有机溶剂冷却结晶法
因为D-阿洛酮糖在水中具有较高的溶解度,加之D-阿洛酮糖溶液浓缩后糖液黏度非常大,导致结晶困难。此时,可以考虑添加有机溶剂降低液体黏度,同时也可以降低糖的溶解度。常用的有机溶剂为无毒的无水乙醇。虽然D-阿洛酮糖可溶于无水乙醇,但是溶解度远低于在水中的溶解度,加入无水乙醇后不仅可以降低糖液黏度,还可以降低溶解度,有利于D-阿洛酮糖的结晶。佟毅等[46]发明了1种从乙醇溶液中结晶D-阿洛酮糖的方法,通过D-阿洛酮糖在乙醇溶液中降温结晶,一次结晶率达到50%以上,结晶晶型均一,易于固液分离,后期干燥简单易行。
虽然添加乙醇可以改善结晶性能,但由于乙醇是易燃品,存在安全隐患,并且使用过程中需要进行回收而且具有一定的损耗,增加成本,因此很多情况下尽量避免使用乙醇。这也进一步对D-阿洛酮糖的结晶工艺提出了更高的要求。
6 总结与展望
D-阿洛酮糖作为一种理想的蔗糖替代品,具有广阔的市场前景,对于提高人民健康水平、幸福指数和满足日益升级的消费市场需求具有重要意义。为了提高D-阿洛酮糖的生产效率,建议从以下几个方面进行重点研究:
(1)提高酶的催化活性和稳定性,降低最适pH。一直以来,提高酶的催化活性和稳定性是生物合成领域的研究重点和难点。催化活性高、耐热性好、半衰期长的酶是获得高产能和降低酶使用成本的必要条件。另外,大多数报道的DPE或DTE最适pH为碱性,容易发生美拉德反应,导致糖液颜色加深,产生副产物,对后期产品分离纯化不利。通过酶分子理性设计和定向进化的方式改造DPE或DTE以及筛选和挖掘新的具有应用潜力的酶是未来D-阿洛酮糖生物合成的重要任务。
(2)构建食品级宿主工程菌株,满足食品安全要求。大肠杆菌作为常用的表达系统因产生内毒素而不利于食品级D-阿洛酮糖的生产。虽然有酵母菌、枯草芽孢杆菌和谷氨酸棒状杆菌等食品级表达系统构建的工程菌株生产D-阿洛酮糖的报道,但是这些表达系统具有稳定性差、重复率低等缺点。因此,构建具有高稳定性、耐受高底物浓度、具有高转化率、高生产强度、高安全性的工程菌株是实现食品级D-阿洛酮糖生产的重要基础。
(3)构建简单、高效、低成本的D-阿洛酮糖工业化生产工艺。开发创新型工艺路线,提高转化效率,解决D-阿洛酮糖分离纯化问题,降低分离纯化工艺难度和成本,构建适合大规模工业化生产D-阿洛酮糖的简单、高效、创新性生产工艺路线。
(4)开发利用D-阿洛酮糖保健功能和生物医药应用潜能。D-阿洛酮糖的医药价值巨大,它既能抗龋齿、降血糖、抗氧化,又具有防止脂肪堆积、发挥神经保护作用和清除活性氧自由基等生理功能,可用于制备特医食品、保健品和合成药物。进一步开发D-阿洛酮糖的医药潜能,将会为糖尿病、肥胖症以及动脉粥样硬化等病患带去福音,改善他们的生活水平和质量。

