新型冠状病毒亚单位疫苗研制及其高效免疫增强剂的筛选
王祥锟 宋学宏 刘金龙 郭培红 庄晓峰 韦良孟 周凡 张树宇 高攀攀 魏凯
(1.山东农业大学动物科技学院,泰安 271018;2.苏州大学基础医学与生物科学学院,苏州 215123;3.山东贝瑞康生物科技有限公司,潍坊 261061;4.昆山贝瑞康生物科技有限公司,昆山215345)
2019年12月,科研人员从肺炎患者中发现了一种新型冠状病毒(2019-nCoV),并于2020年1月7日成功分离到毒株,该病毒引起的疾病被命名为“新型冠状病毒感染肺炎”,其完整的基因组也已经向全球公布[1]。系统发育进化树分析显示,2019-nCoV 是一种从未见过的乙型冠状病毒,将其列为可以感染人类的冠状病毒科中的第7 个成员[2-4]。尽管我国新冠肺炎疫情得到了有效控制,但是目前该病毒仍在世界上几十个国家范围内持续传播,严重威胁着我国乃至世界人民的生命安全,对世界经济发展造成了严重的影响。
全面防控新型冠状病毒的感染是当前工作的重中之重,而作为持续性防控的关键,疫苗、抗体和治疗药物的研发至关重要[5]。其中,疫苗的研发不仅具有重要的现实意义,更具有战略储备意义。目前2019-nCoV 的全基因组序列早已经公布,我们可以根据其基因序列预测其保护性抗原表位基因,用以研制基因工程亚单位疫苗。与传统的灭活疫苗及减毒疫苗相比,基因工程亚单位疫苗更高的抗原含量和纯度,且具有特异性强、无感染性、成本低、受限少等多方面的优越性,对于烈性传染病疫苗的研发是最佳的选择[6-7]。
为了提高亚单位疫苗的免疫效果,免疫增强剂的筛选和配比也十分重要。免疫增强剂是一种能够显著增强抗原的免疫原性,能够加快抗体产生的速度,提高免疫应答的物质。本团队前期研究发现一种从松树的花粉中提取的天然多糖,能够显著增强动物疫苗(如禽流感灭活疫苗、新城疫弱毒疫苗以及多种细菌或病毒的亚单位疫苗)的免疫效果[8-12]。鉴于其优良的免疫增强效果,松花粉多糖(PPPS)在人类疫苗和药物上开发应用具有较大的潜力。本团队前期开展了大量的工作,确切了PPPS作为佐剂的免疫增强功效[13],但是对2019-nCoV 疫苗的免疫增强效果评价还需要进行科学的验证。本研究成果旨在为新型冠状病毒肺炎疫苗的研发提供技术参考和数据支持。
1 材料与方法
1.1 材料
1.1.1 实验动物 本动物研究由山东农业大学动物Q8 保护利用委员会审定(许可证号:20010510);6周龄雌性SPF 级BALB/c 小鼠购自于济南朋悦实验动物中心。
1.1.2 试剂与设备 克隆用大肠杆菌DH5α 株、原核表达载体pET28a(+)、表达用大肠杆菌BL21 株均购自上海生工生物有限公司;克隆载体pMD19-T、限制性内切酶Ncol/HidIII和EcoR I/XhoI 购自TaKaRa 公司。2019-nCoV-Spike(2019-nCoV- S)的基因序列由南京金斯瑞生物科技有限公司合成;2019-nCoV-Nucleocapsid(2019-nCoV- N)的基因序列由广东省实验动物监测所的丛锋博士无偿提供。泰山松花粉,每年四月采集自泰山山区,过260 目筛,并进行超微粉碎破壁,黄芪粉购自于药店。羊抗鼠二抗购自美国earthox 公司;伴刀豆素球蛋白(ConA)、胃蛋白酶、小鼠抗鸡CD4-FITC 抗体和小鼠抗鸡CD8-RPE 抗体购自Amresco 公司;RPMI-1640 培养液和胎牛血清(FBS)购自Gibco 公司;小鼠外周血淋巴细胞分离液、BCA 蛋白浓度测定试剂盒、CCK-8 购自索莱宝公司;ELISA 试剂盒购自于上海朗顿生物科技公司。
高压细胞破碎仪(北京迪索);蛋白质高压制备色谱仪(法国SPOT);Milipore 超滤系统(Milipore,美国);流式细胞仪(美国BD 公司);酶标仪(美国Bio-Tek 公司)。
1.2 方法
1.2.1 pET28a(+)-2019-nCoV- S 和pET28a(+)-2019-nCoV- N 表达载体的构建 合成后的2019-nCoV- S 和2019-nCoV- N 基因序列,经TA 克隆法连接至pMD19-T 载体,送苏州金唯智生物科技有限公司测序鉴定。将测序鉴定正确的2019-nCoV- S和2019-nCoV- N 目的片段,分别经Ncol/HidIII和EcoR I/XhoI 双酶切后,插入表达载体pET28a(+)质粒,分别获得重组表达质粒pET28a(+)-2019-nCoV- S 和pET28a(+)-2019-nCoV- N。
1.2.2 2019-nCoV- S 和2019-nCoV- N 重组蛋白的诱导表达及纯化 将表达载体pET28a(+)-2019-nCoVS 和pET28a(+)-2019-nCoV- N 分别转化E.coliBL21 感受态细胞,在含卡那霉素的LB 液体培养基中振荡过夜培养,取培养物按1∶100 的比例接种到2YT 诱导培养基(卡那霉素终浓度100 μg/mL)中,37℃条件下,220 r/min 振荡培养2 h 后,在培养物中加入IPTG 至终浓度1 mmol/L,28℃,100 r/min培养4 h;离心收集细胞,进行12% SDS-PAGE 分析。
诱导表达的pET28a(+)-2019-nCoV- S/ BL21和pET28a(+)-2019-nCoV- N/ BL21 经高压细胞破碎仪破碎,4℃条件下12 000 r/min 离心10 min,收集沉淀;将沉淀分别用含7 mol/L 尿素的变性缓冲液充分溶解;4℃条件下12 000 r/min 离心20 min,得上清液;亲和层析柱进行纯化;用Milipore 超滤系统将洗脱液进行超滤浓缩和脱盐处理,直至洗脱液中不含咪唑及尿素;整个操作在4℃条件下进行。最终获得纯化2019-nCoV- S 和2019-nCoV- N 重组蛋白,采用BCA 蛋白浓度测定试剂盒测定蛋白浓度。
1.2.3 PPPS 的制备 按照Wei 等[11]优化的步骤进行PPPS 的提取。将破壁的松花粉用滤纸分装成数包(50 g/包)并放入索氏提取器中,用乙醚抽提脂肪。将去除脂肪的花粉与去离子水混合(1∶15)放置于水浴锅中,使其在85℃浸提8 h。将反应后的松花粉悬液冷却后放置于4℃冰箱中沉淀过夜,弃去沉淀,用滤网过滤上清,再离心上清(10 000 r/min,10 min),用旋转蒸发仪加压浓缩。将浓缩液用Sevag试剂除蛋白,重复2 次,最后用4 倍体积的无水乙醇沉淀多糖,冷冻干燥后得到PPPS。黄芪粉从药店购买,遵循相同的方法提取黄芪多糖(APS),跳过除脂步骤。
1.2.4 疫苗的制备 重组表达2019-nCoV- S 和2019-nCoV- N 蛋白分别与不同浓度的PPPS 按照相应的体积比混合后加入到组织捣碎机进行混匀,多糖终浓度分别为200、400、800 mg/mL。本试验免疫程序计划分3 次免疫,每次免疫时各组疫苗中多糖含量不变,重组蛋白含量梯度增加,分别为50、100 和150 μg/mL。对照组按照终浓度400 mg/mL 的APS 剂量分别与2019-nCoV- S 和2019-nCoV- N 蛋白调配后用组织捣碎机进行混合均匀,3 次免疫的蛋白浓度也为50、100 和150 μg/mL。
1.2.5 免疫程序 将100 只小鼠分为两大组:A 组为2019-nCov-S 组,然后再分为5 个小组(I-V 组),每个小组10 只小鼠。I 组:低剂量松花粉多糖组(LPPPS 组)免疫200 mg/mL PPPS-2019-nCoV-S 疫苗,II 组:中剂量松花粉多糖组(MPPPS 组)免疫400 mg/mL PPPS-2019-nCoV-S 疫苗,III 组:高剂量松花粉多糖组(HPPPS 组)免疫800 mg/mL PPPS-2019-nCoV-S 疫苗,IV 组免疫APS-2019-nCoV- S 疫苗,V 组仅免疫纯化的加PBS 的2019-nCoV- S 疫苗。B 组为2019-nCoV- N 组,5 个小组分组设置与2019-nCoV- S 组相同。各组分别免疫3 次,每次间隔两周;第一次免疫2019-nCoV-S 和2019-nCoV-N 蛋白含量为50 μg/mL,第二次免疫蛋白剂量为100 μg/mL,第三次蛋白剂量为150 μg/mL。免疫方式均为腿部肌肉注射。在第一次免疫后的3、7、14、21、28、35 d采集血液,分离血清,检测相应指标。
1.2.6 PPPS 佐剂2019-nCoV 亚单位疫苗免疫后特异性IgG 抗体的测定 用间接ELISA 试验检测免疫小鼠血清中2019-nCoV- S 和2019-nCoV- N 特异性IgG的抗体滴度,步骤如下:包被:每孔分别100 μL 0.5 μg/mL 2019-nCoV- S 和2019-nCoV- N 蛋白,4℃包被12 h 后PBST 清洗3 次,间隔5 min。封闭:每孔加入200 μL 封闭液(含1% BSA 的PBST),37℃水浴2 h,PBST 清洗3 次。一抗孵育:使用2019-nCoV- S 和2019-nCoV- N 多抗小鼠血清作为一抗,使用封闭液稀释免疫疫苗后的各组血清,每孔100 μL,37℃水浴2 h,PBST 清洗5 次;二抗孵育:每孔加入100 μL 羊抗鼠酶标二抗(IgG,1∶10 000 稀释),37℃水浴1 h,PBST 清洗6 次;显色:每孔加入100 μL TMB 显色液,37℃水浴避光显色5 min;终止:每孔加入50 μL 终止液(2 mol/L H2SO4);读数:样品吸光度(OD490nm)使用酶标仪进行检测。
1.2.7 PPPS 佐剂2019-nCoV 亚单位疫苗免疫后对小鼠体内细胞免疫的影响
1.2.7.1 血清IL-2 含量的检测 血清IL-2 含量的检测按照小鼠IL-2 检测试剂盒说明书进行操作。
1.2.7.2 淋巴细胞转化率测定 小鼠尾根静脉采集肝素钠抗凝血0.5 mL,加入等体积的全血稀释液。取无菌的2 mL 离心管,向其中加入1 mL 淋巴细胞分离液,用巴氏德吸管将血液稀释液平铺到分离液液面上方,保持两液界面清晰。将离心管放置于水平转子离心机中,3 000 r/min,25 min。离心后,用微量加样器吸取中间层乳白色雾状的淋巴细胞于无菌的10 mL 离心管中,加入5 mL 细胞洗涤液,1 500 r/min,10 min。倾斜缓慢倒掉上清,加入5 mL PBS 缓冲液,1 500 r/min,10 min,此过程重复2 次。倒掉上清,用含10% FBS、1%青链霉素的RPMI-1640 培养液重悬细胞。取96 孔细胞培养板,每孔加入100 μL 细胞悬液,每组6 孔,周围加入RPMI-1640 边缘对照孔。6 孔中3 孔加入25 μL ConA,并放置37℃、5%CO2细胞培养箱中培养36-48 h,到时向每孔中加入10 μL CCK-8,继续放置于细胞培养箱孵育2-4 h,通过酶标仪测定其在490 nm 处的吸光值。根据公式计算淋巴细胞转换率:LTR=(ConA刺激OD490nm均值-无ConA 刺激OD490nm均值)/对照组OD490nm均值。
1.2.8 PPPS 佐剂2019-nCoV 亚单位疫苗免疫后外周血CD4+T 细胞、CD8+T 细胞的测定 采集新鲜肝素钠抗凝血1 mL,加入等体积的全血稀释液得到2 mL的稀释血液。小心的将上述稀释血液加到2 mL 淋巴细胞分离液的液面上,要求同1.2.7.2 步骤。取乳白色雾状的淋巴细胞层,取2 mL 分别置于两个管中。加PBS 至2 mL 刻度,1 500 r/min,10 min。弃上清,重复两次。500 μL PBS 重悬沉淀,取50 μL。每样加20 μL 染料(小鼠抗鸡CD4-FITC 和小鼠抗鸡CD8-RPE 各10 μL)。4℃避光孵育20 min,上样,用流式细胞仪测定。
2 结果
2.1 2019-nCoV- S和2019-nCoV- N重组蛋白的诱导表达
图1-A 显示,构建成功的pET28a(+)-2019-nCoVS/BL21 克隆株经诱导表达后,蛋白电泳图在53 kD与70 kD 之间显示出较粗的条带(泳道2 和泳道4),与预测大小55.68 kD 吻合;pET28a(+)-2019-nCoVN/BL21 经诱导表达的蛋白在40-53 kD 显示出较粗的条带(泳道6 和泳道8),与预测大小45.64 kD吻合。
图1-B 和图1-C 显示,经Ni-NTA 亲和层析柱纯化后的pET28a(+)-2019-nCoV-S/BL21 和pET28a(+)-2019-nCoV-N/BL21 重组蛋白纯度可达90%以上。

图1 2019-nCoV- S 和2019-nCoV- N 重组蛋白的诱导表达及纯化Fig.1 Induced expressions and purifications of recombinant protein 2019-nCoV-S and 2019-nCoV-N
纯化蛋白浓度测定:按照BCA 蛋白浓度测定试剂盒说明书测定,以吸光度OD562nm为横坐标,以标准蛋白BSA 含量为纵坐标绘制标准曲线,见图2。经计算,Ni-NTA 纯化后的2019-nCoV- S 重组蛋白浓度为1.12 mg/mL,共得到重组蛋白17.2 mg;2019-nCoV- N 重组蛋白浓度为0.66 mg/mL,共得到重组蛋白10 mg。

图2 BSA 蛋白浓度测定标准曲线Fig.2 BSA protein concentration determination standard curve
2.2 PPPS佐剂2019-nCoV亚单位疫苗免疫后对特异性IgG抗体的测定结果
制备的2019-nCoV- S 和2019-nCoV- N 亚单位疫苗免疫后小鼠血清中抗体效价的变化示于图3。单纯的两种重组蛋白(PBS 组)免疫后抗体效价从14 d 开始升高,但总体上升缓慢,而LPPPS 组、MPPPS 组、HPPPS 组的抗体滴度均快速升高,显著高于PBS 组(P< 0.05);在免疫后14-35 d,MPPPS组的抗体效价极显著高于PBS 组(P< 0.01);在第35 天,所有组的抗体效价达到峰值。其中,MPPPS组的抗体效价从14-35 d 均为最高,表明400 mg/mL PPPS 作为佐剂增强了2019-nCoV- S 和2019-nCoV- N诱导的IgG 抗体应答。
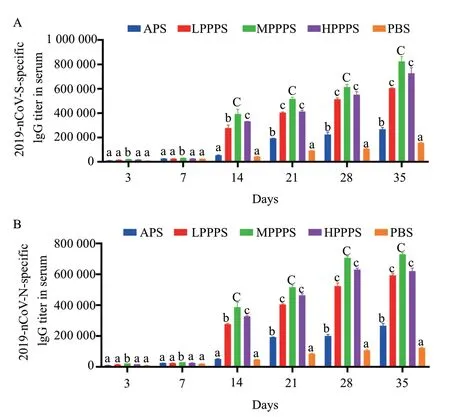
图3 疫苗免疫后特异性IgG 抗体的测定结果Fig.3 Determination of specific IgG antibody after immunization with vaccine
2.3 PPPS佐剂2019-nCoV亚单位疫苗免疫后血清IL-2检测结果
如图4所示,于第一次免疫后的第28-35 天,细胞因子IL-2 的变化趋势基本与抗体变化保持规律一致,其中MPPPS 组的IL-2 含量显著(P< 0.05)高于APS 组、LPPPS 组、HPPPS 组和PBS 组,说明400 mg/mL 的PPPS 有效地提高了两种亚单位疫苗免疫后小鼠的血清中IL-2 含量。

图4 疫苗免疫后血清中IL-2 的含量变化Fig.4 Changes of IL-2 content in serum after immunization with vaccine
2.4 PPPS佐剂2019-nCoV亚单位疫苗免疫后淋巴细胞转换率测定结果
各组淋巴细胞转换率变化结果见图5。淋巴细胞转换率反映了小鼠细胞免疫应答水平。在第一次疫苗接种3-35 d 后,无论是2019-nCoV- S 还是2019-nCoV- N 亚单位疫苗,MPPPS 佐剂组T 淋巴细胞转换率均高于APS 组、LPPPS 组、HPPPS 组和PBS 组。第28 天,T 淋巴细胞转换率所有组达到高峰值。结果表明,400 mg/mL 的PPPS 有效地提高了两种亚单位疫苗免疫后小鼠的T 淋巴细胞转换率。
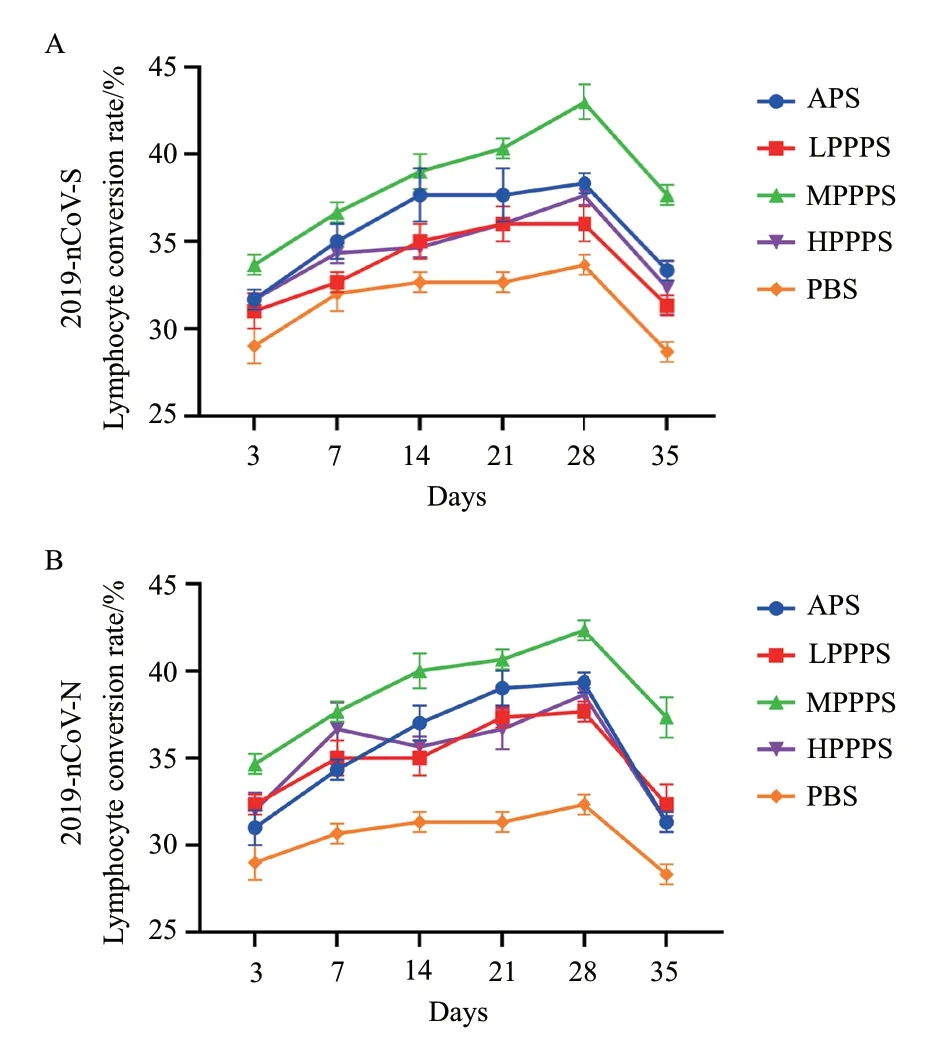
图5 疫苗免疫后外周血淋巴细胞转换率的变化Fig.5 Changes of peripheral blood lymphocyte conversion rate after immunization with vaccine
2.5 PPPS佐剂2019-nCoV亚单位疫苗免疫后CD4+T细胞和CD8+T细胞的测定结果
各免疫组外周血CD4+T 细胞和CD8+T 细胞含量变化示于图6。无论是2019-nCoV- S 还是2019-nCoV- N 亚单位疫苗免疫,MPPPS 佐剂组外周血CD4+T 细胞和CD8+T 细胞含量高于APS 组、LPPPS组、HPPPS 组和PBS 组。在免疫后3-28 d,外周血CD4+T 细胞和CD8+T 细胞含量逐渐升高,并在第28 天达到峰值,28-35 d 有所下降。以上结果表明,400 mg/mL 的PPPS 有效地提高了两种亚单位疫苗免疫后小鼠的外周血CD4+T 细胞和CD8+T 细胞含量。
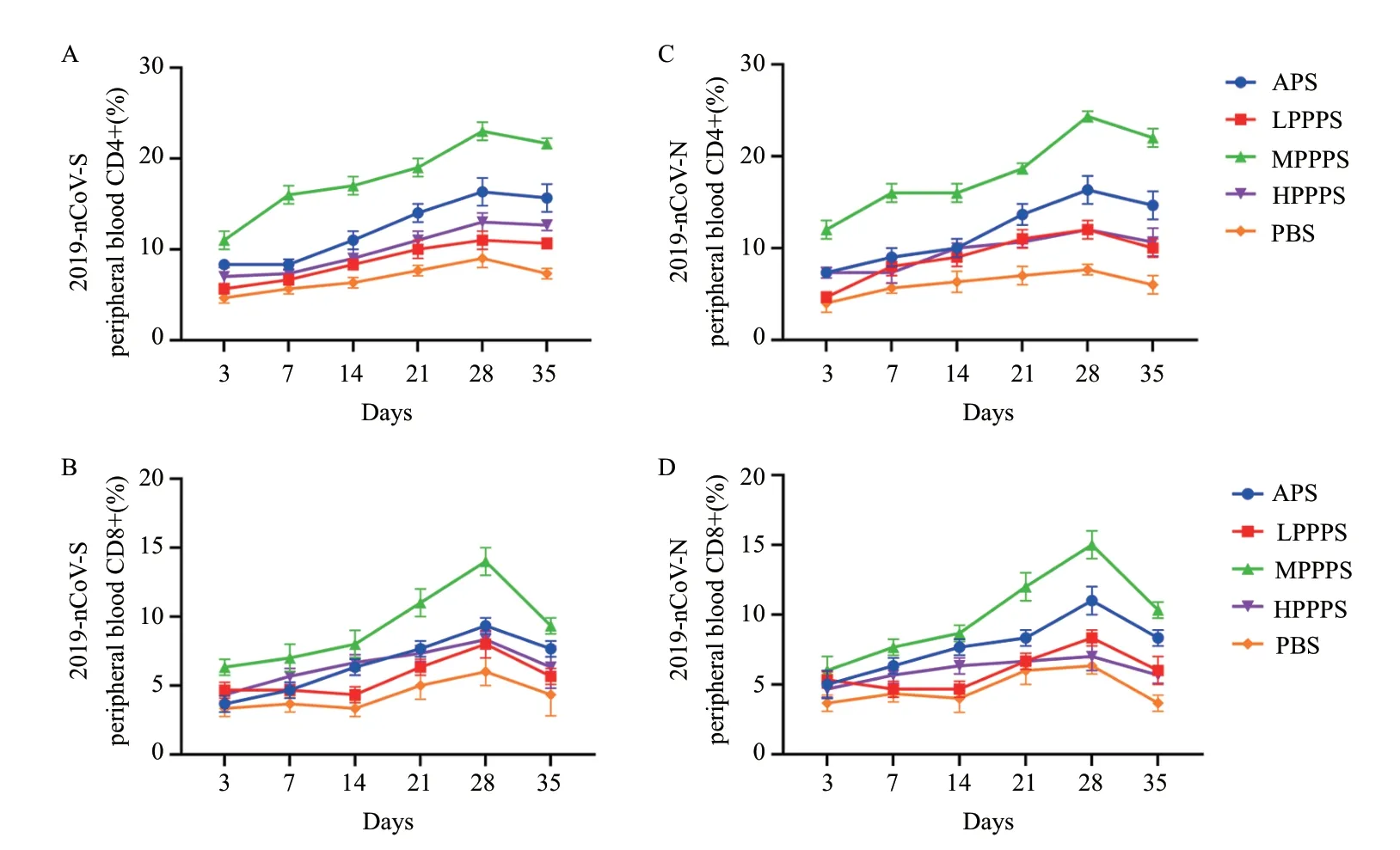
图6 疫苗免疫后外周血CD4+T 和CD8+T 细胞含量的测定结果Fig.6 Determination of CD4+T and CD8+T cell content in peripheral blood after immunization with vaccine
3 讨论
2019年底全球爆发新型冠状病毒肺炎疫情,世界卫生组织迅速将其定为国际关注的突发公共卫生事件[14],全球疫情防控压力巨大,因此迫切需要新的预防与治疗方法,以有效遏制2019-nCoV 的快速传播。亚单位疫苗是以合成肽或重组蛋白为基础制备的疫苗,与灭活或减毒病毒和一些活病毒载体疫苗不同,这种疫苗包含了高浓度的病毒保护性抗原片段,但不包括传染性病毒粒子,既能够产生高度特异性的抗体,又消除了灭活不完全、毒力恢复或前期免疫抗体存在干扰的风险[15-16]。亚单位疫苗通常是安全的,不会引起潜在的负面免疫反应,然而,这些亚单位疫苗可能会面临一些重要的挑战,主要是因为它们的免疫原性相对较低,必须与适当的佐剂配合,因此高效免疫佐剂的筛选十分重要。
多糖是一种高分子量的碳水化合物,代表着一类主要来源于微生物、动物或植物的生物活性分子,具有多种生理功能,增强和激活巨噬细胞的免疫反应,促进细胞因子和趋化因子的分泌[17]。作为疫苗佐剂,多糖不仅可以促进抗原特异性免疫系统,还可以增强机体的天然免疫功能[18-19]。许多植物多糖,特别是从中草药中提取的多糖,已经成为取代传统佐剂的极佳候选物质,因为植物多糖可以刺激免疫系统从而增强免疫力,比细菌多糖和合成化合物毒性小,副作用少[20-21]。目前,商品化的APS已被添加到口蹄疫病毒、传染性法氏囊病毒、禽流感病毒等疫苗中,且显示出良好的佐剂能力[22-23]。本实验室一直从事PPPS 佐剂的研究,前期研究表明,PPPS 对多种动物疫苗具有显著的免疫增强作用[24-26],但是对于新型冠状病毒疫苗的效果尚未验证。本研究结果显示,PPPS 不论作为2019-nCoV-S还是2019-nCoV- N 重组蛋白的佐剂,均能够显著提高二者诱导的免疫应答反应,且效果优于同剂量的APS。尽管PPPS 的提取总成本高于APS,但是人用疫苗优先考虑效果,因此PPPS 具有成为新型疫苗佐剂的较大潜力。
接种疫苗后诱导产生的抗体效价高低是评价疫苗保护效果的主要标准。从本研究结果来看,APS佐剂虽然可以促进机体对2019-nCoV 的免疫反应,但同剂量的PPPS 效果优于APS,并且400 mg/mL 剂量的PPPS 能够刺激机体产生更高效价的抗体,因此,PPPS 佐剂会产生更强的保护效果。IL-2 是效应淋巴细胞增殖或分化和调节性T 细胞增殖或分化所必需的多效性细胞因子,有抗感染活性[27]。相比APS 佐剂和PBS 对照组,400 mg/mL 剂量的PPPS 显著提高了血清中IL-2 的含量,因此PPPS 佐剂具有更强的抗感染促进作用。T 淋巴细胞是获得性免疫的主要效应细胞,广泛参与从信号识别、抗原提呈,到炎症因子的释放、其他免疫细胞的激活和趋化等多个免疫反应过程[28]。淋巴细胞体外转化率和T 细胞亚群(CD4+、CD8+)数量是反映T 细胞免疫功能的重要指标[29]。在本研究中,400 mg/mL 剂量的PPPS 能够显著提高机体的淋巴细胞转化率和CD4+、CD8+T 细胞含量,且效果均优于其他各组,表明PPPS 能够显著提高机体的细胞免疫功能,这一点对于疫苗佐剂来讲非常重要,这是因为很多疫苗良好的免疫保护需要较强的细胞免疫,尤其是杀伤性T细胞(CD8+T 细胞)介导来实现。
综上所述,本试验重组表达了两种2019-nCoV抗原蛋白用于制作亚单位疫苗,并评价了不同浓度PPPS对两种2019-nCoV亚单位疫苗的免疫增强作用。通过测定各组小鼠的相关免疫指标,证明了PPPS能够显著提高两种亚单位疫苗的免疫效果,改善机体的免疫功能。因此,PPPS 的优良特性使其可以作为2019-nCoV 亚单位疫苗的候选佐剂,从而为新型2019-nCoV 亚单位疫苗的研发提供理论和技术支持。
4 结论
本试验成功构建了重组表达质粒pET28a(+)-2019-nCoV-S 和pET28a(+)-2019-nCoV- N,转入E.coliBL21 之后诱导表达出了大小分别约为55.68 kD 和45.64 kD 的重组蛋白2019-nCoV- S 和2019-nCoV- N。分别制备了含不同浓度PPPS 佐剂的重组蛋白2019-nCoV- S 和2019-nCoV- N 亚单位疫苗,结果显示,疫苗免疫小鼠后TPPS 佐剂可以提高抗体效价、血清中IL-2 含量、外周血CD4+T 与CD8+T含量以及T 淋巴细胞转化率,证明PPPS 对疫苗的免疫效果有显著的提升效果,可以作为2019-nCoV亚单位疫苗佐剂的候选。

