苗药五藤膏外敷对膝骨关节炎兔软骨SMAD1及血清Jagged1、Jagged2表达的影响
韩珊 周静 马武开 姚血明 申海艳 陈琳 王颜君
(1贵州中医药大学,贵州 贵阳 550002;2贵州省骨科医院;3贵州中医药大学第二附属医院风湿免疫科)
膝骨关节炎(KOA)又称膝退行性骨关节病,好发于中老年人群,尤以女性常见,以关节软骨(变性、退化)、关节囊增厚、软骨下骨发生病理改变(骨质增生、滑膜增生等)及关节周围肌肉损伤等为主要特征,临床主要表现为不同程度的关节疼痛、肿胀、畸形及活动受限等〔1〕。目前临床治疗KOA的方式有药物治疗、物理治疗、手术治疗等,主要以缓解症状为主。苗药五藤膏作为KOA的外治经验方,具有祛风通络、活血止痛等作用。经前期临床研究显示,苗药五藤膏贴敷疗效确切,能够有效缓解KOA患者关节疼痛、肿胀等临床症状〔2~5〕。KOA发病机制较为复杂,有研究发现骨形态发生蛋白(BMP)、Notch信号通路在调控KOA关节软骨细胞增殖、分化,维持软骨细胞表型及软骨基质代谢平衡等方面发挥着重要作用,其中,SMAD1作为BMP信号通路中BMP2受体的直接下游分子,在BMP2信号转导中起中心作用;而Jagged1、Jagged2作为激活Notch信号的关键配体,可以加速早期软骨细胞分化,在调控软骨方面起着重要作用〔6~9〕。因此,我们在前期临床和实验研究的基础上进一步验证苗药五藤膏治疗KOA是否与其通过调节BMP、Notch信号通路中相关蛋白及基因的表达水平,从而减慢KOA关节软骨退变。为验证该假设,本研究通过建立兔KOA模型,从细胞及分子水平探讨不同剂量苗药五藤膏于相应时间内外敷干预对KOA模型兔关节软骨SMAD1及血清Jagged1、 Jagged2表达水平的影响。
1 材料与方法
1.1实验动物 2019年3~6月选取同一批4~5月龄健康新西兰大白兔72只,体重(2±0.5)kg,由贵州中医药大学动物实验中心提供,合格证号:SCXK(黔)2018-00012。分笼饲养,实验前均进行1 w的适应期喂养,在实验过程中遵照实验动物伦理要求。
1.2实验药物 氟比洛芬巴布膏,进口药品注册证号:H20140693;生产批号:602243-01;生产厂家:日本三笠制药株式社会;规格:40 mg/贴。苗药五藤膏(黑骨藤30 g、大血藤30 g、小花青风藤30 g、香血藤30 g和络石藤30 g打成细粉与凡士林按1∶1的比例混合制成),由贵州中医药大学第二附属医院药剂科提供(黔药制字Z20120072),使用前将调制好的苗药五藤膏均匀涂于纱布上做成贴膏。
1.3主要仪器和试剂 微量移液器(Eppendorf)、磁力搅拌器(T8-1,江苏省金坛市中大仪器厂)、离心机(HI650,湖南湘仪实验室仪器开发有限公司)、酶标仪(mμlISKANMK3,Thermo)、电热恒温培养箱(ICV-450,日本ASONE)、FlexStation 3多功能酶标仪(Flexstation3,Molecular Devices);二喹啉甲酸(BCA)蛋白浓度测定试剂盒(碧云天,货号:P0010)、兔多抗SMAD1(52 kD,avivasysbio,货号:ARP38692-T100)、Jagged1蛋白测定试剂盒(优尔生,货号:SEB807Hu)、Jagged2蛋白测定试剂盒(优尔生,货号:SEL636Hu)、磷酸酶抑制剂(碧云天,货号:S1873)、辣根过氧化物酶(HRP)标记羊抗兔二抗(武汉博士德生物工程有限公司,货号:BA1054)、Trise-Base(Biofroxx,货号:1115GR500)、蛋白marker(10~250 kD,海利克思,货号:P12103-2)。
1.4方法
1.4.1实验分组与KOA兔模型的制备 采用随机数字表法将72只家兔分为空白组、模型组、巴布膏组、苗药五藤膏高剂量组、苗药五藤膏中剂量组、苗药五藤膏低剂量组各12只。除空白组外,其余五组采用经典的木瓜蛋白酶膝关节内注射方法建立KOA兔模型〔10〕:将4%的木瓜蛋白酶生理盐水溶液0.3 ml分别于第1、4、7 天注入兔右膝关节,第7天注射完毕后,不再进行任何干预。正常饲养4 w后,通过X线片、组织切片观察兔右膝关节,建立稳定的KOA兔模型。
1.4.2给药方法 从造模后第5周开始给药,具体方法:空白组、模型组正常饲养4 w,每日用无菌纱布包扎固定右膝关节4 h,不做任何药物干预;巴布膏组给予氟比洛芬巴布膏外敷,将巴布膏(约2 g)剪至4 cm×3 cm大小直接贴敷于兔右膝关节,关节固定4 h,每日给药1次,干预时间为4 w;苗药五藤膏低、中、高剂量组分别给予低(约1 g)、中(约2 g)、高(约4 g)剂量的苗药五藤膏外敷,将苗药五藤膏(贵州中医药大学第二附属医院制剂室研制)均匀涂抹于纱布上制成贴膏直接贴敷于兔右膝关节前方,关节固定4 h,每日给药1次,干预时间为4 w,其中,高剂量组贴膏面积大小为8 cm×3 cm、中剂量组膏贴面积大小为4 cm×3 cm、低剂量组膏贴面积大小为2 cm×3 cm,各治疗组家兔药物使用剂量均为人体等效剂量〔11〕。为了防止药物挣脱,各治疗组均用绷带包扎固定。给药4 w后采用空气栓塞法将其全部处死,剥除右侧膝关节皮肤,取右侧股骨内髁顶点钙化层以上软骨进行各项指标检测。
1.4.3Western印迹检测蛋白表达 按照说明书要求,首先完成蛋白样品的制备,即:在EP管中加入剪碎的软骨组织、钢珠及裂解液〔含2 μl苯甲基磺酰氟(PMSF)、2 μl磷酸酶抑制剂〕进行匀浆、裂解、离心,将蛋白样品〔经磷酸盐缓冲液(PBS)稀释20倍〕、标准品〔经牛血清白蛋白(BSA)标准品稀释〕及BCA试剂盒中的混合液(A液和B液按50∶1比例混合)依次加入96孔板内,37℃避光孵育后,用酶标仪(DG-3022A)测定OD值(OD568),根据OD值和标准蛋白浓度计算直线回归方程及蛋白样品浓度,最后用BandScan分析胶片灰度值。
1.4.4酶联免疫吸附试验(ELISA)检测 根据说明书要求,首先完成血清样本的加样处理,即:设置空白孔、标准孔、待测样品孔,依次向各孔中加入样品稀释液、标准品、待测样品(均100 μl),37℃酶标板覆膜孵育1 h,用酶标仪测量各孔OD值。根据标准品的浓度和OD值计算标准曲线的直线回归方程及样品浓度。
1.4.5关节软骨病理学观察 取各组兔右侧股骨内髁顶点钙化层以上软骨制作标本,经中性甲醛固定,硝酸脱钙,常规石蜡包埋,切片,苏木素-伊红(HE)染色,观察各组病理标本形态变化。软骨病理改变情况参考Mankin评分〔12〕进行评分。
1.5统计学方法 采用SPSS22.0软件进行LSD-t检验、方差分析。
2 结 果
2.1病理结果
2.1.1关节软骨病理图片观察 光镜下可见空白组关节面光滑,未见明显肿胀、增生及滑膜充血,软骨无退行性改变,软骨细胞未变性、萎缩,分布均匀;模型组关节面粗糙不平整,明显肿胀、增生及滑膜充血,软骨重度退行性改变,软骨细胞重度变性、萎缩,分布紊乱;巴布膏组关节面不平整,伴有关节肿胀和滑膜充血,软骨轻度退行性改变,软骨细胞轻度变性、萎缩,分布轻度紊乱;苗药五藤膏低、中、高剂量组关节表面较光滑,轻度关节肿胀和滑膜充血,软骨退变程度与剂量呈反比,即剂量越低越接近模型组,剂量越高越接近空白组,见图1。
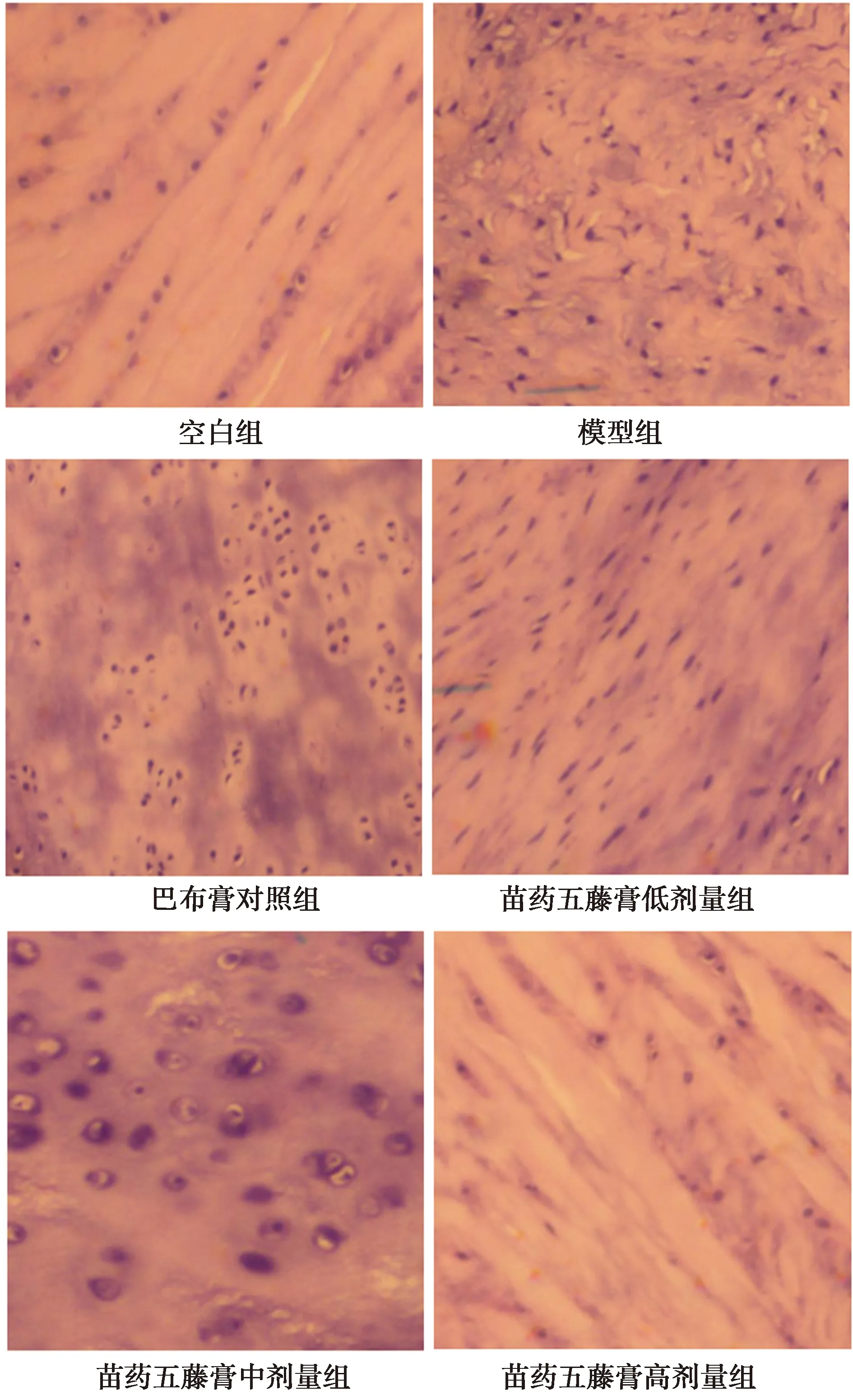
图1 各组病理结果(HE染色,×200)
2.1.2Mankin评分结果 与空白组相比,模型组及各治疗组Mankin评分明显升高(P<0.05);与模型组相比,各治疗组Mankin评分均明显降低(P<0.05);治疗组组内比较,Mankin评分从高到低依次分别为苗药五藤膏低、中剂量组、巴布膏组及苗药五藤膏高剂量组,差异有统计学意义(P<0.05),见表1。
2.2各组SMAD1蛋白表达水平的比较 与空白组相比,模型组及各治疗组SMAD1蛋白表达水平均明显降低(P<0.05);与模型组相比,苗药五藤膏中、高剂量组及巴布膏组SMAD1蛋白表达水平均明显升高(P<0.05);巴布膏组SMAD1蛋白表达水平均明显高于苗药五藤膏低、中剂量组(P<0.05),见表1、图2。
2.3各组血清中Jagged1、Jagged2表达水平比较 与空白组相比,模型组及苗药五藤膏各剂量组Jagged1、Jagged2表达水平均明显升高(均P<0.05);与模型组相比,苗药五藤膏各剂量组、巴布膏组Jagged1、Jagged2表达水平均明显降低(P<0.05);与巴布膏组相比,苗药五藤膏各剂量组Jagged1、Jagged2表达均明显升高(P<0.05);与苗药五藤膏低剂量组比较,苗药五藤膏中、高剂量组Jagged1、Jagged2表达水平明显降低(均P<0.05),见表1。

表1 各组Mankin评分、兔软骨SMAD1蛋白及血清Jagged1、Jagged2表达水平比较
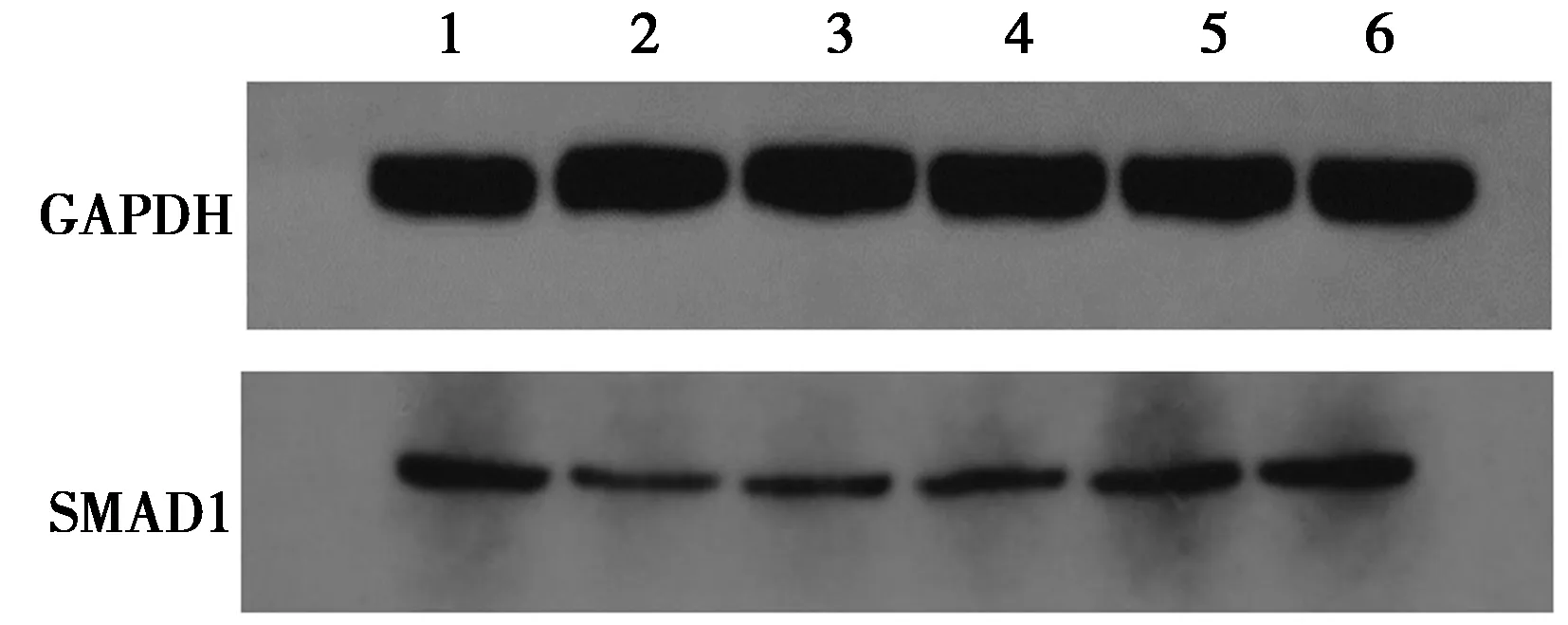
1~6:空白组、模型组、苗药五藤膏低剂量组、苗药五藤膏中剂量组、苗药五藤膏高剂量组、巴布膏组图2 干预4 w后各组关节软骨组织中SMAD1蛋白表达
3 讨 论
膝关节软骨降解、骨赘形成及软骨损伤等是形成KOA的主要原因,其中软骨降解主要是由于蛋白裂解酶(基质金属蛋白酶、蛋白聚糖酶等)活性的提高,从而导致Ⅱ型胶原蛋白被降解〔13〕;骨赘则是由肥大的软骨细胞引起软骨局部钙化所导致〔14〕。BMP、Notch信号通路与KOA的发生发展有密切的关系〔15,16〕。BMP作为转化生长因子(TGF)-β超家族中的一员,是一种多功能生长因子,参与了软骨细胞的形成、增殖,正常稳态的维持,骨化阶段的终末分化、凋亡及退行性改变等,在软骨细胞信号网络调控中发挥着重要作用,BMP在软骨损伤后可通过促进软骨细胞的增殖和Ⅱ型胶原表达来促进软骨修复与软骨细胞表型稳态的维持〔17~19〕。SMAD1在BMP信号通路中起着转导中心的作用〔20〕,即当BMP配体与BMPⅠ型受体集合后,BMPⅡ型受体也集合上去,使BMPⅠ型受体磷酸化,进而磷酸化下游与BMP特异作用的受体性蛋白SMAD1,从而激活细胞内的信号传导,调节软骨细胞的增殖、分化等〔21〕。研究表明,上调SMAD1蛋白表达,可促进软骨下骨再生修复;下调SMAD1蛋白表达,则会加速软骨细胞的降解、肥大,从而导致骨关节炎发生〔22〕。
Notch信号通路是一条高度保守的信号通路,广泛存在于无脊椎动物和哺乳动物中,由Notch受体(Notch1、2、 3、4)、配体(Delta-like1、3、4和Jagged1、2)及CSL蛋白等组成;可参与调控细胞的增殖、分化及凋亡进程,在调节软骨细胞的增殖与分化、维持软骨细胞的表型及平衡软骨的基质代谢方面发挥着重要的作用〔23,24〕。Notch信号通路对关节炎具有保护和破坏双重作用,即持续激活Notch信号通路会引起早期关节炎进一步发展,短暂的激活则能促进软骨基质的合成及抑制软骨的退变〔25〕;然而对于Notch信号通路的激活,研究表明只有当Notch受体与配体相结合时,Notch信号才能在细胞的增殖、分化、凋亡中发挥调控作用〔26〕。Jagged1、Jagged2作为激活Notch信号通路的关键配体,在启动Notch信号通路中扮演着不可或缺的角色,同时,有研究表明在骨关节炎软骨中Jagged1、Jagged2呈高表达状态〔27〕。
本研究说明,SMAD1蛋白的表达水平与KOA有很大的相关性。苗药五藤膏可通过促进软骨组织中SMAD1蛋白的表达来抑制KOA的病程进展,从而治疗KOA;同时,本研究结果也进一步说明Notch信号通路的下游基因Jagged1、Jagged2的表达水平与KOA的发生发展也有着密切的联系。苗药五藤膏可通过抑制软骨组织中Jagged1、Jagged2的表达来抑制KOA的病程进展,从而治疗KOA且其表达水平与KOA病程进展及软骨退变程度呈正相关。

